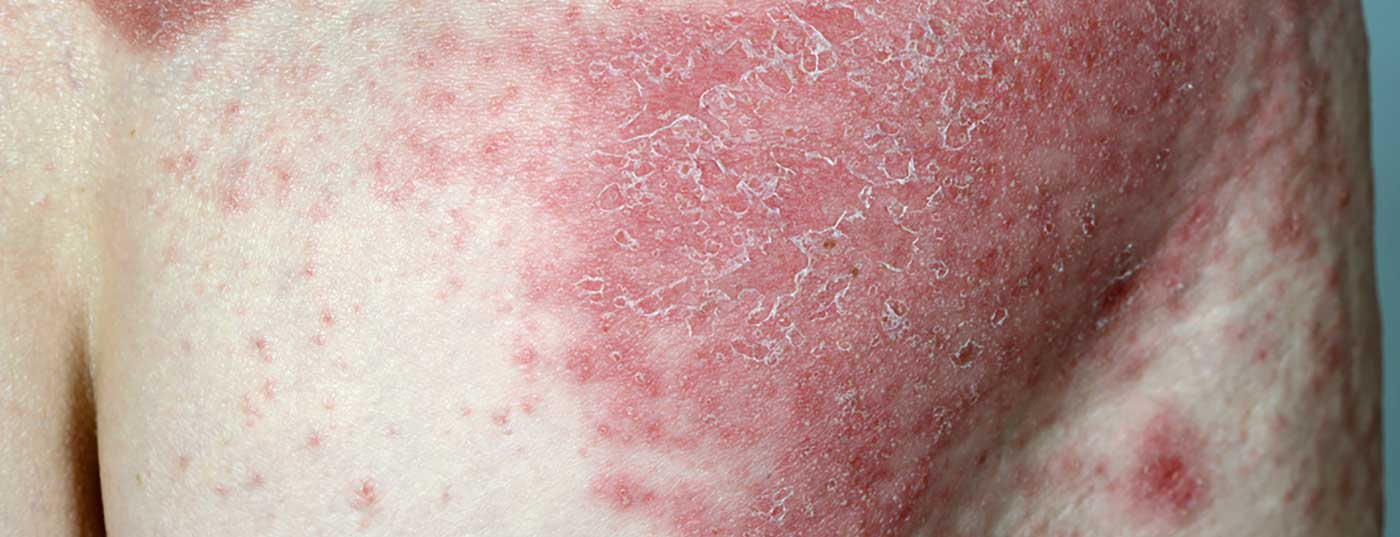
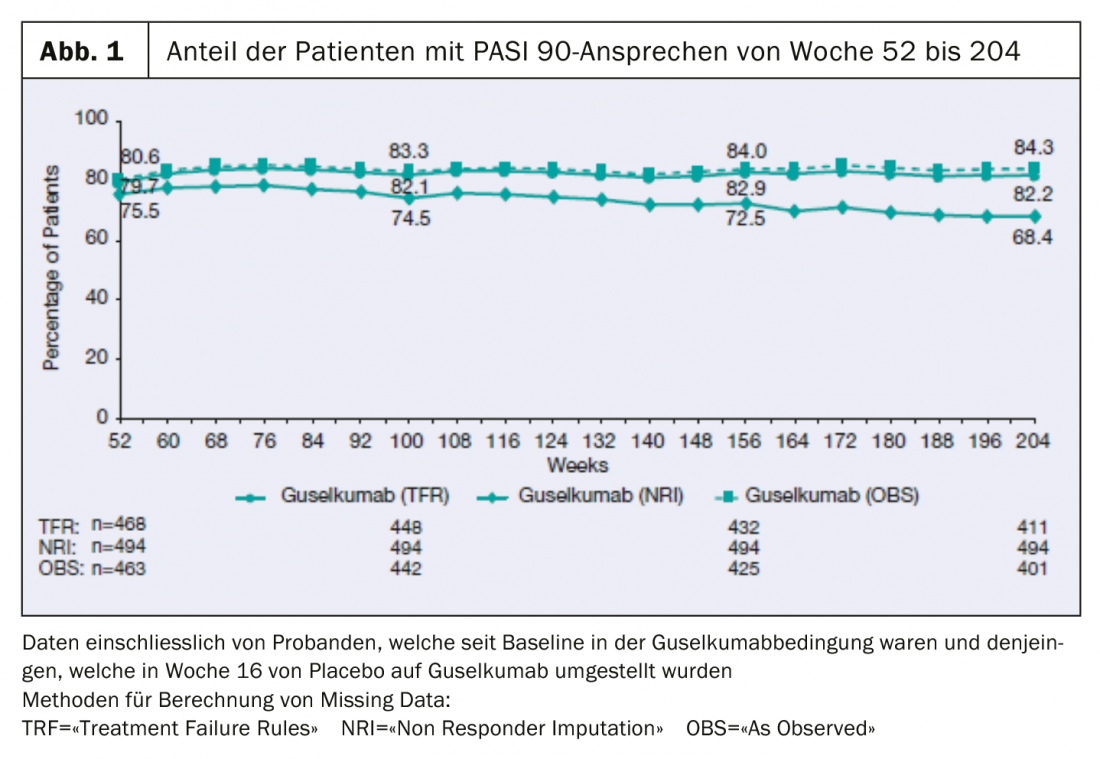
I dati a lungo termine dello studio clinico di fase III VOYAGE 1, presentati di recente, mostrano che l’84% dei pazienti continua a raggiungere il PASI-90 dopo 204 settimane.
L’anticorpo monoclonale guselkumab (TREMFYA®) è stato approvato in Svizzera dal 2018 per gli adulti con psoriasi a placche da moderata a grave che sono idonei alla terapia sistemica [1]. Nello studio pivotale VOYAGE 1 (n=837), guselkumab è stato significativamente superiore ad adalimumab e placebo in tutti gli endpoint primari (risposta PASI-90) e negli endpoint secondari chiave (IGA 0/1, risposta PASI-75).
Efficacia e tollerabilità elevate e sostenute
Sono ora disponibili i dati a quattro anni della fase in aperto dello studio multicentrico, randomizzato, in doppio cieco VOYAGE 1, che sono stati presentati alla 39esima Conferenza autunnale di dermatologia clinica a Las Vegas (USA) [2]: La percentuale di pazienti con PASI 90 è rimasta stabile fino alla settimana 204: 8 pazienti su 10 hanno mostrato una risposta PASI 90 con guselkumab in questo periodo. (Fig. 1). L’82% dei pazienti che hanno ricevuto TREMFYA® (guselkumab) nel gruppo combinato di pazienti inizialmente randomizzati alla condizione guselkumab o placebo con passaggio a guselkumab alla settimana 16, ha ottenuto un miglioramento di almeno il 90% dell’Indice di gravità dell’area della psoriasi (PASI 90) alla settimana 204. Inoltre, un punteggio IGA di 0 (senza lesioni) o 1 (quasi senza lesioni) era misurabile in questo momento della misurazione.
Guselkumab (TREMFYA®) è il primo anticorpo monoclonale interamente umano approvato che si lega selettivamente alla subunità p19 dell’interleuchina-23 (IL-23) e inibisce la sua interazione con il recettore IL-23 [1]. Questa sostanza blocca quindi il rilascio di queste citochine infiammatorie, che sono coinvolte nella formazione delle placche nella psoriasi. TREMFYA® è stato generalmente ben tollerato dai pazienti con psoriasi durante lo sviluppo clinico [3–5]. Non sono stati identificati nuovi segnali di sicurezza nel periodo in aperto di 4 anni [2].
Studio di follow-up di Fase III VOYAGE 1
I soggetti sono stati assegnati in modo casuale al basale a placebo, guselkumab o adalimumab. La fase di trattamento controllata con placebo è durata dalla settimana 0 alla 16. Successivamente, i pazienti nella condizione placebo sono stati passati a guselkumab fino alla settimana 48, ed è stato effettuato un confronto con il principio attivo adalimumab (settimane 0-48). I partecipanti allo studio sono stati randomizzati a ricevere guselkumab alla settimana 0 e quelli che sono passati dal placebo a guselkumab alla settimana 16 hanno ricevuto guselkumab alla settimana 48, a distanza di 8 settimane. Dalla settimana 52, tutti i partecipanti hanno ricevuto guselkumab. L’efficacia è stata valutata utilizzando l’Indice di Area e Severità della Psoriasi (PASI75/90/100) e i punteggi IGA (0=senza lesioni, 1=quasi senza lesioni). I dati mancanti sono stati calcolati con i seguenti metodi: NRI (“Non-Responder Imputation Rules”), TFR (“Treatment Failure”) e OBS (“As Observed”).
Fonte: Janssen-Cilag AG
Letteratura:
- Guida del soggetto Tremfya®, 02/2019, www.swissmedicinfo.ch, ultimo accesso 24.10.2019
- Griffiths CE, et al: Mantenimento della risposta con un trattamento continuo di guselkumab fino a 4 anni: risultati dello studio VOYAGE 1 di fase 3. Conferenza di dermatologia clinica Falls. Ottobre 2019; Las Vegas, USA.
- Blauvelt A, et al: Efficacia e sicurezza di guselkumab, un anticorpo monoclonale anti-interleuchina-23, rispetto ad adalimumab per il trattamento continuo di pazienti con psoriasi da moderata a grave: risultati dello studio VOYAGE 1 di fase III, in doppio cieco, controllato con placebo e comparatore attivo. J Am Acad Dermatol 2017; 76(3): 405-417.
- Reich K, et al: Efficacia e sicurezza di guselkumab, un anticorpo monoclonale anti-interleuchina-23, rispetto ad adalimumab per il trattamento di pazienti con psoriasi da moderata a grave con ritiro e ritiro randomizzato: risultati dello studio VOYAGE 2 di fase III, in doppio cieco, controllato con placebo e comparatore attivo. J Am Acad Dermatol 2017; 76(3): 418-431.
- Langley R, et al: Efficacia e sicurezza di guselkumab nei pazienti con psoriasi che hanno avuto una risposta inadeguata a ustekinumab: risultati dello studio randomizzato, in doppio cieco, di fase III NAVIGATE. Br J Dermatol 2018; 178(1): 114-123.
DERMATOLOGIE PRAXIS 2019; 29(6): 31 (pubblicato l’8.12.19, prima della stampa).