Nel terzo giorno del Congresso EULAR di quest’anno, sono state presentate novità nel campo della fibromialgia, dell’artrite idiopatica giovanile, dell’artrite psoriasica e dell’osteoartrite. Gli esperti di quattro Paesi diversi hanno presentato le attuali scoperte sulla patogenesi, le strategie diagnostiche e le forme di terapia per queste quattro malattie reumatiche.
Nella prima conferenza della Sessione calda 6, il Prof. Dr. med. José António P. da Silva, Portogallo, ha approfondito la fibromialgia. La ricerca mostra che i cambiamenti nel sistema nervoso centrale sono la causa della sofferenza. Di conseguenza, il cervello elabora i segnali del dolore in modo errato, il che porta a un’intensificazione della sensazione di dolore. Nei pazienti con fibromialgia, quindi, è necessario uno stimolo molto più debole rispetto alle persone sane per provocare il dolore [1]. “Nella gestione di questa malattia, per i medici valgono le stesse regole di tutte le condizioni croniche(Tab. 1).
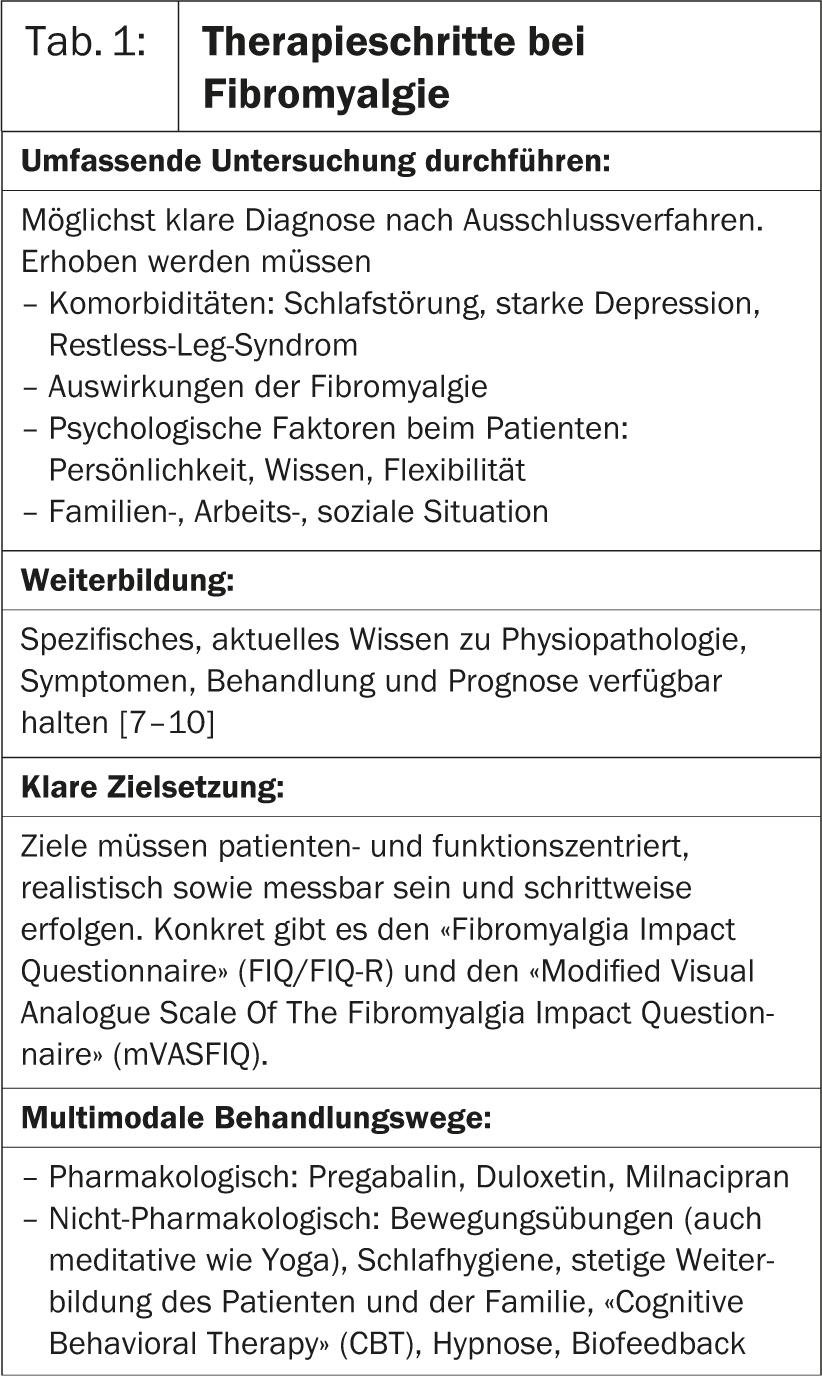
Deve farlo:
- Eseguire un’indagine completa
- istruirsi ulteriormente
- Stabilire obiettivi terapeutici chiari
- Trovare percorsi di trattamento multimodali, cioè opzioni di trattamento farmacologico, ma anche non farmacologico.
- Monitorare attentamente la risposta alla terapia e i progressi o le battute d’arresto.
- trarre conclusioni per la ridefinizione della terapia.
Il medico deve anche dimostrare di avvicinarsi all’esperienza individuale di malattia del paziente con una mente aperta e senza pregiudizi, e di prendere davvero sul serio il dolore del paziente”, dice il Prof. da Silva. Secondo la sua stessa valutazione, la fibromialgia è indotta dallo stress, che porta alla tensione muscolare e al dolore muscolare. È quindi importante chiedere con precisione le aspettative del paziente e valutare obiettivi terapeutici realistici in collaborazione, in modo che dalla terapia derivi il minor stress possibile [2].
Il pregabalin 450 mg/d si è dimostrato efficace negli studi (sollievo dal dolore: 46,9% vs. placebo: 31,5%), ma accompagnato da vari effetti collaterali come vertigini, affaticamento, secchezza delle fauci, aumento di peso ed edema periferico. Un paziente su quattro ha interrotto la terapia per questo motivo (NNH: 6) [3]. Duloxetina e milnacipran offrono solo un piccolo beneficio nel sollievo dal dolore. Anche i problemi di sonno, la stanchezza e la qualità di vita (QOL) non sono migliorati in modo sostanziale rispetto al placebo [4].
Poiché la depressione è comune come comorbidità nella fibromialgia, possono essere efficaci anche fluoxetina, paroxetina o sertralina. Case et al. (2012) ha mostrato un sollievo dal dolore con effetti collaterali minori con la terapia antidepressiva in un piccolo gruppo di pazienti. Tuttavia, un numero notevole di partecipanti ha interrotto la terapia proprio a causa dello scarso equilibrio tra effetti ed effetti collaterali [5].
“Come alternativa non farmacologica, si può prendere in considerazione la Terapia Cognitivo Comportamentale (CBT), che allevia il dolore e riduce la depressione [6]”, afferma il Prof. da Silva.
Artrite idiopatica giovanile
Pierre Quartier, MD, Parigi, ha parlato dell’artrite idiopatica giovanile (JIA). “Esistono diversi sottotipi: artrite idiopatica giovanile sistemica (nota anche come malattia di Still), poliartrite giovanile, oligoartrite, artrite psoriasica e altri. L’esordio di questa malattia avviene sempre prima dei 16 anni”, afferma il dottor Quartier. La JIA sistemica (SJIA), ad esempio, è una forma particolarmente grave di reumatismo infantile. I criteri sono: esordio <16 anni, durata >6 settimane, nessuna diagnosi differenziale, febbre ≥15 giorni e una o più delle seguenti condizioni: Rash, linfoadenopatia, epatomegalia o splenomegalia, infiammazione delle membrane sierose.
“In ogni caso, il reumatologo pediatrico deve lavorare in un team multidisciplinare. Ciò significa che i genitori del bambino, il medico di famiglia, gli assistenti della scuola o dell’asilo nido, ecc. devono essere strettamente coinvolti nella terapia. Se possibile, si raccomanda un trattamento non aggressivo. Vengono utilizzati farmaci antinfiammatori non steroidei (FANS), iniezioni articolari (corticosteroidi), fisioterapia e varie altre forme di cura”, afferma il dottor Quartier. “Sono attualmente in corso numerosi studi clinici sulle opzioni farmacologiche per le forme di JIA(Tab. 2). Nel complesso, il trattamento della JIA può essere considerato un work-in-process”.
Artrite psoriasica
“Quali sono le novità nel campo dell’artrite psoriasica?”. Questa domanda ha trovato risposta nella conferenza di Juan J. Gomez-Reino, MD, Santiago. Studi recenti sostengono l’evidenza che esiste un legame tra un elevato IMC (obesità) e lo sviluppo dell’artrite psoriasica (PsA) nei pazienti con psoriasi conclamata [11, 12]. Anche il fumo è stato confermato come un importante fattore di rischio per la psoriasi [13].
Per quanto riguarda gli strumenti diagnostici nella PsA precoce, i criteri del Gruppo di Studio CASPAR sono più sensibili dei criteri di Moll e Wright [14]. Inoltre, la risonanza magnetica e gli ultrasuoni (US) stanno diventando sempre più importanti nella PsA. Aumentano la comprensione di questa malattia e quindi contribuiscono a migliorare la diagnosi e il controllo del trattamento. Il punteggio PsAMRI di nuova concezione viene già utilizzato per gli studi controllati randomizzati. È molto adatto per la misurazione oggettiva dell’attività della malattia. “La risonanza magnetica multiarticolare del corpo intero (WBMJ-MRI) fornisce una sorta di istantanea dell’infiammazione nelle articolazioni colpite dalla PsA [15]”, ha spiegato il dottor Gomez-Reino. “Inoltre, la risonanza magnetica può aiutare a distinguere l’artrite reumatoide dalla PsA. Questo è particolarmente vero in pazienti selezionati in cui gli esami clinici, di laboratorio e radiografici convenzionali non hanno dato risultati chiari”.
Nel trattamento, i diversi gradi di efficacia e le prove della tradizionale
farmaci antireumatici modificanti la malattia (DMARDs), sono riassunti nella Tabella 3.
Nel complesso, secondo il dottor Gomez-Reino, emergono i seguenti punti rilevanti per la pratica:
- Le vie patogenetiche appena identificate vengono considerate come bersagli terapeutici nella PsA.
- L’obesità e il fumo sono fattori di rischio reversibili per la PsA e per la risposta alla terapia.
- Gli Stati Uniti e la risonanza magnetica hanno un grande potenziale per la diagnosi della PsA.
- L’inibitore orale della PDE-4 apremilast, e possibilmente i biologici che interferiscono con il percorso IL-23/IL-17, potrebbero essere un trattamento alternativo per i pazienti con PsA per i quali gli inibitori del TNF non funzionano bene.
- I fattori di rischio cardiovascolare (dislipidemia, ipertensione, obesità, diabete mellito, fumo) sono più diffusi nei pazienti con PsA rispetto ai controlli [16].

Osteoartrite
Secondo la Prof. Dr. med. Margreet Kloppenburg, di Leiden, due argomenti sono di particolare interesse al momento:
- Il ruolo dell’osso subcondrale nell’osteoartrite: la molecola di segnalazione delle citochine “fattore di crescita trasformante β” (TGF-β) nell’osso subcondrale potrebbe essere un possibile bersaglio terapeutico.
- La terapia non farmacologica. Nel trattamento, la terapia fisica in particolare può essere efficace. Tuttavia, solo alcune forme di essa, come dimostrato da una meta-analisi di Wang et al. (2012) mostra: Gli esercizi aerobici e in acqua hanno ridotto la disabilità. Gli esercizi aerobici e di forza e gli ultrasuoni hanno ridotto il dolore e migliorato la funzionalità. Quindi una forma di terapia da sola non potrebbe migliorare tutte le limitazioni allo stesso tempo. La diatermia, l’ortopedia e la stimolazione magnetica erano inefficaci [17].
“Siamo ancora nel processo di comprensione di questa malattia”, afferma il Prof. Kloppenburg. “Per esempio, la densità minerale ossea (BMD) è associata alla patogenesi dell’osteoartrite: Una variazione della BMD sistemica è associata alla progressione della malattia. Anche il ruolo dell’osso deve essere esaminato più da vicino. Uno studio recente dimostra che la somministrazione di bifosfonati può ridurre il dolore [18].”
Altri desideri attuali riguardano nuove strategie diagnostiche. Secondo il Prof. Kloppenburg, la risonanza magnetica non è adatta alla pratica clinica, perché nella stragrande maggioranza delle persone che non mostrano evidenza radiografica di osteoartrite, le lesioni possono essere rilevate nelle fasi intermedie e avanzate della vita [19].
“Inoltre, il ranelato di stronzio, che è in realtà un farmaco per l’osteoporosi, ha dimostrato di essere efficace nella terapia. Un’analisi post-hoc di uno studio sull’osteoporosi mostra che il ranelato di stronzio potrebbe ridurre la progressione radiografica e il dolore alla schiena nell’osteoartrite spinale rispetto al placebo [20]. Risultati simili esistono per l’osteoartrite del ginocchio. Nel complesso, il farmaco è stato ben tollerato [21]”, ha spiegato il Prof. Kloppenburg.
Fonte: EULAR, 12-15 giugno 2013, Madrid
Letteratura:
- Fibro Collaborative: Mayo Clin Proc 2012; 87: 488.
- Paiva, Jones: Best Pract Res Clin Rheumatol 2010; 24: 341-352.
- Tzellos, et al: J Clin Pharm Ther 2010 Dec; 35(6): 639-56.
- Hauser, et al: The Cochrane Library 31 gennaio 2013.
- Case, et al: CNS Drugs 2012; 26(4): 297-307.
- Bernardy, et al: J Rheumatol 2010 Oct; 37(10): 1991-2005.
- Burckhardt, et al: J Rheumatol 1994; 21: 714-720.
- King, et al: J Rheumatol 2002; 29: 2620-2627.
- Rooks, et al: Arch Intern Med 2007; 167: 2192-2200.
- White, et al: Arthritis Rheum 2002; 47: 260-265.
- Wenqing, et al: Ann Rheum Dis 2012; 71: 1267-1272.
- Jon Love, et al: Ann Rheum Dis 2012; 71(8): 1273-1277.
- Li, et al: American Journal of Epidemiology 2011; 175(5): 402-413.
- Coates, et al: Arthritis Rheum 2012 Oct; 64(10): 3150-5.
- Coates, et al: Best Pract Res Clin Rheumatol 2012; 26(6): 805-22.
- Jamnitski, et al: Ann Rheum Dis 2013; 72: 211-216.
- Wang, et al: Ann Intern Med 2012 Nov 6; 157(9): 632-44.
- Laslett, et al: Ann Rheum Dis. doi: 10.1136/annrheumdis-2012-202989.
- Guermazi, et al: BMJ 2012; 345. doi: http://dx.doi.org/10.1136/bmj.e5339 (Pubblicato il 29 agosto 2012).
- Bruyere, et al: Ann Rheum Dis 2008; 67: 335-339.
- Reginster, et al: Ann Rheum Dis 2013; 72: 179-186.












