Da oltre un decennio, i biomarcatori nella LCR e, più recentemente, nella voce hanno veramente rivoluzionato la diagnosi della malattia di Alzheimer, consentendo un rilevamento più preciso e accurato della patologia. Le linee guida 2024, con il loro approccio integrato clinico-biologico, offrono una procedura più completa per la diagnosi e la gestione personalizzata della malattia, con percorsi specifici per ogni fase della patologia.
Può sostenere il test ECM nella nostra piattaforma di apprendimento dopo aver esaminato i materiali consigliati. Clicchi sul seguente pulsante:
La malattia di Alzheimer (AD) è la principale causa di demenza nel mondo e colpisce più di 50 milioni di persone. Questa patologia neurodegenerativa progressiva è caratterizzata da problemi di memoria, codifica e funzioni cognitive causati dall’accumulo di placche amiloidi e grovigli neurofibrillari nel cervello. Storicamente, la diagnosi si basava principalmente sull’osservazione dei sintomi clinici, spesso confermati post-mortem dall’analisi cervicale. Tuttavia, con l’avvento di tecnologie moderne come la neuroimmagine e l’analisi dei biofluidi, la MA è stata progressivamente ridefinita come una patologia biologica [1]. L’introduzione di biomarcatori, rilevabili nei fluidi corporei come il liquido cerebrospinale (LCR) e, più recentemente, nelle urine, ha cambiato in modo significativo il modo in cui la malattia viene diagnosticata, consentendo un rilevamento sempre più preciso della malattia negli studi di ricerca. Nel 2018, l’Institut National du Vieillissement (NIA) e l’Association Alzheimer (AA) hanno introdotto il quadro A/T/N (Amyloïde/Tau/Neurodégénérescence), che consente di diagnosticare la fisiopatologia della MA sulla base di biomarcatori specifici [2]. Questo quadro ha quindi trasformato la critériology del MA e la sua diagnosi. Questo articolo si propone di esaminare questa transizione del MA da un’interpretazione clinica a una validazione clinico-biologica, con un’attenzione particolare ai biomarcatori più importanti rilevati nel LCR e nella voce, nonché alle nuove linee guida 2024, che incorporano un approccio clinico-biologico complementare per una diagnosi precisa [3].
I biomarcatori nel liquido cefalo-rachidiano (LCR)
Il liquido cefalo-rachidiano è un fluido biologico essenziale per lo studio dei biomarcatori del MA. Riflette direttamente i cambiamenti patologici che si verificano nella cervice. Tra i biomarcatori più importanti misurati nella LCR ci sono l’amiloide-β 42 (Aβ42), la proteina tau totale (t-tau) e la proteina tau fosforilata (p-tau).
Amiloide-β 42 (Aβ42) e il rapportoAβ42/Aβ40: L’amiloide-β 42 (Aβ42) è una proteina clé che forma le placche amiloidi nel cervello dei pazienti affetti da MA. Si osserva una diminuzione della concentrazione di Aβ42 nel LCR a causa del suo accumulo sotto forma di placche. Questa diminuzione è un indicatore precoce della patologia amiloide. [4,5] Il rapporto Aβ42/Aβ40 è un indicatore utilizzato per migliorare la precisione della diagnosi. Mentre l’Aβ42 diminuisce nella LCR a causa della formazione di placche, i livelli di Aβ40, una forma di proteina amiloide meno specifica della patologia, rimangono stabili. Il rapporto Aβ42/Aβ40 permette di correggere le variazioni individuali dei livelli di amiloide-β e di migliorare la sensibilità e la specificità della diagnosi della MA. Un rapporto inferiore indica un accumulo di amiloide significativo e costituisce un indicatore affidabile della malattia.
La proteina Tau e la sua iperfosforilazione: La tau totale (t-tau) nel LCR è un marcatore generale della neurodegenerazione. La proteina tau, in condizioni normali, è coinvolta nella stabilizzazione dei microtubuli dei neuroni. Tuttavia, nella MA, i valori elevati di tau totale nel LCR indicano una degradazione neuronale. Anche se la t-tau è un indicatore della neurodegenerazione [6], non è specifica della MA e può essere elevata in altre patologie neurodegenerative o dopo una lesione cerebrale aiguë. La tau fosforilata (p-tau) è una forma modificata della proteina tau, in cui i gruppi di fosfati vengono aggiunti a siti specifici, favorendo così la formazione di strutture neurofibrillari, una caratteristica tipica della MA. Le principali forme di p-tau rilevate nel LCR sono p-tau181, p-tau217 e p-tau231. Questi biomarcatori sono più specifici della MA che della tau totale.
- P-tau181 è uno dei primi biomarcatori tau fosforilati identificati nella malattia di Alzheimer (MA). Il suo aumento nella LCR riflette i cambiamenti patologici legati agli enchevêtrements neurofibrillaires, che sono una caratteristica tipica della MA [7]. p-tau181 è un biomarcatore sensibile e relativamente specifico della MA, che permette di differenziare questa malattia da altri disturbi neurodegenerativi. Tuttavia, anche se associato principalmente alla MA, può anche essere molto elevato in altre forme di demenza.
- P-tau217 è più strettamente legato alla patologia della MA rispetto a p-tau181. [8,9] Studi recenti hanno dimostrato che il p-tau217 ha una migliore correlazione con la formazione di placche amiloidi e di enchevêtrements tau. Grazie alla sua maggiore sensibilità e specificità, il p-tau217 potrebbe progressivamente sostituire il p-tau181 come biomarcatore di riferimento per la diagnosi preclinica, soprattutto nelle fasi iniziali e tardive della malattia.
- Il P-tau231 è un biomarcatore ancora in fase di studio, ma può fornire informazioni supplementari sugli stadi intermedi del MA. [10,11] La sua utilità potrebbe risiedere principalmente nel monitoraggio della transizione tra il decadimento cognitivo lieve (MCI) e la demenza. Sebbene sia un promotore, p-tau231 richiede ancora ulteriori ricerche per convalidare la sua specificità e il suo ruolo potenziale nella pratica clinica.
- MTBR-Tau243: L’MTBR-Tau243 è un biomarcatore specifico e promettente per la rilevazione della patologia tau nella malattia di Alzheimer (MA). Questo biomarcatore è caratterizzato dalla capacità di rilevare in modo specifico gli aggregati tau insolubili, che sono fortemente associati ai sintomi clinici del MA, in particolare al declino cognitivo. Studi recenti hanno dimostrato che il MTBR-Tau243, misurato nel liquido cefalorachidiano (LCR), è il marcatore che risulta essere il più corrélé à l’imagerie tau-PET, superando altre forme di tau fosforilata come p-tau181 e p-tau217. [12] Inoltre, mostra un aumento significativo durante le fasi avanzate della malattia, il che rappresenta un indicatore rilevante per monitorare l’evoluzione della patologia tau.
Tecnologie avanzate per il rilevamento delle proteine nel plasma
Il rilevamento della proteina tau fosforilata (p-tau) nel plasma rappresenta uno dei più promettenti progressi recenti nel campo dei biomarcatori della malattia di Alzheimer (AD). Storicamente, la misurazione della p-tau nel plasma è stata limitata a causa della sua concentrazione molto bassa e della presenza di altre proteine circolanti. [16–20] Tuttavia, le tecnologie ultrasensibili come SIMOA (utilizzata da Quanterix) e gli immunodosaggi automatizzati (sviluppati da Roche e Fujirebio) hanno superato questi ostacoli. Ora permettono di rilevare con precisione biomarcatori come p-tau181, p-tau217 e il rapporto Aβ42/Aβ40, a concentrazioni molto basse. Tra questi biomarcatori, il p-tau217 si distingue per la sua capacità di classificare meglio la patologia amiloide e tau, superando altri biomarcatori come Aβ42/Aβ40, che spesso sono meno sensibili a causa delle variazioni di pH. Questi test sono sempre più utilizzati, non solo nella ricerca, ma anche per una diagnosi preclinica più accessibile e meno invasiva. Altre aziende, come C2N Diagnostics, hanno ottimizzato i test di screening per il rilevamento di Aβ42/Aβ40 utilizzando la spettrometria di massa. Sebbene questo biomarcatore presenti una precisione inferiore rispetto al p-tau217, rimane fondamentale per valutare il carico di amiloide cervicale, ma la sua interpretazione deve essere associata ad altri biomarcatori per garantire una valutazione clinica affidabile. Sebbene queste innovazioni abbiano mostrato un grande potenziale per vari biomarcatori, richiedono ancora un’ulteriore validazione prima di poter essere ampiamente utilizzate nella pratica clinica. Tuttavia, con le dovute precauzioni, queste tecnologie potrebbero essere progressivamente integrate nella pratica clinica, offrendo prospettive promettenti per una diagnosi precoce e meno invasiva e potenzialmente applicabile alla depilazione di massa in futuro.
I biomarcatori sanguigni
Negli ultimi anni, i biomarcatori sanguigni sono diventati sempre più importanti come alternativa non invasiva alle analisi del liquido cefalorachidiano (LCR). La loro facilità d’uso e il loro potenziale di deposito li rendono uno strumento prezioso per la diagnosi della malattia di Alzheimer (AD). Tra i biomarcatori più studiati, troviamo le proteine tau fosforilate (p-tau), la catena leggera dei neurofilamenti (NfL), le proteine acido gliofibrillari (GFAP), nonché i biomarcatori amiloidi come il rapporto Aβ42/Aβ40 nel plasma. [17] Sebbene questi biomarcatori offrano prospettive interessanti, le loro prestazioni variano a seconda della tecnologia utilizzata e dello stadio della malattia.
Amiloide-β nel sangue: un’alternativa promettente ma limitata: Il rilevamento delle proteine amiloidi nel sangue, in particolare il rapporto Aβ42/Aβ40, rappresenta un punto di svolta per la diagnosi non invasiva del MA. [16] Tuttavia, recenti studi comparativi mostrano che i test basati su Aβ42/Aβ40 sono globalmente meno efficienti di quelli basati sulle proteine p-tau217 . Infatti, le fluttuazioni dovute a fattori periferici non correlati alla patologia cervicale, come la presenza di APP in diversi tessuti, complicano l’interpretazione di questo biomarcatore. Tecnologie come SIMOA e Lumipulse consentono di misurare questo rapporto con precisione, ma le variazioni sistemiche possono ridurre la sua specificità. Sebbene i biomarcatori amiloidi possano essere utilizzati per valutare il carico amiloide cervicale, spesso devono essere combinati con altri biomarcatori per migliorare l’accuratezza della diagnosi.
Le protéines tau phosphorylées (p-tau): différences technologiques et implications cliniques: Le forme di p-tau misurate nel sangue, come p-tau181, p-tau217 e, in alcuni casi, p-tau231, svolgono un ruolo cruciale nella diagnostica precoce del MA. Secondo studi recenti, il p-tau217 è uno dei biomarcatori più promettenti, con una migliore accuratezza diagnostica rispetto al p-tau181, soprattutto per differenziare il MA da altre forme di depressione.
- P-tau181: nonostante sia una delle prime forme utilizzate per la diagnostica sanguigna, il P-tau181 presenta una sensibilità limitata, soprattutto nelle fasi più precoci della malattia [8]. [21] Test come quelli proposti da Roche e Quanterix mostrano prestazioni accettabili, ma inferiori al p-tau217 in termini di correlazione con i risultati della PET amiloide.
- [22]P-tau217: secondo studi recenti, il p-tau217 rilevato con tecnologie come C2N e Fujirebio Lumipulse offre una maggiore sensibilità e specificità per il rilevamento della patologia amiloide, superando altri biomarcatori in test comparativi. [21] Le prestazioni del p-tau217 sono particolarmente elevate nelle fasi precliniche della malattia, il che lo rende un elemento essenziale per una diagnosi precoce.
Neurofilament léger (NfL): un marcatore non specifico di neurodégénérescence: NfL è un marcatore di neurodégénérescence non specifico, misurato nel sangue. Anche se i livelli di NfL aumentano in diverse malattie neurodegenerative, tra cui la MA, le sue prestazioni sono inferiori a quelle del p-tau. Lo studio mostra che test come il Roche NeuroToolKit e il Quanterix Neurology 4-Plex consentono di rilevare la NfL con una buona sensibilità, ma con una specificità inferiore rispetto alla p-tau217. L’NfL rimane comunque un ottimo marcatore per monitorare l’evoluzione della degenerazione neuronale e per valutare i trattamenti neuroprotettivi.
Gliofibrillaire acide protéine (GFAP): un marqueur de l’inflammation gliale: GFAP riflette l’infiammazione gliale legata all’attivazione degli astrociti nel cervello. Lo studio dimostra che la GFAP è un marcatore promotore per il rilevamento dell’infiammazione associata alla patologia amiloide, con aumenti significativi osservati nei pazienti positivi all’amiloide. Tuttavia, come la NfL, la GFAP non è specifica per la MA e può essere osservata in altre patologie neuroinfiammatorie. [25] Le tecnologie Roche e Quanterix permettono di misurare la GFAP con una grande precisione, e la combinazione con il p-tau migliora la valutazione clinica.
Nota: il gene APOE, e in particolare l’allele ε4, è il principale fattore di rischio genetico per il MA. [26,27] I portatori di Allerle ε4 sono a rischio di sviluppare la malattia. Allerle è anche associato a livelli più elevati di p-tau e placche amiloidi, il che aumenta la probabilità di una rapida progressione della patologia. Inoltre, i portatori di APOE ε4 presentano spesso livelli elevati di GFAP, che indicano una neuro-infiammazione più marcata, il che suggerisce che questo allele contribuisce non solo all’accumulo di amiloide, ma anche all’infiammazione associata al MA. La considerazione della genetica può servire anche come indicatore per interpretare i risultati di un’analisi del plasma di un paziente sintomatico.
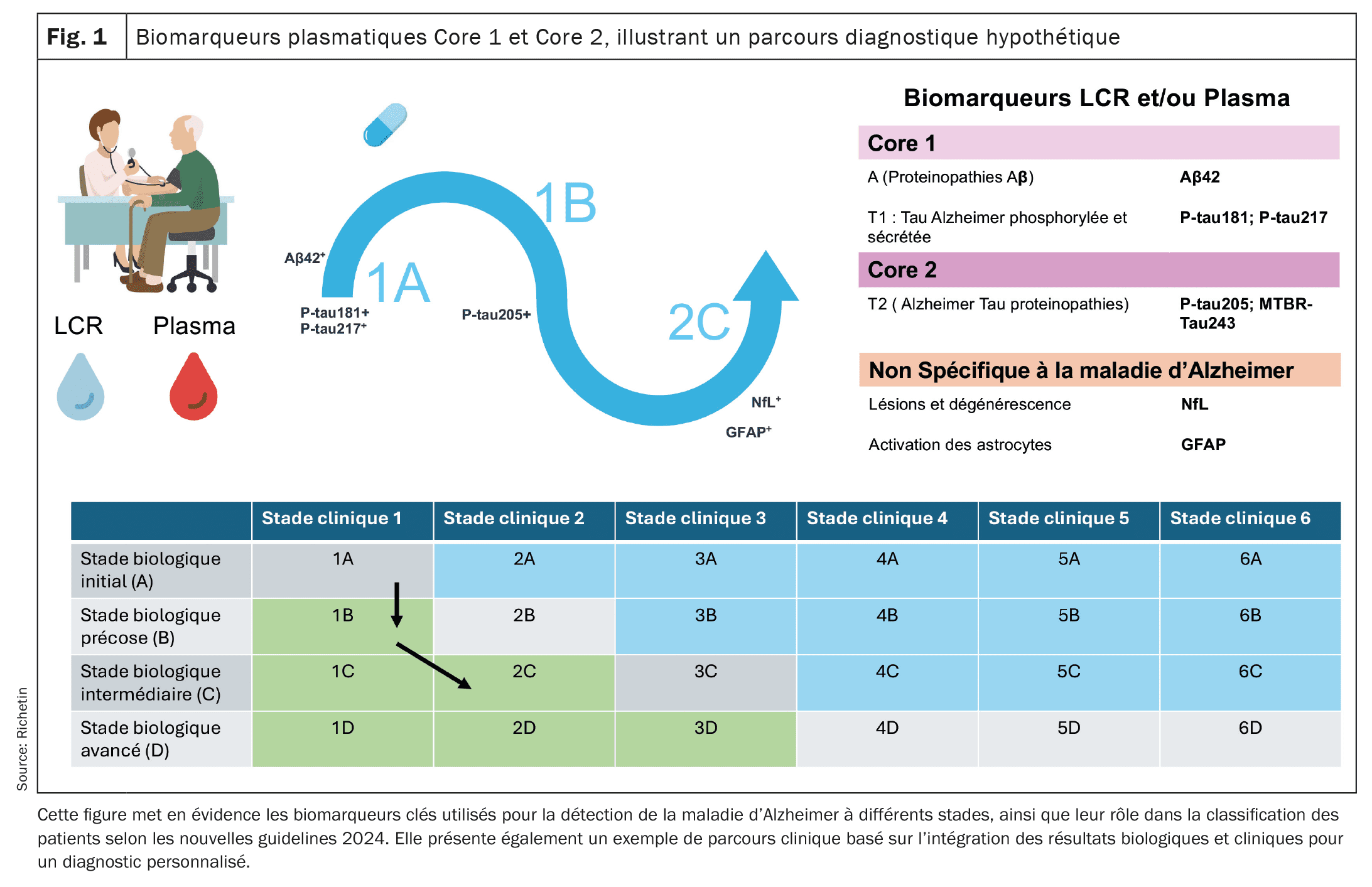
| È quindi in arrivo un nuovo concetto di percorsi diagnostici, che sarà probabilmente perfezionato nei prossimi anni. D’ora in poi, i percorsi classificheranno i pazienti in base alle anomalie dei biomarcatori Core 1 e Core 2, nonché alla presenza o all’assenza di sintomi clinici, al fine di adattare la diagnosi e il follow-up. Queste nuove linee guida potrebbero fornire un quadro più preciso per la valutazione diagnostica e il follow-up dell’evoluzione della MA in modo più personalizzato, integrando biomarcatori plasmatici, LCR e valutazioni cliniche. Inoltre, facilitano un onere adattato a ogni fase della malattia, dalla fase preclinica alle fasi avanzate della neurodegenerazione. |
Dalla ricerca alla diagnosi?
Negli ultimi decenni, i progressi nella ricerca sui biomarcatori della malattia di Alzheimer hanno portato a una transizione cruciale verso l’applicazione clinica e una diagnostica di precisione sempre più accessibile. I primi studi si sono concentrati sull’identificazione della patologia amiloide e della proteinopatia tau nel liquido cerebrospinale (LCR), portando allo sviluppo di test in grado di rilevare queste anomalie con grande precisione. Questi biomarcatori, inizialmente utilizzati nella ricerca, hanno permesso di confermare la presenza di cambiamenti fisiopatologici prima dei sintomi. Tuttavia, l’accesso a questi test era limitato ai centri di ricerca specializzati, a causa delle tecniche invasive e costose utilizzate. Con l’introduzione dei biomarcatori plasmatici, in particolare le forme p-tau e il rapporto Aβ42/Aβ40, la ricerca ha compiuto un passo decisivo verso una più ampia applicazione clinica. La capacità di rilevare questi biomarcatori nel corpo, grazie a tecnologie ultrasensibili, ha aperto la porta a un rilevamento clinico non invasivo e più facilmente realizzabile. Queste innovazioni potrebbero consentire di confermare facilmente la fisiopatologia del MA nei pazienti con un quadro clinico suggestivo e di identificare le persone asintomatiche e a rischio di sviluppare il MA, anche prima della comparsa dei sintomi cognitivi. Tuttavia, ci sono ancora sfide per quanto riguarda la standardizzazione dei test, la loro variabilità (variazione circadiana, funzione renale, funzione vascolare), la loro disponibilità in grandi centri e l’addebito dei costi, in particolare per il rimborso dei test sul plasma. La progressiva integrazione dei biomarcatori nei percorsi di cura quotidiani, in combinazione con le tecnologie di imaging come la PET amiloide e la tau-PET, consente non solo una diagnosi più accurata, ma anche una migliore valutazione della progressione della malattia. Questo passaggio dalla ricerca alla clinica rappresenta un importante progresso per la medicina personalizzata e potrebbe consentire strategie di prevenzione di secondo o terzo livello, a seconda dello stadio della malattia.
Verso un approccio clinico-biologico più integrato
[16]Nel 2024, l’Institut National du Vieillissement (NIA) e l’Associazione Alzheimer hanno proposto nuove linee guida basate su un approccio che combina valutazioni cliniche e biologiche per migliorare la diagnosi e il monitoraggio della progressione della malattia di Alzheimer (MA). Queste linee guida sono organizzate intorno a due categorie di biomarcatori: Core 1 e Core 2, oltre a diversi percorsi diagnostici (1A, 1B, ecc.), che consentono di classificare i pazienti in base all’evoluzione della loro patologia. I biomarcatori del Core 1 misurano direttamente la patologia amiloide e tau. Comprendono indicatori come il rapporto bêta-amiloide Aβ42/Aβ40 e le forme di tau fosforilata (p-tau181, p-tau217). Queste anomalie appaiono nelle prime fasi della malattia, spesso in correlazione con i risultati dell’imaging amiloide PET, facilitando così una diagnosi preliminare prima della comparsa dei sintomi clinici. I biomarcatori plasmatici, in particolare il p-tau217 e il p-tau181, si sono dimostrati utili per rilevare queste anomalie nel plasma, consentendo un rilevamento più ampio e meno invasivo. Tuttavia, l’interpretazione di questi risultati deve essere associata a una valutazione clinica approfondita. I biomarcatori del Core 2 riflettono il processo di neurodégénérescence e protéinopathie tau plus avancée, come la MTBR-tau243. Diventano anormali nelle fasi più avanzate del MA, in associazione diretta con la comparsa di sintomi cognitivi. I biomarcatori come la catena leggera del neurofilamento (NfL) e la proteina acida gliofibrillare (GFAP), rilevati nel liquido seminale e cerebrospinale (LCR), forniscono informazioni precise sulla degenerazione neuronale e sull’infiammazione, svolgendo un ruolo cruciale nella valutazione della progressione della malattia e nell’adattamento delle strategie terapeutiche.Proposizione di uno scenario ipotetico per il percorso diagnostico e terapeutico di un paziente affetto da malattia di Alzheimer
Étape 1: Depistage dans un centre de la memoire (Parcours 1A): il signor K., 62 anni, si consulta durante una visita di routine senza sintomi cognitivi percepibili. Considerando la sua storia familiare di malattia di Alzheimer, sarebbe orientato a una valutazione preliminare presso un centro della memoria. Un test sanguigno potrebbe rivelare livelli anormalmente elevati di p-tau217 e un rapporto ridotto Aβ42/Aβ40, che sono potenziali indicatori di una patologia amiloide. Questi risultati sono stati confermati da un’analisi del liquido cefalorachidiano (LCR), che ha evidenziato un accumulo anormale di amiloide e di proteine tau. In questa fase, il signor K. non presentava alcun sintomo clinico, ma i suoi biomarcatori Core 1 (p-tau e Aβ) potevano indicare una patologia della malattia di Alzheimer in fase preclinica (decorso 1A). Dato il rilevamento preclinico di questa patologia amiloide, sarebbe ipotizzabile proporre una terapia anti-amiloide come lecanemab o donanemab per prevenire la formazione di placche amiloidi nel cervello. Questi trattamenti, somministrati in fase preclinica, potrebbero avere l’obiettivo di rallentare la progressione dei sintomi cognitivi gravi.
Étape 2: Apparizione di problemi cognitivi gravi (Parcours 1B): Due anni più tardi, il signor K. potrebbe iniziare a manifestare dei disturbi della memoria più gravi, come ad esempio degli oublis de rendez-vous. Si procederà quindi a una rivalutazione clinica, che comprenderà una nuova serie di analisi del sangue e un test lombare. I risultati potrebbero mostrare anomalie persistenti nei biomarcatori del core 1, confermando la continuità della patologia amiloide e tau. I test neuropsicologici potrebbero rivelare un leggero deterioramento cognitivo. In questa fase, il signor K. è entrato nel decorso 1B, caratterizzato dalla presenza di lievi problemi cognitivi (decadimento cognitivo lieve, o MCI) associati a biomarcatori anormali. Questo sviluppo potrebbe giustificare un’intensificazione della sorveglianza e un aumento del potenziale della terapia anti-amiloide per migliorare la prevenzione di sintomi più gravi. Questi trattamenti continuerebbero ad essere somministrati per rallentare la progressione verso una malattia conclamata.
Étape 3: Evoluzione verso una neurodégénérescence avancée (Parcours 2C): Cinque anni dopo la diagnosi iniziale, i sintomi del signor K. si sono aggravati. Poteva presentare problemi cognitivi più gravi che influivano sulle sue attività quotidiane, segnando così la transizione verso una demenza più avanzata. È stata effettuata una nuova serie di analisi dei biomarcatori, che ha rivelato anomalie nei biomarcatori Core 2, come la variazione p-tau205. Inoltre, i biomarcatori di neurodégénérescence, come NfL (catena leggera del neurofilamento) e GFAP (proteina acida fibrillare), possono indicare la neuroinfiammazione e la distruzione neuronale attiva. Un’immagine tau-PET potrebbe mostrare un maggiore accumulo di tau nelle regioni associate alla cognizione. In questa fase, il signor K. si trovava nel decorso 2C, con una marcata neurodégénérescence. Il piano di trattamento si è concentrato sulla gestione dei sintomi cognitivi e comportamentali, con una combinazione di trattamenti sintomatici, assistenza personalizzata e maggiore sostegno alla famiglia, al fine di mantenere la qualità di vita del paziente.
Conclusione: Questo scenario ipotetico evidenzia l’importanza della pre-diagnosi mediante biomarcatori sanguigni e LCR nella malattia di Alzheimer. Dimostra inoltre che l’introduzione di farmaci anti-amiloidi potrebbe aiutare a rallentare la progressione della malattia prima della comparsa dei sintomi. Il monitoraggio continuo dei biomarcatori, unito alle valutazioni neuropsicologiche, consente di adattare gli interventi terapeutici in base all’evoluzione biologica e clinica, garantendo così un approccio personalizzato al paziente.
Vantaggi clinici della diagnosi precoce
La diagnosi precoce della malattia di Alzheimer, resa possibile grazie ai biomarcatori nella LCR e nella voce, offre importanti vantaggi clinici. Permette di intervenire in una fase in cui i trattamenti, sebbene limitati nella loro capacità di invertire la malattia, possono arrestare la progressione dei sintomi cognitivi. Identificando la patologia nella fase 1A, quando i pazienti non presentano ancora alcun segno clinico, i medici possono mettere in atto strategie terapeutiche preventive volte a rallentare il passaggio a fasi più sintomatiche. Un altro vantaggio fondamentale dell’intervento precoce è che offre la possibilità di una migliore pianificazione dell’assistenza a lungo termine. Una volta identificata la patologia tramite i biomarcatori di amiloide o tau, i pazienti e le loro famiglie possono beneficiare di una migliore anticipazione dello sviluppo della malattia. Ciò include decisioni più informate in termini di assistenza, gestione finanziaria e organizzazione della vita quotidiana, nonché la creazione di reti di supporto adeguate. Questo approccio proattivo permette di migliorare la qualità di vita del paziente, rallentando gli effetti invalidanti della demenza e favorendo un’assistenza personalizzata.
La diagnosi preclinica, grazie a biomarcatori come p-tau217 e Aβ42/Aβ40, consente anche di prendere una decisione terapeutica più accurata e adatta al paziente. I medici possono determinare più rapidamente se un paziente è idoneo per gli studi clinici su nuove terapie o per i trattamenti per modificare la malattia al fine di ridurre l’accumulo di amiloide o tau. Trattando i pazienti nelle prime fasi della malattia, è anche possibile limitare l’impatto delle complicanze secondarie associate allo sviluppo del MA, come la perdita di autonomia, i problemi comportamentali e l’aumento dell’onere per i caregiver. [28] Infine, la diagnosi precoce consente una migliore gestione delle risorse mediche, soprattutto nei Paesi con scarse risorse. Identificando con maggiore precisione i pazienti che hanno più bisogno di un attento monitoraggio o di interventi specifici, i medici possono adattare le loro pratiche e dare priorità all’assistenza in base alla gravità della malattia. Questo potrebbe avere anche implicazioni economiche positive, riducendo i costi a lungo termine associati agli interventi tardivi per la demenza avanzata, che spesso comportano il ricovero in ospedale e un’assistenza più complessa.
Conclusione
I biomarcatori nella LCR e nella voce hanno veramente rivoluzionato la diagnosi della malattia di Alzheimer, consentendo un’individuazione più precisa e accurata della patologia, anche prima della comparsa dei sintomi clinici. Le linee guida 2024, con il loro approccio integrato clinico-biologico, offrono una procedura più completa per la diagnosi e la gestione personalizzata della malattia, con percorsi specifici per ogni fase della patologia. Tuttavia, nonostante questi progressi, è necessario continuare a impegnarsi per rendere queste tecnologie più accessibili, in particolare estendendo la loro disponibilità al di là dei centri specializzati e affrontando le questioni dei costi e dei rimborsi. Queste iniziative saranno fondamentali per migliorare la gestione di questa malattia su larga scala, consentendo un accesso più equo alla diagnosi precoce e a interventi terapeutici e di sopravvivenza più appropriati.
Messaggi da portare a casa
- Da oltre un decennio, i biomarcatori nella LCR e, più recentemente, nella voce hanno veramente rivoluzionato la diagnosi della malattia di Alzheimer, consentendo una diagnosi più precisa e accurata della patologia.
- Le linee guida 2024, con il loro approccio integrato clinico-biologico, offrono una procedura più completa per la diagnosi e il trattamento personalizzato della malattia, con percorsi specifici per ogni fase della patologia.
- Tuttavia, nonostante questi progressi, è necessario continuare a impegnarsi per rendere queste tecnologie più affidabili e accessibili. Nei prossimi anni, i biomarcatori della malattia di Alzheimer nella voce potrebbero trasformare il modo in cui la malattia di Alzheimer viene diagnosticata in anticipo, offrendo così una finestra di opportunità per intervenire prima ancora della comparsa dei sintomi clinici.
- Marcatori come il p-tau217 e il rapporto Aβ42/Aβ40 promuovono una maggiore precisione diagnostica, consentendo di prevedere strategie terapeutiche per ridurre al minimo la progressione della malattia.
- Questi progressi hanno offerto ai medici strumenti più sensibili, meno invasivi e potenzialmente applicabili nella pratica clinica di routine.
- Sebbene vi siano sfide in termini di standardizzazione e di costi per i sistemi sanitari, le linee guida 2024 aprono la porta a un’assistenza personalizzata, combinando la valutazione biologica e clinica per ottimizzare l’assistenza in ogni fase della malattia.
Littérature:
- Huang S, Wang YJ, Guo J: Biomarcatori biofluidici della malattia di Alzheimer: progressi, problemi e prospettive. Bollettino di Neuroscienze 2022 38: 6 38, 677-691 (2022).
- Jack CR, et al: Quadro di ricerca NIA-AA: Verso una definizione biologica della malattia di Alzheimer. Alzheimer & Dementia 2018; 14: 535-562.
- Jack CR, et al: Criteri rivisti per la diagnosi e la stadiazione della malattia di Alzheimer: Gruppo di lavoro dell’Alzheimer’s Association. Alzheimer e Demenza 2024; 20: 5143-5169.
- Salvadó G, et al: Associazioni specifiche tra biomarcatori plasmatici e carichi di placche amiloidi e grovigli tau post mortem. EMBO Mol Med 2023; 15.
- Hansson O, Lehmann S, Otto M, et al: Vantaggi e svantaggi dell’uso del rapporto 42/40 dell’amiloide β (Aβ) nel liquor nella diagnosi della malattia di Alzheimer. Alzheimers Res Ther 2019; 11: 1-15.
- Holper S, Watson R, Yassi N: Tau come biomarcatore della neurodegenerazione. International Journal of Molecular Sciences 2022; 23: 7307.
- Kurihara M, Komatsu H, Sengoku R: ARTICOLO COMPLETO CSF P-Tau181 e altri biomarcatori in pazienti con malattia da inclusione intranucleare neuronale. Citare come: Neurology® 2023; 100: 1009-1019.
- Janelidze S, et al: Il P-tau181 plasmatico nella malattia di Alzheimer: relazione con altri biomarcatori, diagnosi differenziale, neuropatologia e progressione longitudinale verso la demenza di Alzheimer. Nat Med (2020), doi: 10.1038/s41591-020-0755-1.
- Janelidze S, et al: Il liquido cerebrospinale p-tau217 si comporta meglio del p-tau181 come biomarcatore della malattia di Alzheimer. Nature Communications 2020; 11(1): 1-12.
- Ashton NJ, et al: Plasma p-tau231: un nuovo biomarcatore per la patologia incipiente della malattia di Alzheimer. Acta Neuropathol 2021; 141: 709-724.
- Buerger K, et al: La proteina tau CSF fosforilata alla treonina 231 è correlata al declino cognitivo nei soggetti con MCI. Neurology 2002; 59: 627-629.
- Horie K, et al: CSF MTBR-tau243 è un biomarcatore specifico della patologia del groviglio tau nella malattia di Alzheimer. Nature Medicine 2023; 29(8): 1954-1963.
- Lantero-Rodriguez J, et al: CSF p-tau205: un biomarcatore della patologia tau nella malattia di Alzheimer. Acta Neuropathol 2024; 147: 1-17.
- Olsson B, et al: Biomarcatori del liquor e del sangue per la diagnosi della malattia di Alzheimer: una revisione sistematica e una meta-analisi. Lancet Neurol 2016; 15: 673-684.
- Santangelo R, et al: Il rapporto p-tau181/Aβ42 del liquor offre una buona accuratezza “in vivo” nella diagnosi differenziale della demenza di Alzheimer. Curr Alzheimer Res 2019; 16: 587-595.
- Schindler SE, et al: Confronto testa a testa dei principali esami del sangue per la patologia della malattia di Alzheimer. Alzheimer & Dementia (2024), doi: 10.1002/ALZ.14315.
- Hampel H, et al: Biomarcatori ematici per la malattia di Alzheimer: stato attuale e uso futuro in un panorama sanitario globale trasformato. Neuron 2023; 111: 2781-2799.
- Hansson O, et al: L’Alzheimer’s Association raccomanda l’uso appropriato dei biomarcatori ematici nella malattia di Alzheimer. Alzheimer & Dementia 2022; 18: 2669-2686.
- Hansson O, Blennow K, Zetterberg H, Dage J: Biomarcatori del sangue per la malattia di Alzheimer nella pratica clinica e negli studi. Nat Aging 2023; 3: 506-519.
- Álvarez-Sánchez L, Peña-Bautista C, Baquero M, Cháfer-Pericás C: Nuove tecnologie di rilevamento ultrasensibili per l’identificazione di biomarcatori ematici della malattia di Alzheimer precoci e minimamente invasivi. Journal of Alzheimer’s Disease 2022; 86: 1337-1369.
- Blennow K, et al: Il potenziale valore clinico dei biomarcatori plasmatici nella malattia di Alzheimer. Alzheimer & Dementia 2023; 19: 5805-5816.
- Ashton NJ, et al: Accuratezza diagnostica di un immunodosaggio per la Tau fosforilata 217 nel plasma per la patologia della malattia di Alzheimer. JAMA Neurol 2024; 81: 255-263.
- Alcolea D, Beeri MS, Rojas JC, et al: Biomarcatori del sangue nelle malattie neurodegenerative: Implicazioni per il neurologo clinico. Neurologia 2023; 101: 172-180.
- Palmqvist S, et al: Accuratezza discriminativa della fosfo-tau217 plasmatica per la malattia di Alzheimer rispetto ad altri disturbi neurodegenerativi. JAMA 2020; 324: 772-781.
- Kim KY, Shin KY, Chang KA: GFAP come potenziale biomarcatore della malattia di Alzheimer: revisione sistematica e meta-analisi. Cellule 2023: 12.
- Yakoub Y, et al: Traiettorie longitudinali dei biomarcatori ematici nella malattia di Alzheimer preclinica. Alzheimers Dement 2023; 19: 5620-5631.
- Stevenson-Hoare J, et al: Biomarcatori plasmatici e genetica nella diagnosi e nella previsione della malattia di Alzheimer. Brain 2023; 146: 690-699.
- Nwamekang Belinga L, et al: Biomarcatori circolanti per la malattia di Alzheimer: sbloccare il potenziale diagnostico nei Paesi a basso e medio reddito, con particolare attenzione all’Africa. Neurodegener Dis 2024; 24: 26-40.
InFo NEUROLOGIE & PSCHIATRIE 2024; 22(6): 14-19