Lo spettro delle opzioni di trattamento sistemico per la dermatite atopica è attualmente in evoluzione. Negli ultimi anni, è stato dimostrato che la via di segnalazione dell’interleuchina (IL)-13 svolge un ruolo essenziale nella patogenesi della dermatite atopica. Mentre il biologico Dupilumab inibisce la segnalazione di IL-4/IL-13 ed è già affermato nella pratica, Tralokinumab e Lebrikizumab si rivolgono specificamente all’IL-13. I dati degli studi condotti finora sono molto promettenti.
Sulla base dei progressi nella decifrazione della base immunopatologica della dermatite atopica, sono stati sviluppati concetti di trattamento che mirano specificamente ai meccanismi immunitari di tipo 2 [1]. Le terapie innovative sotto forma di anticorpi monoclonali specifici e le cosiddette “piccole molecole” hanno inaugurato una nuova era. I corrispondenti agenti antinfiammatori e immunomodulatori possono essere utilizzati nei pazienti affetti da dermatite atopica da moderata a grave e combinano effetti terapeutici altamente efficaci con un profilo di sicurezza favorevole, per cui le varie opzioni terapeutiche devono essere adattate alle rispettive caratteristiche del paziente, nel senso della medicina personalizzata. Si tratta di un progresso significativo nelle opzioni di trattamento di questa fastidiosa malattia della pelle, in quanto le opzioni di terapia sistemica convenzionali sono molto limitate in termini di durata di utilizzo e di profilo rischio-beneficio, e la sola terapia topica di solito non è sufficiente.
La via di segnalazione dell’interleuchina (IL)-13 come bersaglio terapeutico
L’anticorpo monoclonale dupilumab – il primo biologico approvato per la dermatite atopica – si lega al recettore dell’IL-4 (IL-4Rα), impedendo la segnalazione di IL-4 e IL-13 [1]. Studi recenti hanno identificato l’IL-13 come la citochina di tipo 2 più abbondante nella pelle lesionata nella dermatite atopica e hanno dimostrato che il livello di espressione di IL-13 è molto alto.
L’IL-13 nelle lesioni cutanee è correlata alla gravità della malattia [2–6]. Si ritiene che la sovraespressione di IL-13 nella pelle della dermatite atopica contribuisca al circolo vizioso di infiammazione, interruzione della barriera cutanea e disbiosi del microbioma [2,3]. Il tralokinumab, anch’esso un anticorpo monoclonale, neutralizza specificamente l’IL-13 legandosi a questa citochina, impedendo l’interazione con il recettore IL-13Rα1 [1]. Questa è la base delle proprietà antinfiammatorie e immunomodulatorie di tralokinumab. Un farmaco biologico che ha come bersaglio anche l’IL-13 è il lebrikizumab. Questo anticorpo monoclonale IgG4 si lega a un epitopo dell’IL-13 che impedisce al complesso IL-13/IL-13Rα1 di formare un eterodimero con IL-4Rα [2].
Tralokinumab: successo nello studio di fase III come monoterapia e con TCS
L’efficacia e la sicurezza della terapia con tralokinumab per 52 settimane nella dermatite atopica sono state studiate nei due RCT multinazionali di fase III ECZTRA 1 (n=802) ed ECZTRA 2 (n=794) [7]. In entrambi gli studi, tralokinumab 300 mg ogni due settimane (q2w) è stato significativamente superiore al placebo in termini di miglioramento degli endpoint primari IGA 0/1 e EASI-75 a 16 settimane. Inoltre, vari endpoint secondari come il prurito, il DLQI, lo Scoring Atopic Dermatitis (SCORAD) e i disturbi del sonno legati all’eczema hanno manifestato miglioramenti significativi con tralokinumab [7].
Un altro studio di fase III randomizzato e controllato – ECZTRA 3 – ha valutato l’efficacia e la sicurezza di tralokinumab 300 mg q2w in combinazione con un corticosteroide topico (TCS) in 380 pazienti con dermatite atopica da moderata a grave [8]. La terapia su richiesta con cortisone applicato localmente era il mometasone furoato 0,1% crema (steroide di classe III), applicato una volta al giorno sulle lesioni attive. Alla settimana 16 dello studio ECZTRA 3, un numero significativamente maggiore di persone nel braccio tralokinumab ha raggiunto EASI-75 e IGA 0/1 (56,0% e 38,9%, rispettivamente) rispetto al braccio placebo, dove i valori corrispondenti erano 35,7% e 26,2% (p<0,001 e p=0,015, rispettivamente) (Fig. 1) [8]. Il braccio tralokinumab si è dimostrato superiore anche in termini di EASI-90 (32,9 vs. 21,4%; p=0,022) e EASI-50 (79,4 vs. 57,9%; p<0,001). Le analisi hanno anche mostrato che nelle settimane 15-16, i pazienti trattati con tralokinumab hanno utilizzato circa il 50% in meno di steroidi topici rispetto al gruppo placebo (p=0,002). Coloro che hanno raggiunto l’endpoint primario alla settimana 16 sono stati randomizzati nuovamente 1:1 per continuare il trattamento con tralokinumab q2w o per ridurre il dosaggio a q4w. Circa il 90% dei pazienti è stato in grado di mantenere la risposta dalla settimana 16 alla settimana 32 con entrambi i regimi di dosaggio [9].
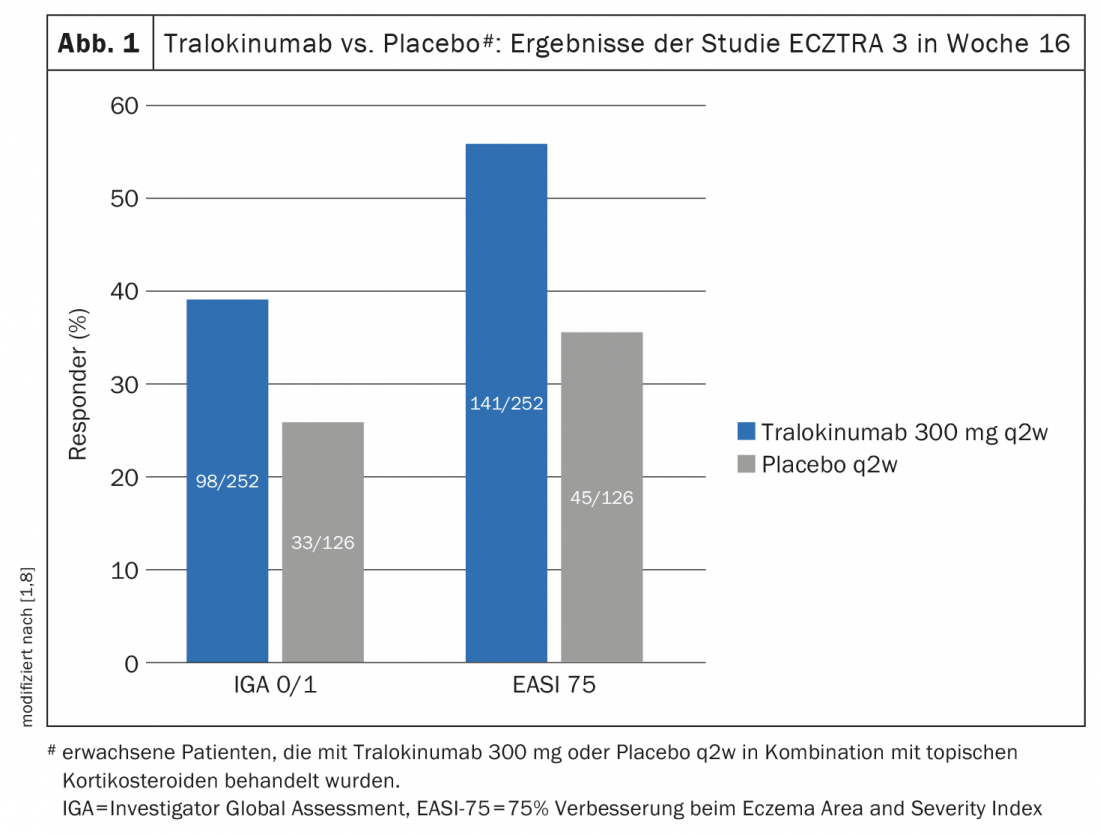
In particolare, lo studio ECZTRA 3 si confronta bene con la pratica quotidiana nella dermatite atopica: se le TCS da sole non sono efficaci, si inizia una terapia sistemica. Per evitare una ricaduta, entrambi i trattamenti vengono idealmente proseguiti in parallelo [1].
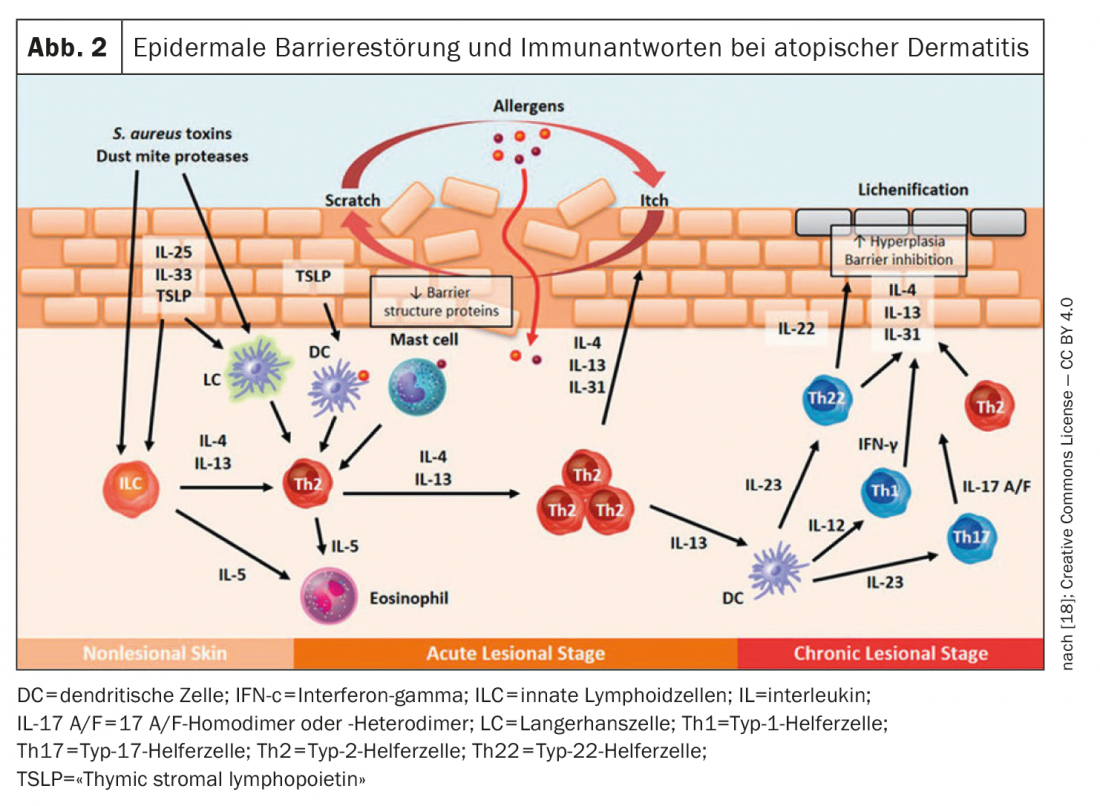
Lebrikizumab: completato lo studio di Fase II di ricerca della dose
Gli studi di fase IIb su lebrikizumab negli adulti hanno mostrato un’efficacia dose-dipendente senza un aumento significativo dell’incidenza relativa della congiuntivite [11]. Un totale di 280 pazienti (età media 39,3 anni, 59,3% donne) sono stati assegnati in modo casuale a uno dei seguenti bracci di studio: 125 mg ogni 4 settimane (n=73), 250 mg ogni 4 settimane (n=80) o 250 mg ogni 2 settimane (n=75) o placebo. Alla settimana 16, il trattamento con lebrikizumab ha mostrato un miglioramento statisticamente significativo dose-dipendente nelle variazioni percentuali medie dei minimi quadrati EASI rispetto al placebo. Le differenze rispetto al placebo si sono manifestate già alla settimana 4 e hanno continuato ad accentuarsi fino alla settimana 16. Inoltre, un numero significativamente maggiore di pazienti ha ottenuto una risposta IGA 0/1 e EASI50, EASI75 e EASI90 alla settimana 16 alla dose di 250 mg di lebrikizumab rispetto al placebo.

Nel complesso, i risultati degli studi clinici condotti finora suggeriscono che lebrikizumab è un’altra opzione terapeutica efficace e ben tollerata per la dermatite atopica da moderata a grave. L’efficacia e la sicurezza di questo biologico per la terapia di mantenimento e come trattamento a lungo termine sono state testate in studi di fase III dal 2019 [12,13]. La Food and Drug Administration (FDA) statunitense ha recentemente concesso lo status di fast-track a questo anticorpo monoclonale [10].
Letteratura:
- Wollenberg A, Weidinger S, Worm M, Bieber T: J Dtsch Dermatol Ges 2021; 19(10): 1435-1442.
- Bieber T: Allergia 2019; 75: 54-62.
- Tubau C, Puig L: Expert Rev Clin Immunol 2021; 17: 15-25.
- Tsoi LC, et al: J Invest Dermatol 2019; 139: 1480-1489.
- Szegedi K, et al: J Eur Acad Dermatol Venereol 2015; 29: 2136-2144.
- Marbach-Breitrück E, et al: Skin Pharmacol Physiol 2019; 32: 192-200.
- Wollenberg A, et al: Br J Dermatol 2021; 184: 437-449.
- Silverberg JI, et al: Br J Dermatol 2021; 184: 450-463.
- Wohlrab J, et al: Dermatologist 2021; 72(4): 321-327.
- Tuttle KL, Forman J, Beck LA: Int J Womens Dermatol 2021; 7(5Part A): 606-614.
- Guttman-Yassky E, et al: JAMA dermatology 2020; 156(4): 411-420.
- ClinicalTrials.gov, https://clinicaltrials.gov/ct2/show/NCT04146363, (ultimo accesso 24.01.2022)
- ClinicalTrials.gov, https://clinicaltrials.gov/ct2/show/NCT04178967, (ultimo accesso 24.01.2022)
- Wei W, et al: J Dermatol 2018; 45: 150-157.
- Langan SM, Irvine AD, Weidinger S: Lancet 2020; 396: 345-360.
- Wollenberg A, et al: J Eur Acad Derm Venereol 2020; 34: 2717-2744.
- Adtralza®, approvazione EMA nel giugno 2021, https://ec.europa.eu/health/documents/community-register/html/h1554.htm, (ultimo accesso 24.01.2022)
- Cork MJ, Danby SG, Ogg GS: J Dermatolog Treat 2020; 31(8): 801-809, www.researchgate.net/publication/336708334_Atopic_dermatitis_epidemiology_and_unmet_need_in_the_United_Kingdom
PRATICA DERMATOLOGICA 2022; 32(1): 26-28