La tossina botulinica (BTX) si è evoluta da un precedente farmaco oftalmico con uno spettro terapeutico limitato a un farmaco con distribuzione mondiale. Ha un effetto inibitorio presinaptico sul rilascio di ACh nella placca terminale neuromuscolare, da un lato, e nella placca terminale neurovegetativa, dall’altro. Nell’applicazione medico-terapeutica nell’uomo, viene utilizzato praticamente solo il BTX A. Esistono tre preparati che sono stati testati in un gran numero di studi scientifici: Onabotulinum, Abobotulinum, Incobotulinum. Come vengono utilizzati e quale materiale è necessario per il trattamento con il botulino?
Il primo caso registrato di avvelenamento da tossina botulinica con il batterio Clostridium botulinum, produttore di neurotossine, risale al 1735, quando la banda che suonava a una festa di matrimonio fu nutrita con prosciutto avariato e salsicce affumicate. Quattro dei dieci musicisti morirono di botulismo [1]. Dr. Justinus Christian Kerner (1786-1862), poeta e funzionario medico del Baden-Württemberg (Fig. 1), pubblicò nel “Tübinger Blättern für Naturwissenschaften und Arzneykunde” in modo meticoloso i sintomi dei pazienti affetti da botulismo e già all’epoca notò che “questa tossina potrebbe probabilmente essere un farmaco formidabile per il trattamento dei crampi in un secondo momento, così come per la riduzione dell’eccessiva salivazione, lacrimazione o sudorazione” [2]. Poiché all’epoca il batterio non era ancora stato scoperto, Kerner credette nella cosiddetta teoria degli acidi grassi, dopo che erano stati discussi a lungo numerosi altri meccanismi (alimentazione malsana dei suini, energia elettrica dei fulmini, punizioni di Dio dovute a stili di vita disonesti, ecc.) In quel periodo, il botulismo era chiamato anche malattia di Kerner.

Fu Friedrich Gustav Jakob Henle (1809-1885), professore di anatomia di Göttingen (“ansa di Henle”), a descrivere per la prima volta gli organismi parassitari nel 1840 (Contagium vivum) e a descriverli come possibili cause di malattia. 20 anni dopo, il chimico Louis Pasteur (1822-1895) dimostrò la fermentazione microbica del vino. Nel 1882, Robert Koch (1843-1910), studente di Henle, scoprì il bacillo tubercolare e per questo ricevette il Premio Nobel nel 1905. Le conseguenze della scoperta dei batteri furono enormi. Per la prima volta nella storia della medicina, sono state conosciute le cause di numerose malattie, rendendo possibile per la prima volta la terapia causale – almeno in una certa misura all’inizio. Nel 1897, Pierre Marie van Ermengem (1851-1932), studente di Robert Koch, riuscì a isolare l’agente patogeno responsabile del botulismo, confutando così la teoria degli acidi grassi di Kerner. Ha dato a questo batterio il nome di Bacillus botulinus, che oggi è conosciuto come Clostridium botulinum [3]. 1905 Tchitchikane identifica la neurotossina. Per conto dell’Esercito degli Stati Uniti, Eduard J. Schantz ha lavorato sulla struttura della proteina fin dalla Seconda Guerra Mondiale, quando si è saputo che vari Paesi avevano capacità e piani per l’uso di armi chimiche e biologiche. La sua ricerca sulla struttura della proteina e sul meccanismo d’azione ha gettato le basi per l’uso attuale della tossina come farmaco. Nel 1949, gli studi di Burgen dimostrarono che l’effetto della tossina era dovuto a un’inibizione presinaptica dell’acetilcolina (chemodenervazione) e non – come ipotizzato fino ad allora – a un blocco nervoso postsinaptico [4]. Questa scoperta è stata fondamentale per le successive basi teoriche dell’applicazione clinica della tossina (vedere sotto).
Nel 1973, il dottor Alan Scott è stato il pioniere dell’uso clinico della tossina botulinica (BTX), utilizzando per la prima volta la BTX nei primati per trattare lo strabismo. Ha lavorato a stretto contatto con E. J. Schantz, responsabile della produzione della tossina. Tuttavia, se la tossina doveva essere utilizzata terapeuticamente come farmaco nell’uomo, doveva essere prima purificata da altre proteine per evitare la formazione di anticorpi nel modo più efficiente possibile e per garantire la stabilità ad alta diluizione. I problemi furono risolti e otto anni dopo il primo esperimento animale sulle scimmie, Scott fu in grado di pubblicare la prima applicazione della BTX negli esseri umani con il titolo “Iniezione di tossina botulinica nei muscoli oculari per correggere lo strabismo” [5].
20 anni dopo lo sviluppo clinico del farmaco, il preparato BTX è stato approvato dalla FDA americana per il trattamento di strabismo, blefarospasmo e spasmo emifacciale. In modo piuttosto accidentale, Jean Carruthers, uno specializzando del Dr. Scott, ha scoperto che le rughe sul lato trattato dei pazienti con blefarospasmo emifacciale si attenuavano in modo significativo [6]. Più o meno nello stesso periodo, Bushara scoprì una riduzione significativa della sudorazione nella metà del viso trattata e pubblicò per la prima volta un possibile trattamento dell’iperidrosi ascellare con BTX [7]. Queste due scoperte sono state l’inizio di una storia di successo di un ex farmaco oftalmico con un uso terapeutico limitato, che si è sviluppato in un farmaco con distribuzione mondiale. In Svizzera, il BTX è stato utilizzato per la prima volta nel 1997 per il trattamento dell’iperidrosi focale. La prima consultazione sull’iperidrosi in Svizzera è stata istituita presso l’Ospedale Universitario di Zurigo [8]. Nel corso degli anni, le indicazioni per il trattamento estetico sono diventate sempre più importanti. Secondo le statistiche della Società Americana di Chirurgia Plastica Estetica, solo negli Stati Uniti sono stati eseguiti 3.766.148 trattamenti estetici con botulino nel 2013 – escluso il trattamento dell’iperidrosi. Questo rappresenta un aumento del 5680% rispetto al 1997!
Tutto Botox® o cosa?
Ad oggi, sono noti sette tipi immunologicamente diversi di BTX (A-G), con le tossine A, B, E e F che mostrano efficacia negli esseri umani, mentre le tossine C e D causano malattie solo negli animali e la tossina G non è ancora stata descritta come causa di malattie negli esseri umani o negli animali [9]. Nelle applicazioni terapeutiche mediche, il BTX A viene utilizzato quasi esclusivamente. La tossina botulinica B complessa, commercializzata con il marchio Myobloc® in Europa e Neurobloc® negli Stati Uniti (Elan Pharmaceuticals, USA), svolge un ruolo marginale in dermatologia, a causa della durata d’azione limitata e del dolore bruciante all’iniezione.
Esistono tre prodotti BTX A principali, che sono stati testati in una serie di studi scientifici preclinici e clinici:
- Tossina onabotulinica A: Botox®/Vistabel® (Actavis/Allergan, USA)
- Tossina abobotulinica A: Dysport®/Azzalure® (Ipsen, Regno Unito resp. Galderma, CH)
- Tossina incobotulinica A: Xeomin®/Bocouture® (Merz Aesthetics, D)
Botox®, Dysport® e Xeomin® sono utilizzati per indicazioni mediche (quadri clinici neurologici/iperidrosi), Vistabel® (o anche Botox aesthetics® negli Stati Uniti), Azzalure® e Bocouture® sono disponibili per indicazioni estetiche, per cui i rispettivi preparati fratelli sono farmacologicamente assolutamente identici e si differenziano solo per il nome del marchio per una migliore identificazione (requisito FDA). Non tutti i preparati citati hanno l’autorizzazione all’immissione in commercio per ogni indicazione. Tuttavia, questa circostanza è specifica del Paese e non viene quindi discussa in dettaglio in questa sede.
Le singole tossine (onabotulinum, abobotulinum, incobotulinum) si differenziano per la forma di dosaggio (unità/confezione), per le condizioni di trasporto e per la loro attività biologica, che è illustrata nella tabella 1.
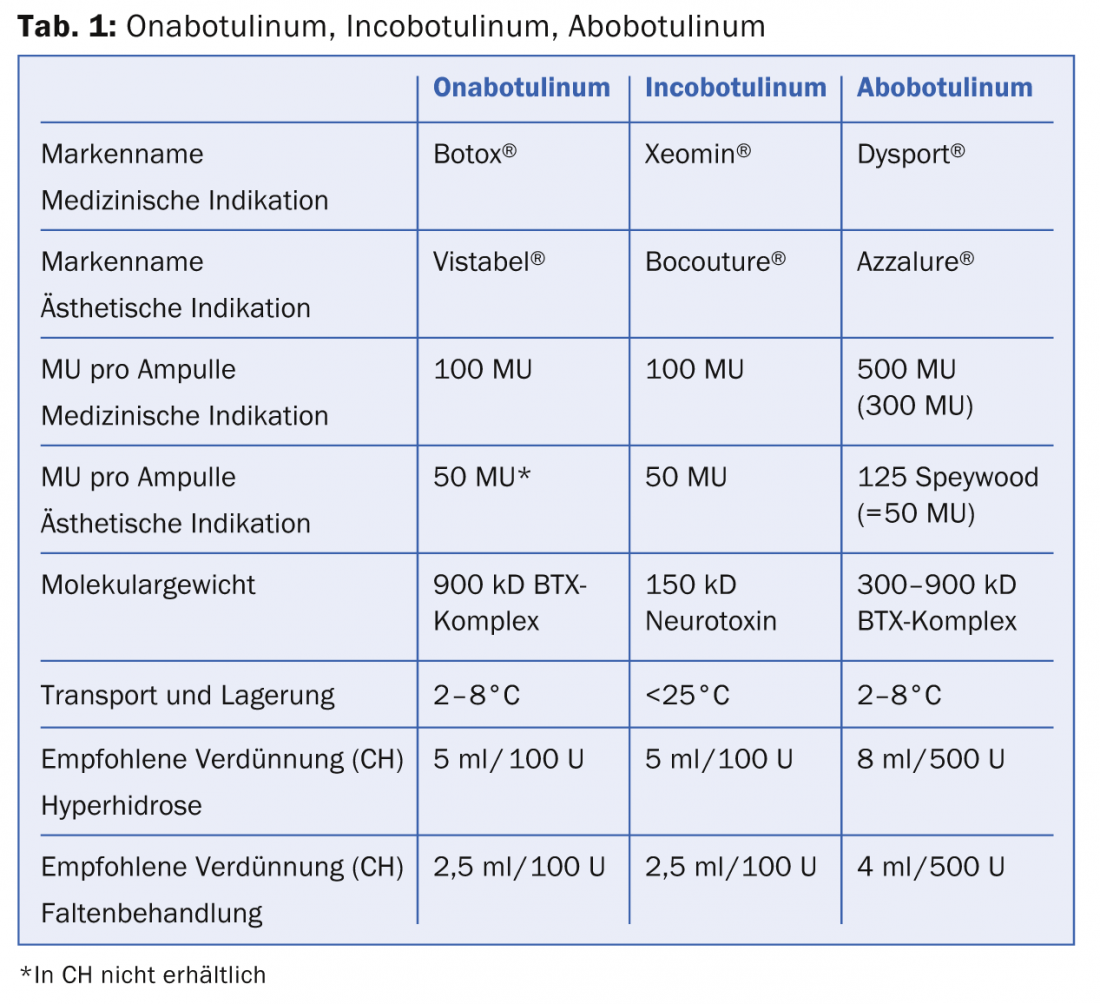
Tutti e tre i prodotti si presentano in una sostanza secca cristallina e devono essere ricostituiti con NaCl allo 0,9%. Mentre l’ona- e l’abobotulinum devono essere trasportati e conservati refrigerati, questa catena del freddo non si applica all’incobotulinum. Dopo la ricostituzione, tuttavia, tutti i prodotti devono essere conservati in un luogo fresco. L’attività biologica di tutti e tre i prodotti è espressa nelle cosiddette unità topo (MU). 1 MU corrisponde a 0,2X10-12 mol (picomol) di tossina ed è definita come la quantità di tossina che è letale per la metà della popolazione di topi Swiss Webster femmina (18-22 g) dopo l’iniezione intraperitoneale (dose letale DL50). Da giugno 2011, Allergan è l’unico concorrente a condurre un test di potenza in vitro basato sulle cellule (CBPA) per determinare la stabilità e l’efficacia del farmaco. Onabotulinum e incobotulinum sono paragonabili in termini di efficacia, durata d’azione e inizio d’azione. Incobotulinum è l’unica preparazione complessa senza proteine, che si dice eccella in una ridotta reazione anticorpale neutralizzante (prevenzione del fallimento della terapia secondaria). È importante notare che la dose equivalente per l’abobotulino (Dysport® resp. Azzalure®) non è uguale alla dose degli altri due BTX (tab. 1). Ciò è dovuto al fatto che per produrre il farmaco vengono utilizzati ceppi batterici diversi e i processi di produzione sono differenti. Il fattore di conversione della dose tra onabotulinum/incobotulinum e abobotulinum è 1:3 (o 1:2,5 a seconda della pubblicazione). Questo è di estrema importanza quando si ricostituisce la tossina nell’uso clinico, per evitare un sovradosaggio o un sottodosaggio. Più che altro, per completezza, va detto che sul World Wide Web viene offerto un gran numero di prodotti BTX con marchi diversi e di origine incerta. Va da sé che questi prodotti dovrebbero essere evitati.
Come funziona il botulino?
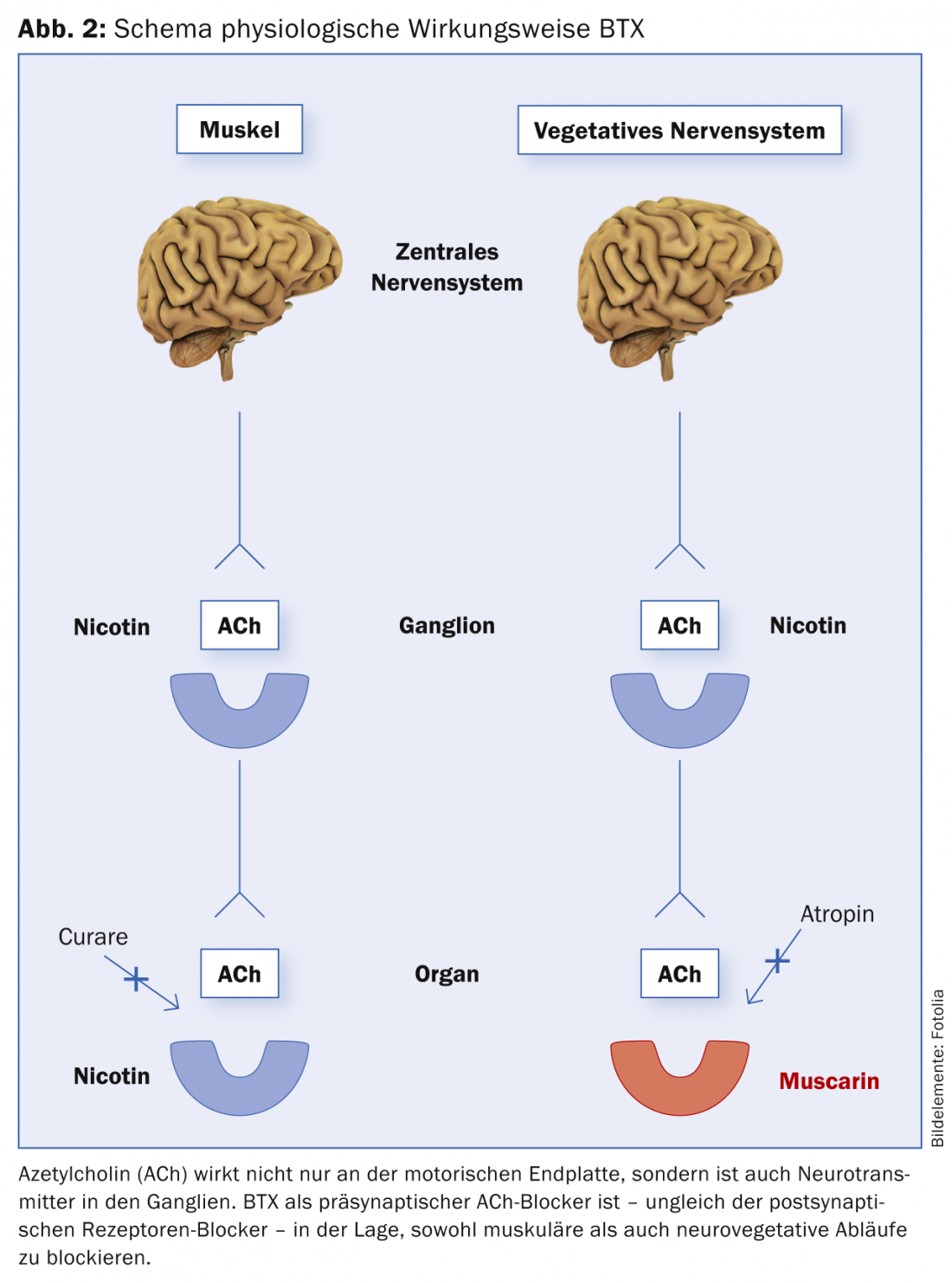
Il BTX, come già detto, ha un effetto inibitorio presinaptico sul rilascio di ACh sia a livello delle terminazioni neuromuscolari che neurovegetative. In altre parole, sia il muscolo che il sistema nervoso autonomo (VNS) sono serviti dalla stessa sostanza trasmittente (ACh). Ecco perché la BTX è efficace sia nel muscolo che in altri processi controllati vegetativamente (iperidrosi, ipersalivazione, indicazioni urologiche, ecc.) (Fig. 2). Questo meccanismo d’azione estremamente specifico della BTX è anche il motivo per cui la BTX non ha effetti collaterali nell’uso clinico. L’ACh viene utilizzata come trasmettitore esclusivamente nei sistemi citati.
La molecola della tossina è composta da una catena leggera (catena L) con un peso molecolare di 50 kD (kilo Dalton) e da una catena pesante (catena H) con un peso molecolare di 100 kD. Le catene sono collegate tra loro da un ponte disolfuro. La catena H è responsabile della cosiddetta internalizzazione: l’assorbimento della tossina nel terminale nervoso nell’area della piastra terminale presinaptica. Dopo l’endocitosi, la catena L si separa dalla catena H. La catena L taglia la proteina SNAP-25, un componente del cosiddetto complesso di fusione SNARE (Soluble N-ethylmaleimide-sensitive-factor Attachment Receptor, SNARE) in vari siti. Di conseguenza, la fusione della vescicola contenente ACh con la membrana non è più possibile e quindi non è possibile il rilascio di ACh dal terminale nervoso colinergico [10,11]. In questo modo, la scarica della sostanza trasmettitrice ACh viene impedita e non c’è alcun effetto postsinaptico. Tuttavia, l’effetto terapeutico è solo di durata limitata, poiché in seguito spuntano di nuovo nuovi nervi e si stabiliscono nuove connessioni sinaptiche.
La preparazione della soluzione di botulino per il trattamento
Esistono diversi modi per sciogliere la sostanza secca BTX. Molti autori scelgono una diluizione di 1 ml a 100 U Ona- e Incobotulinum resp. 500 U Abobotulinum per il trattamento delle rughe mimiche con l’obiettivo di ottenere un risultato di iniezione della tossina il più preciso possibile, con una diffusione minima nei muscoli indesiderati. Tuttavia, questo schema di dissoluzione altamente concentrato e a basso volume ha lo svantaggio principale che è difficile ottenere gradazioni fini nel dosaggio e quindi un certo ‘modellamento’ con la dose di BTX. Se 100 U BTX sono disciolte in 1 ml, 0,1 ml corrispondono a 10 U BTX. La dose di un punto di iniezione per il trattamento delle rughe mimiche è solitamente compresa tra 2 U e 6 U. Pertanto, è necessario un alto livello di esperienza e una mano sicura quando si iniettano piccole dosi. Pertanto, è stata stabilita una diluizione di BTX per le diverse indicazioni, come mostrato nelle tabelle 2 e 3.
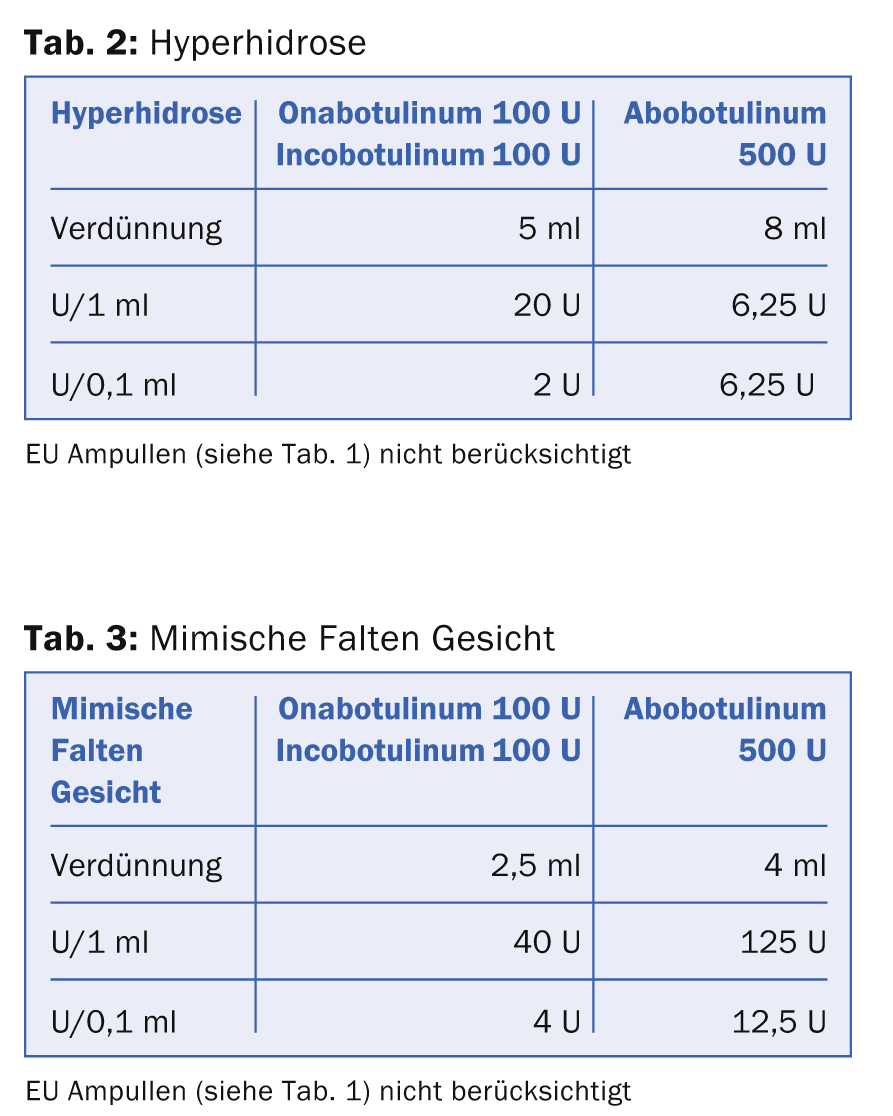
Le tabelle mostrano che la dose equivalente di Ona- risp. Incobotulinum e Abobotulinum si calcolano con 1:3. La particolarità della ricostituzione di Incobotulinum è che l’azienda raccomanda vivamente di inclinare la fiala più volte dopo l’attivazione, per ottenere il massimo effetto della soluzione farmacologica.
Di quale materiale ho bisogno per un trattamento BTX?
Il materiale necessario per il trattamento con BTX è relativamente gestibile. Una preparazione corretta e ben pianificata porta alla sicurezza e all’aumento della qualità. O per dirla al contrario: se il medico deve raccogliere questo e quello prima dell’intervento previsto o addirittura interrompere il trattamento a causa di una mancanza di preparazione, ci sono di per sé pericoli di trattamenti errati. Non bisogna dimenticare che abbiamo a che fare con una droga molto potente. L’istruzione degli assistenti è di estrema importanza.
Per un corretto trattamento BTX ha bisogno di:
- 1 confezione originale di BTX (Ona-, Inco o Abobotulinum) 100 U
- NaCl 0,9% 5 ml (iperidrosi) resp. 2,5 ml (indicazione estetica) Ona- e Incobotulinum, 8 ml rispettivamente. 4 ml Abobotulinum (Cave: nell’UE, 50 U resp. 125 U Flacone disponibile, quindi dimezza la quantità di volume)
- Siringa da 5 ml con ago da 18 G (rosa) per la ricostituzione
- Siringhe di insulina (1 ml) senza ago collegato con scala in ml
- Ago 32G collegabile per l’iniezione
- Disinfezione sia spray, ad esempio Kodan® per il trattamento dell’iperidrosi, sia liquida, ad esempio Octenisept® per il trattamento del viso.
- Fascia nella zona del viso
- Utensili per il test del sudore di Minor per il trattamento dell’iperidrosi ascellare:
- Soluzione di Lugol (farmacia)
- Fecola di patate (farmacia)
- Doppio setaccio per applicare la fecola di patate il più finemente possibile (grandi magazzini)
- Matita Kajal (morbida!) per segnare i punti di iniezione
- Emulsione struccante e opzione di lavaggio dopo il trattamento (soprattutto dopo l’iperidrosi ascellare).
Questo elenco può ovviamente essere adattato alle preferenze personali. Le siringhe, gli aghi e le fiale vuote usate devono essere smaltite separatamente! Questo è un punto da non omettere! Il BTX e i suoi residui non devono essere smaltiti con i rifiuti generici.
Per continuare…

Letteratura:
- Dickson EC: Botulismo: uno studio clinico e sperimentale. Istituto Rockefeller per la Ricerca Medica 1918; 1-117.
- Kerner JC: Avvelenamento da salsicce contaminate. Tübinger Blätter für Naturwissenschaften und Arzneykunde 1817; 3: 1-45.
- Kreyden OP, Geiges ML, Burg G: Tossina botulinica: da veleno a farmaco. Una revisione storica. Dermatologo 2000; 51: 733-737.
- Burgen A, Dickens F, Zatman LJ: L’azione della tossina botulinica sulla giunzione neuromuscolare. J Physiol 1949; 109: 10-24.
- Scott AB: Iniezione di tossina botulinica nei muscoli oculari per correggere lo strabismo. Trans Am Ophthalmol Soc 1981; 79: 734-770.
- Carruthers JD, Carruthers JA: Trattamento delle rughe glabellari con l’esotossina C. botulinum-A. J Dermatol Surg Oncol 1992 Jan; 18(1): 17-21.
- Bushara KO, et al: Tossina botulinica – un possibile nuovo trattamento per l’iperidrosi ascellare. Clin Exp Dermatol 1996 Jul; 21(4): 276-278.
- Kreyden OP, Böni R, Burg G: Iperidrosi e tossina botulinica in dermatologia. Problemi attuali in dermatologia Karger 2002. ISBN 0070-2064.
- Barker WH: Botulismo. La Storia mondiale delle malattie umane di Cambridge. Kiple, KF e Graham 1993; 623-625.
- Kao I, Drachman DB, Price DL: Tossina botulinica: meccanismo di blocco presinaptico. Science 1976; 193: 1256-1258.
- Philipp-Dormston WG: Tossina botulinica in dermatologia. Der Hautarzt 2014; 65: 133-145.
PRATICA DERMATOLOGICA 2015; 25(1): 29-34