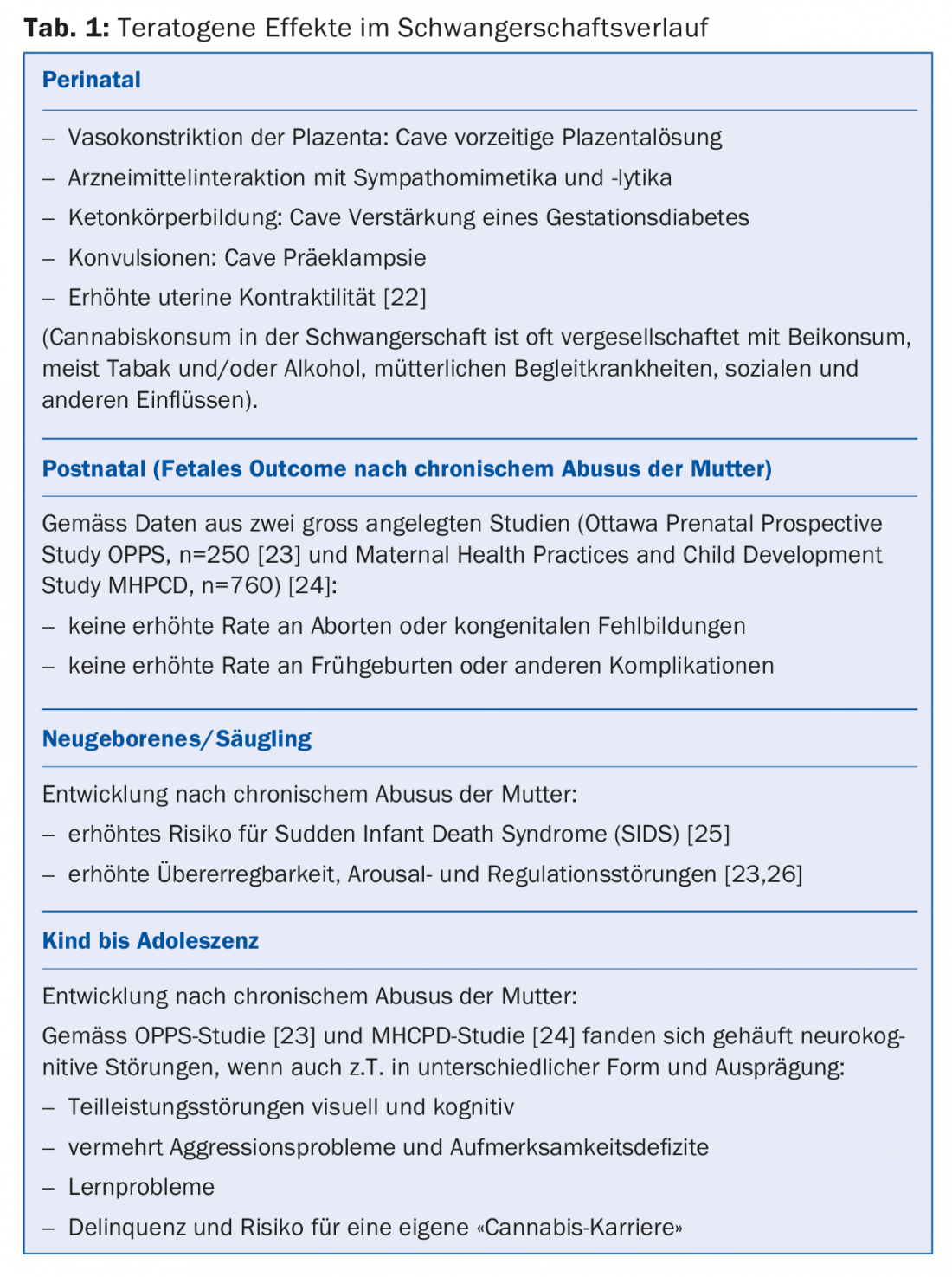
Il consumo di cannabis ha effetti perinatali potenzialmente dannosi. Tuttavia, il tasso di aborti, malformazioni congenite, nascite premature o altre complicazioni non aumenta. L’abuso cronico di cannabis da parte della madre è associato a un rischio maggiore di sindrome della morte improvvisa del lattante nei neonati e può portare a disturbi dell’eccitazione e della regolazione nei bambini.
La Cannabis è una pianta annuale utile e ornamentale e appartiene al genere della canapa. I botanici distinguono tra canapa comune (C. sativa) e canapa indiana (C. sativa var. indica). I prodotti includono fibre, oli e semi di canapa. I seguenti estratti di canapa sono considerati intossicanti o psicoattivi (legandosi ai recettori cannabinoidi CB1 e CB2):
- Marijuana: petali e brattee essiccate; la resina secreta dalle squame ghiandolari è responsabile degli effetti. La marijuana viene principalmente fumata. Per ogni “joint”, circa 0,2 g di fiori vengono mescolati con il tabacco.
- Hashish: la resina essiccata viene fumata, masticata o mangiata. 200 mg di hashish corrispondono all’effetto di 1 g di marijuana. La resina è una miscela di almeno 40 cosiddetti cannabinoidi.
Tra i principi attivi importanti vi sono l’acido cannabidiolico (0,3-0,7%) e il suo prodotto di degradazione, lo psicotropo delta-9-tetraidrocannabinolo (Δ9THC o THC; 0,1-0,5%) [1]. In generale, si dice che il contenuto di THC nelle varietà di piante più moderne sia in aumento [2]. I cannabinoidi sintetici “Spice” sono circa 500 volte più potenti [3]. Negli Stati Uniti, la marijuana era considerata l’antidolorifico più comune fino al 1898. Dal 1928 (Conferenza sull’oppio) la cannabis fa parte degli oppiacei ed è illegale; dal 2004 in poi si è assistito a una crescente legalizzazione, ad esempio in molti Stati degli USA e in Canada per l’uso della cannabis a scopo medico [2,5]. Il periodo di massimo splendore della canapa in Europa è stato intorno al 1700 (prodotti nautici, tessili, carta); le prime tracce dell’uso della canapa (in Asia) esistevano già nel 10.000 a.C. Tra il 1850 e il 1930, in Svizzera sono stati sviluppati più di 100 diversi farmaci a base di cannabis [4]. Oggi ci sono grandi sforzi per la legalizzazione, soprattutto per scopi medici.
Dati epidemiologici
Il consumo di cannabis è aumentato negli ultimi decenni sia negli Stati Uniti che in Europa e colpisce gli uomini in tre quarti dei casi. A seconda delle statistiche, la prevalenza è quasi doppia negli Stati Uniti (circa l’8%) rispetto all’Europa (circa il 4%) [15,18,19].
Dati sulla prevalenza del consumo di cannabis (uso di nicotina) in gravidanza:
- USA: gravidanza totale: 5,2% (16%), primo trimestre: 10,7% (23,2%), secondo trimestre: 2,8% (13,6%), terzo trimestre: 2,3% (11,1%) [20].
- Svizzera: i dati del 2008 mostrano che la frequenza del consumo di cannabis prima dell’inizio della gravidanza diminuisce dal 5,4% al 2,1% (quando la gravidanza è nota) e scende all’1,5% dopo il parto [21].
Farmacocinetica del THC
Quando il tetraidrocannabinolo (THC) viene assorbito per inalazione o per via orale, si ottiene un effetto dopo 30-90 minuti, che dura da quattro a otto ore. Il Δ9-THC viene prevalentemente ossidato nell’uomo a 11-idrossi-Δ9-THC (11-OH-Δ9 THC) (psicoattivo) e ulteriormente metabolizzato a 11-nor-9-carbossi-Δ9-THC (11-COOH-THC, THC-COOH, acido carbossilico del THC, non psicoattivo). Nell’uomo e negli animali sono stati identificati oltre 100 diversi metaboliti del Δ9-THC, quasi tutti non psicoattivi. La metabolizzazione avviene principalmente nel fegato e da parte degli enzimi del citocromo P450 2C9, 2C19 e 3A4 [6].
Gli effetti psicologici si verificano da 30 μg/kg a 50 μg/kg per via endovenosa, 50 μg/kg per inalazione di fumo e 120 μg/kg per via orale. Con l’inalazione di fumo da 5 a 7 mg predomina la componente sedativa, con ≥15 mg la vigilanza [7]. Il THC si lega prevalentemente alle proteine nel plasma sanguigno. L’eliminazione dal plasma si sviluppa in diverse fasi: due o tre più brevi (da alcuni minuti a ore) e una terminale lunga. L’emivita terminale è riportata in media a 21 ore. Dopo cinque giorni, circa l’80%-90% del THC viene escreto sotto forma di metaboliti, circa due terzi nelle feci e un quinto nelle urine [8].
Non esistono dati cinetici specifici per la gravidanza. L’assorbimento placentare è rapido, le concentrazioni sieriche fetali superano quelle materne [9]. La quantità assorbita dal bambino attraverso il latte materno per ogni pasto di allattamento corrisponde a circa lo 0,8% della quantità assorbita dalla madre [10]. Il rilevamento nella madre avviene nelle urine, nel siero (da alcuni giorni a un mese) e nei capelli (da alcuni mesi ad anni); il rilevamento nel neonato avviene nel meconio (secondo e terzo trimestre) o nei capelli (terzo trimestre).
Effetti del THC nell’uso cronico
- Malattie respiratorie e circolatorie croniche dovute a livelli elevati di monossido di carbonio (circa cinque volte superiori a quelli che si ottengono fumando sigarette di tabacco puro). [11]
- Cambiamenti psicologici: Sedazione, euforia, perdita della realtà, ansia; cambiamenti di natura [12]; a lungo termine: paranoia, allucinazioni, psicosi.
- Prestazioni cognitive compromesse [13,14]
- Perdita del controllo degli impulsi [15]
- Perdita della coordinazione motoria
- Attivazione simpatica: vasocostrizione, broncodilatazione, aumento della frequenza cardiaca e della lipolisi.
- Basso potenziale di dipendenza grazie allo sviluppo della tolleranza, droga di passaggio all’eroina!
- Componenti sociali: Disoccupazione più elevata [13,14,16], contraccezione peggiore [17]
Risultati relativi all’allattamento al seno
Circa il 40-80% delle madri continua a farne uso nel periodo postnatale. Un bambino allattato al seno assorbe circa lo 0,8% della dose materna [10], nei consumatori cronici questa dose aumenta fino a otto volte [27]. La cannabis inibisce la produzione di latte (la prolattina diminuisce) [28].
Le raccomandazioni per l’allattamento al seno variano. Negli Stati Uniti, ad esempio, le raccomandazioni sono molto diverse. L’AAP (American Academy of Pediatrics) scoraggia l’allattamento al seno, l’Accademia dell’allattamento al seno consente l’allattamento al seno [31], il Centro per le dipendenze di Baltimora mette in guardia [32]. In Svizzera, non ci sono raccomandazioni a livello nazionale. L’educazione delle donne al parto è una misura importante. In Svizzera, l’allattamento al seno è consentito nei casi di consumo lieve senza uso concomitante. Nei casi di forte consumo di cannabis, a causa della ridotta attenzione della madre verso il bambino e della sedazione del bambino (SIDS), l’allattamento al seno è controindicato (raccomandazioni dell’Ospedale pediatrico universitario di Basilea UKBB).
Per quanto riguarda le conseguenze per il bambino allattato al seno, i dati empirici sono piuttosto limitati. Esistono prove di un ritardo nello sviluppo motorio nei neonati di un anno [29], di debolezza nel bere, di sedazione con un consumo regolare e abbondante da parte della madre [30], e della sindrome della morte improvvisa del lattante (SIDS).
Messaggi da portare a casa
- Il consumo di cannabis durante la gravidanza è associato a problemi significativi per la madre e il bambino. I dati confermati sull’effetto dannoso sulla madre o sul decorso della gravidanza e sul feto servono come aiuto di orientamento per la diagnosi approfondita delle malformazioni, che è indicata in ogni caso.
- Il fatto che solo la cannabis sia usata raramente, ma soprattutto l’uso misto, è probabilmente un’aggravante. Oltre a tutti i potenziali effetti, la cura di una donna incinta che fa uso di farmaci non deve ignorare il fatto che le condizioni generali della donna incinta sono spesso ridotte.
- Le donne incinte che fanno uso di droghe richiedono quindi un’assistenza e una consulenza intensiva da parte degli ostetrici, di solito in collaborazione con altre discipline mediche, tra cui la psichiatria sociale.
Letteratura:
- Garcia GL, et al.: Livelli di legame e di mRNA dei recettori dei cannabinoidi in diverse regioni cerebrali di ratti adulti maschi e femmine esposti perinatalmente al delta9-tetraidrocannabinolo. Dipendenza da droga e alcol 1999; 55: 127-136.
- Warner TD, Roussos-Ross D, Behnke M: Non è la marijuana di tua madre: effetti sulla salute materno-fetale e sullo sviluppo del bambino. Clin Perinatol 2014; 41: 877-894.
- Psychoyos D, Vinod KY: Marijuana, Spice “herbal high” e sviluppo neurale precoce: implicazioni per la riprogrammazione e la legalizzazione. Drug Test Anal 2013; 5: 27-45.
- Fankhauser M: L’hashish come medicina. Sull’importanza della Cannabis sativa nella medicina occidentale. Società Svizzera per la Storia della Farmacia (SGGP/SSHP), Langnau: 2002, ISBN 3-9520758-9-2.
- Metz TD, Stickrath EH: Uso di marijuana in gravidanza e allattamento: una revisione delle prove. Am J Obstet Gynecol 2015; 213: 761-778.
- Gustafson RA, et al: Farmacocinetica urinaria dell’11-nor-9-carbossi-delta9-tetraidrocannabinolo dopo somministrazione orale controllata di delta9-tetraidrocannabinolo. J Anal Toxicol 2004; 28: 160-167.
- Chiang CN, Rapaka RS: Farmacocinetica e disposizione dei cannabinoidi. NIDA Res Monogr 1987; 79: 173-188.
- Heuberger JA, et al.: Il modello farmacocinetico di popolazione del THC integra il dosaggio orale, endovenoso e polmonare e caratterizza la farmacocinetica a breve e lungo termine. Clin Pharmacokinet 2015; 54: 209-219.
- Bailey JR, et al: Disposizione fetale del delta 9-tetraidrocannabinolo (THC) durante la tarda gravidanza nella scimmia rhesus. Toxicol Appl Pharmacol 1987; 90 (2): 315-321.
- Djulus J, Moretti M, Koren G: Uso di marijuana e allattamento al seno. Can Fam Physician 2005; 51 (3): 349-350.
- Macleod J, et al: Cannabis, fumo di tabacco e funzione polmonare: uno studio osservazionale trasversale in una popolazione di medicina generale. Br J Gen Pract 2015; 65: e89-95.
- Gilman JM, et al: L’uso di cannabis è quantitativamente associato ad anomalie del nucleo accumbens e dell’amigdala nei giovani adulti consumatori ricreativi. J Neurosci 2014; 34 (16): 5529-5538.
- Auer R, et al.: Associazione tra l’uso di marijuana nel corso della vita e la funzione cognitiva nella mezza età: lo studio CARDIA (Coronary Artery Risk Development in Young Adults). JAMA Intern Med 2016; 176 (3): 352-361.
- Pedersen W, Skardhamar T: Cannabis e crimine: risultati di uno studio longitudinale. Addiction 2010; 105 (1): 109-118.
- Ansell EB, et al: Effetti dell’uso di marijuana sull’impulsività e l’ostilità nella vita quotidiana. Droga Alcol Dipendenza 2015; 148: 136-142.
- Meier MH, et al: I consumatori persistenti di cannabis mostrano un declino neuropsicologico dall’infanzia alla mezza età. Proc Natl Acad Sci U S A 2012; 109(40): E2657-64.
- Morrison LF, et al: Fattori protettivi, indicatori di rischio e coerenza contraccettiva tra le donne universitarie. J Obstet Gynecol Neonatal Nurs 2016; 45 (2): 155-165.
- Istituto Nazionale sull’Abuso di Droga (NIH). Marjuana. www.drugabuse.gov/drugs-abuse/marijuana, ultimo accesso 18.10.2018
- Osservatorio europeo delle droghe e delle tossicodipendenze. Rapporto europeo sui farmaci 2017: tendenze e sviluppi. www.emcdda.europa.eu/publications/edr/trends-developments/2017_en, ultimo accesso 18.10.2018
- Amministrazione dei Servizi per l’Abuso di Sostanze e la Salute Mentale. Risultati dell’Indagine nazionale sull’uso e la salute delle droghe del 2013: Sintesi dei risultati nazionali. www.samhsa.gov/data/sites/default/files/NSDUHresultsPDFWHTML2013/Web/NSDUHresults2013.pdf, ultimo accesso 18.10.2018
- Grob A, Lemola S: Screening del consumo di sostanze nell’assistenza prenatale. Studio commissionato dall’Ufficio federale della sanità pubblica (UFSP) 2008.
- Murthy NVA, Melville GN, Wynter HH: Risposte contrattili del muscolo liscio uterino all’acetilcolina e all’estratto di marijuana. Int J Gynaecol Obstet 1983; 21 (3): 223-226.
- Fried PA: L’Ottawa Prenatal Prospective Study (OPPS): problemi metodologici e risultati – è facile buttare via il bambino con l’acqua sporca. Life Sci 1995; 56 (23-24): 2159-2168.
- Goldschmidt L, et al: Iniziazione precoce alla marijuana: il legame tra esposizione prenatale alla marijuana, comportamento nella prima infanzia e ruoli adulti negativi. Neurotoxicol Teratol 2016; 58: 40-45.
- Klonoff-Cohen H, Lam-Kruglick P: Uso materno e paterno di droghe ricreative e sindrome della morte improvvisa del lattante. Arch Pediatr Adolesc Med 2001; 155 (7): 765-770.
- de Moraes Barros MC, et al: L’esposizione alla marijuana durante la gravidanza altera il comportamento neurologico nel primo periodo neonatale. J Pediatr 2006; 149 (6): 781-787.
- Perez-Reyes M, Wall ME: Presenza di delta9-tetraidrocannabinolo nel latte umano. N Engl J Med 1982; 307 (13): 819-820.
- Murphy LL, et al.: Funzione dei recettori dei cannabinoidi nella regolazione neuroendocrina della secrezione ormonale. Neurobiol Dis 1998; 5: 432-446.
- Astley SJ, Little RE: Uso materno di marijuana durante l’allattamento e sviluppo del bambino a un anno. Neurotoxicol Teratol 1990; 12 (2): 161-168.
- Liston J: Allattamento e uso di droghe ricreative – alcol, caffeina, nicotina e marijuana. Breastfeed Rev 1998; 6 (2): 27-30.
- Reece-Stremtan S, Marinelli KA: Protocollo clinico ABM #21: linee guida per l’allattamento al seno e l’uso di sostanze o il disturbo da uso di sostanze, rivisto nel 2015. Breastfeed Med 2015; 10(3): 135-141.
- Jansson LM, Bunik M, Bogen DL: Allattamento e madre che fa uso di marijuana. Breastfeed Med 2015; 10 (6): 342-343.
PRATICA GP 2018; 13(11): 23-25