Le embolie cardiogene sono per lo più trombi embolizzati dall’orecchio atriale sinistro nella fibrillazione atriale. La profilassi primaria e secondaria degli eventi ischemici cerebrali si basa sulla loro causalità, se questa può essere determinata, e comprende l’anticoagulazione orale o misure correttive come la chiusura di un forame ovale persistente, un difetto del setto atriale o l’esclusione dell’appendice atriale sinistra, per evitare le complicanze crescenti a lungo termine dell’anticoagulazione orale o un rischio elevato di embolia in assenza di anticoagulazione.
L’ictus (infarto cerebrale o apoplessia), che è per circa l’85% ischemico, è la seconda causa di morte più comune dopo la cardiopatia coronarica, ha un’incidenza annuale di circa 250 su 100.000 persone in Europa occidentale ed è la causa più comune di disabilità permanente, spesso con gravi conseguenze psicosociali ed economiche. La mortalità rimane elevata, pari al 25% (50% nei pazienti sotto i 65 anni), nonostante i progressi medici nel trattamento acuto degli ultimi due decenni. [1–3]. Oltre l’80% degli emboli clinicamente evidenti interessa la circolazione cerebrale, di cui l’80% nella circolazione anteriore (carotidea) e il 20% in quella posteriore.
Il cuore come sito di formazione di trombi e quindi fonte di emboli è stato menzionato per la prima volta in un caso di Gowers nel 1875 [4]. Le tecniche di imaging come l’ecocardiografia transoesofagea (TÖE), la tomografia computerizzata con ricostruzione angiografica, l’ecografia Doppler e la risonanza magnetica possono essere utilizzate per documentare o almeno sospettare fortemente alcune delle fonti di embolia nell’attuale contesto clinico.
Una percentuale di tutti gli ictus ischemici (20 – 33%) che viene sottostimata a causa della rilevazione diretta spesso impossibile, viene chiamata cardiogeno-embolica. Tra queste, la fibrillazione atriale (VF) svolge il ruolo più significativo (Fig. 1).
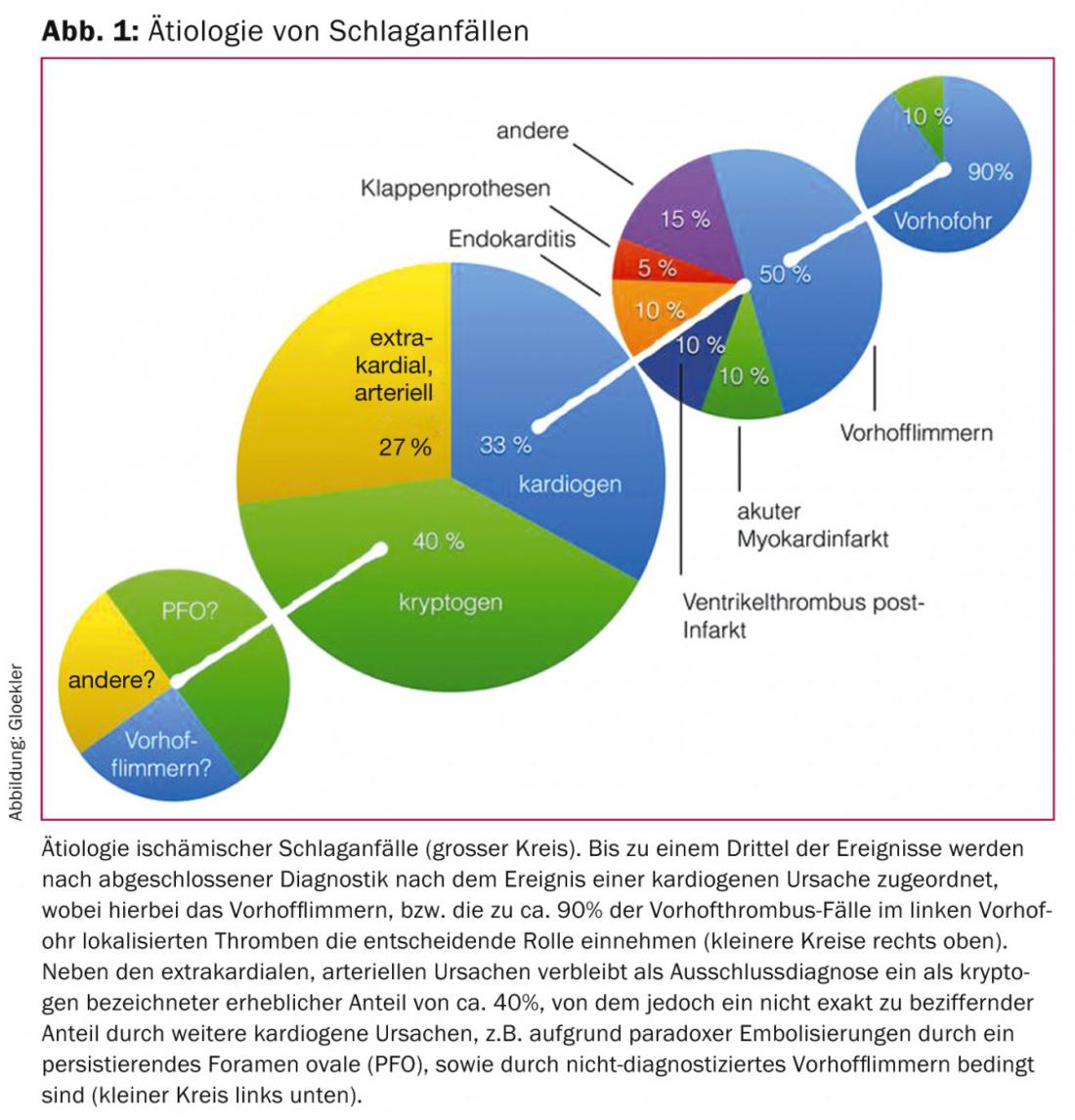
Nella FV, la formazione di un trombo si verifica in oltre il 90% dei casi nel tubo atriale sinistro, un residuo cieco di una vena polmonare primordiale.
In circa il 40% di tutti gli ictus, nella breve finestra temporale del work-up diagnostico dopo un evento, non vengono trovate cause cardiache o extracardiache oggettive. Tali ictus sono quindi spesso chiamati criptogenetici (inspiegabili) – ma questa categoria è sovrastimata. Gli ictus criptogenetici non sono in linea di principio possibili e riflettono le nostre debolezze diagnostiche. Ad esempio, la presenza di un forame ovale persistente (PFO) o di un difetto del setto atriale (ASD) è raramente chiarita e non viene riconosciuta come una causa convenzionale di ictus anche in un caso positivo. Anche la VF non rilevata è raramente esclusa con la massima coerenza. Pertanto, il numero di ictus (trans)cardiaci è più alto di quanto generalmente ritenuto. Se gli infarti cerebrali sono presenti in aree correnti diverse, ciò suggerisce una fonte di embolia distante dal cervello, e la FV, il PFO e le vene polmonari non valutabili vengono alla ribalta come fonti di embolia.
Si spera che la terapia preventiva correttiva possa essere migliorata e che venga utilizzata più spesso.
Fibrillazione atriale, causa più comune di embolia cardiogena
Circa il 20% di tutti gli ictus ischemici sono attribuiti all’embolia cardiogena dovuta alla FV. La fibrillazione ventricolare è l’aritmia più comune, con un continuo aumento della prevalenza e dell’incidenza (migliore rilevazione e aumento dell’età media della popolazione) negli ultimi decenni. La sua prevalenza è superiore al 7% nelle donne e superiore al 10% negli uomini di età superiore agli 80 anni. [5,6] (Fig. 1).
In due studi pubblicati di recente che hanno monitorato il ritmo cardiaco dei pazienti dopo l’ictus criptogenetico rispetto a un ECG Holter standard utilizzando un registratore impiantabile o un registratore di eventi a 30 giorni (studio CRYSTAL AF [7] e studio EMBRACE [8]), la fibrillazione atriale parossistica è stata documentata significativamente più spesso nei pazienti con il metodo di registrazione prolungato (12,4 vs. 2,0% durante un anno in CYSTAL AF, e 16,1 vs. 3,2% durante tre mesi in EMBRACE). 16,1 contro il 3,2% durante i tre mesi in EMBRACE). Di conseguenza, un numero significativamente maggiore di pazienti nei gruppi con monitoraggio migliorato ha ricevuto una protezione contro l’ictus ricorrente iniziando l’anticoagulazione orale (OAC). La fibrillazione ventricolare è sottodiagnosticata e quindi sottotrattata nel contesto della ricerca della fonte dell’ictus ischemico.
Trattamento standard con anticoagulazione permanente
Sia la classica OAK permanente con antagonisti della vitamina K (VKA) che i nuovi agenti tipo anticoagulazione orale senza antagonismo della vitamina K (NOAK) riducono l’incidenza dell’ictus ischemico e della morte di due terzi e di un quarto, rispettivamente, e sono efficaci nella profilassi degli eventi ischemici [9–13]. Nel caso dell’OAK classica, tuttavia, c’è un chiaro sottoutilizzo anticipato a causa del sanguinamento o dell’aumento del rischio di sanguinamento (ad esempio, in caso di rischio di caduta) [14–16]. Per esempio, fino al 44% dei pazienti con fibrillazione atriale non riceve alcun OAC come protezione dagli eventi embolici [17]. In un ampio studio svedese del registro nazionale degli ictus con oltre 21.077 pazienti dopo un ictus ischemico nella fibrillazione atriale, i tassi di interruzione del trattamento per l’OAK sono stati documentati in cinque terzi nei primi due anni dopo un’apoplessia: Dopo due anni, invece dell’iniziale 89% dei pazienti, solo il 45% dei pazienti era protetto dalla recidiva di apoplessia grazie all’OAK. (Fig. 2) [18].
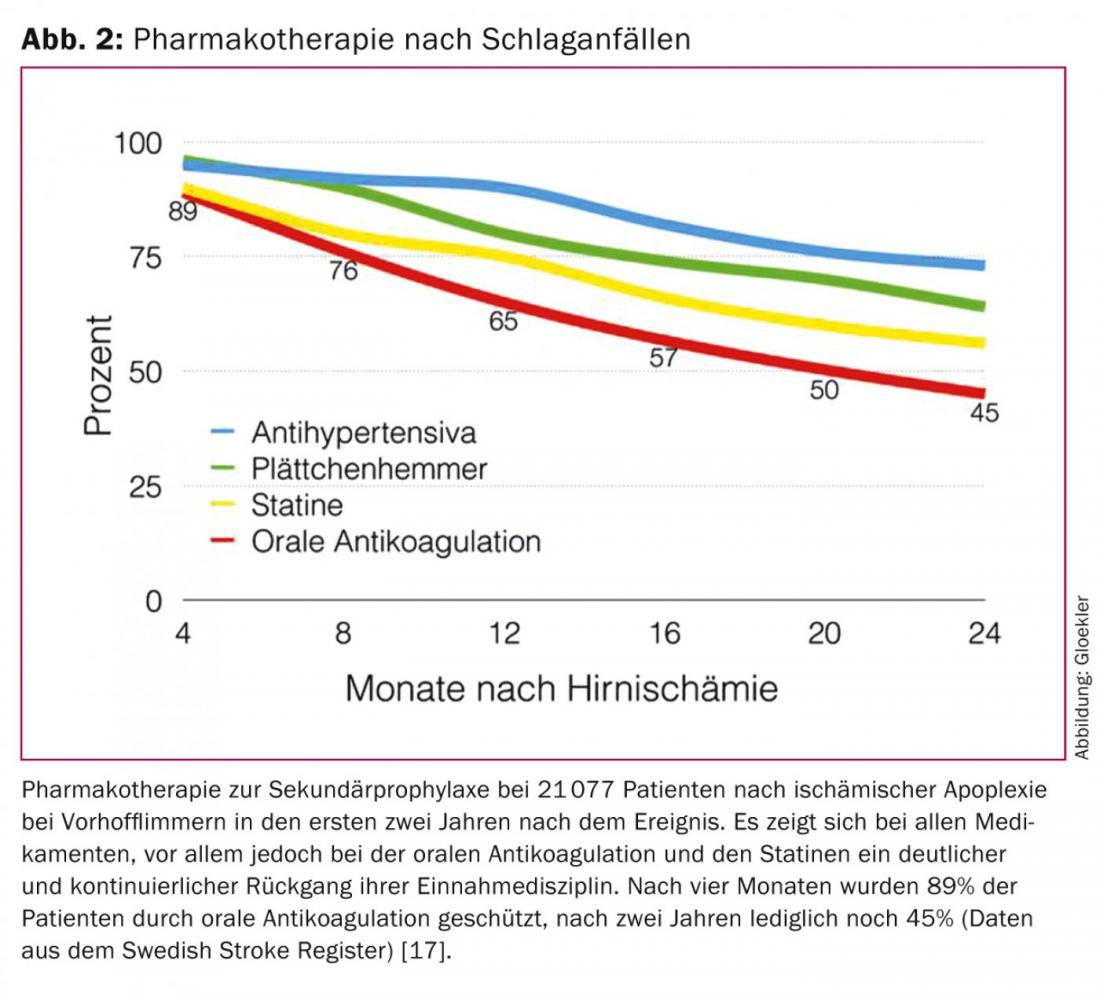
Il problema dell’alto tasso di interruzione della terapia per l’OAK è noto anche da altri studi e dalla pratica clinica quotidiana. Un’altra limitazione è che nel 30-46% dei pazienti che continuano l’OAH, il valore dell’INR (International Normalised Ratio) è al di fuori dell’intervallo terapeutico, con una protezione embolica inadeguata (INR <2) o un aumento del rischio di sanguinamento (INR >3) [13,19]. Se è possibile somministrare un’OAC in modo permanente, la protezione embolica deve essere pagata con tassi annui di emorragia rilevanti fino al 15%, che tendono ad aumentare nel corso degli anni [10–12].
Nei grandi studi di registrazione dei tre NOAK approvati in Svizzera: RE-LY (“Dabigatran Randomised Evaluation of Long-Term Anticoagulation Therapy”) [10]ROCKET AF (“Rivaroxaban una volta al giorno, per via orale, inibizione diretta del Fattore Xa rispetto all’antagonismo della vitamina K per la prevenzione dell’ictus e dell’embolia Trial nella fibrillazione atriale”) e ARISTOTLE (“Apixaban for Reduction In Stroke and Other ThromboemboLic Events in Atrial Fibrillation”), oltre a edoxaban, che attualmente non è ancora approvato in Svizzera: ENGAGE AF-TIMI 48 (“Edoxaban versus Warfarin in Patients with Atrial Fibrillation”) ha dimostrato costantemente che il NOAK è equivalente o superiore all’OAK classico per quanto riguarda la profilassi dell’apoplessia. Il rischio di emorragia intracranica grave e soprattutto pericolosa per la vita è significativamente ridotto con la NOAK rispetto alla classica OAK, ma il tasso di emorragia gastrointestinale è leggermente aumentato [10–13]. Per l’uso dei NOAK, si rimanda a un articolo di revisione pubblicato di recente [20].
Nonostante i vantaggi delle NOAK rispetto alle OAK classiche, nei singoli studi è stato documentato un tasso di interruzione del 17-27% anche con le NOAK, nonché un tasso di emorragia annuale compreso tra il 3,1 (RE-LY) e il 14,4% (ROCKET AF), a seconda della classe di rischio delle diverse popolazioni di studio. Un altro svantaggio, tuttavia, che viene sopravvalutato, è la mancanza di mezzi affidabili per una rapida inversione dell’anticoagulazione in caso di emorragia pericolosa per la vita.
Quindi, anche con le NOAK, è nella natura delle cose che un’adeguata anticoagulazione comporti sempre un certo tasso di sanguinamento rilevante.
Chiusura del tubo atriale sinistro come profilassi alternativa dell’ictus
A causa del fatto, ben documentato da studi patologici, chirurgici e di imaging, che più del 90% di tutti i trombi nella fibrillazione atriale provengono dal sacco cieco dell’appendice atriale sinistra (LVO), nonché dei rischi di OAC e NOAC sistemici all’infinito, l’esclusione dell’LVO dal flusso sanguigno mediante occlusione chirurgica o con catetere è un’opzione. [21,22]. Il metodo chirurgico è stato pubblicato per la prima volta da Madden nel 1949 [23], ma non ha ottenuto l’accettazione generale a causa dei risultati di esclusione incompleti e della mancanza di studi comparativi.
L’efficacia e la sicurezza del concetto di un intervento una tantum al posto dell’anticoagulazione permanente per raggiungere l’obiettivo comune di un’efficace profilassi dell’ictus con pochi effetti collaterali sono state dimostrate per la prima volta in modo randomizzato nello studio PROTECT AF. [24] ed è supportato dallo studio PREVAIL, pubblicato di recente, anch’esso randomizzato. [25] Sottotitolo: una chiusura VHO una tantum con il sistema WATCHMAN è almeno competitiva con l’OAK permanente con warfarin. Dai dati attualmente non pubblicati con un periodo di osservazione prolungato dello studio PROTECT AF, è logico ipotizzare una superiorità della chiusura del VHO con catetere rispetto alla prosecuzione dell’anticoagulazione, poiché il beneficio netto della chiusura del VHO rispetto alla prosecuzione dell’anticoagulazione aumenta con l’aumentare della durata dell’intervento. È interessante notare che questo beneficio netto era più pronunciato nei pazienti ad alto rischio [26]. Per l’Amplatzer Cardiac Plug, che rispetto alla configurazione a cappuccio del sistema WATCHMAN ha un corpo che occlude il lume del VHO e un disco che sigilla l’ostio del VHO, è realizzato in nitinolo e viene impiantato secondo il principio del manichino, esistono dati simili provenienti da studi più piccoli e non randomizzati (Figg. 3 e 4) [27–30].
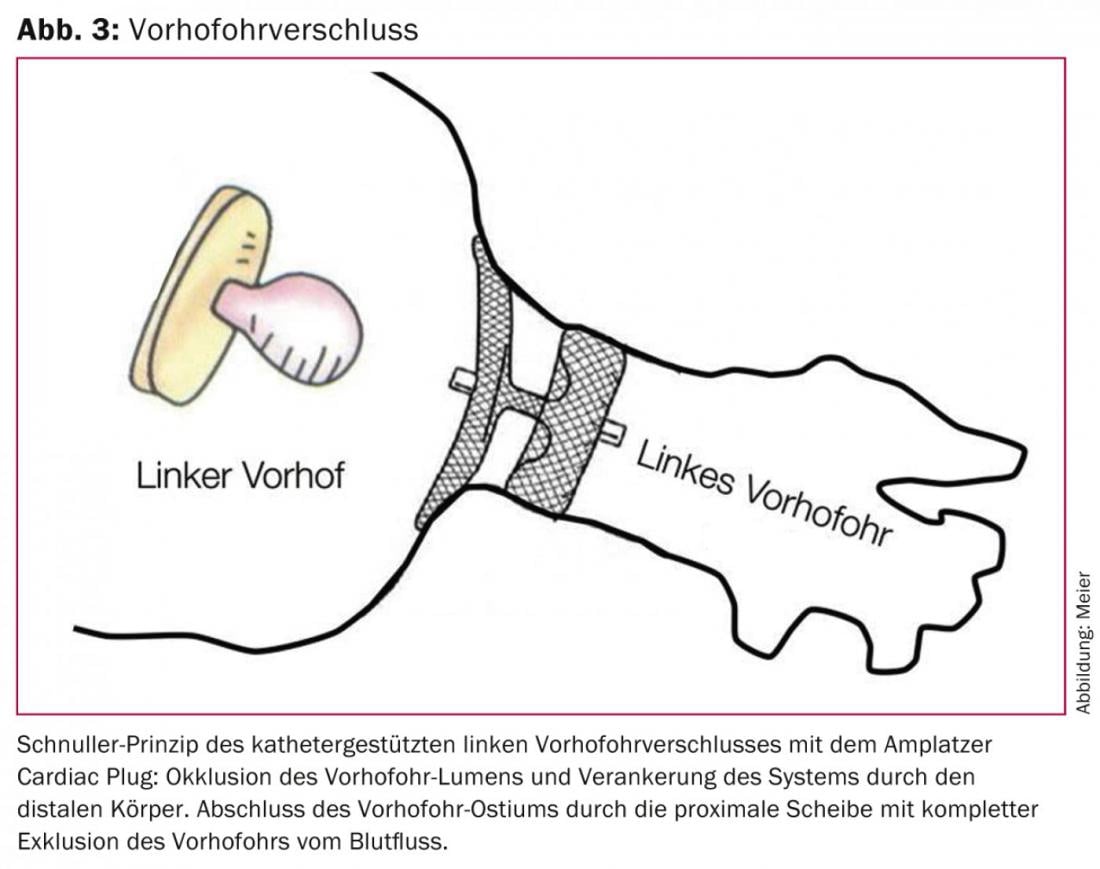
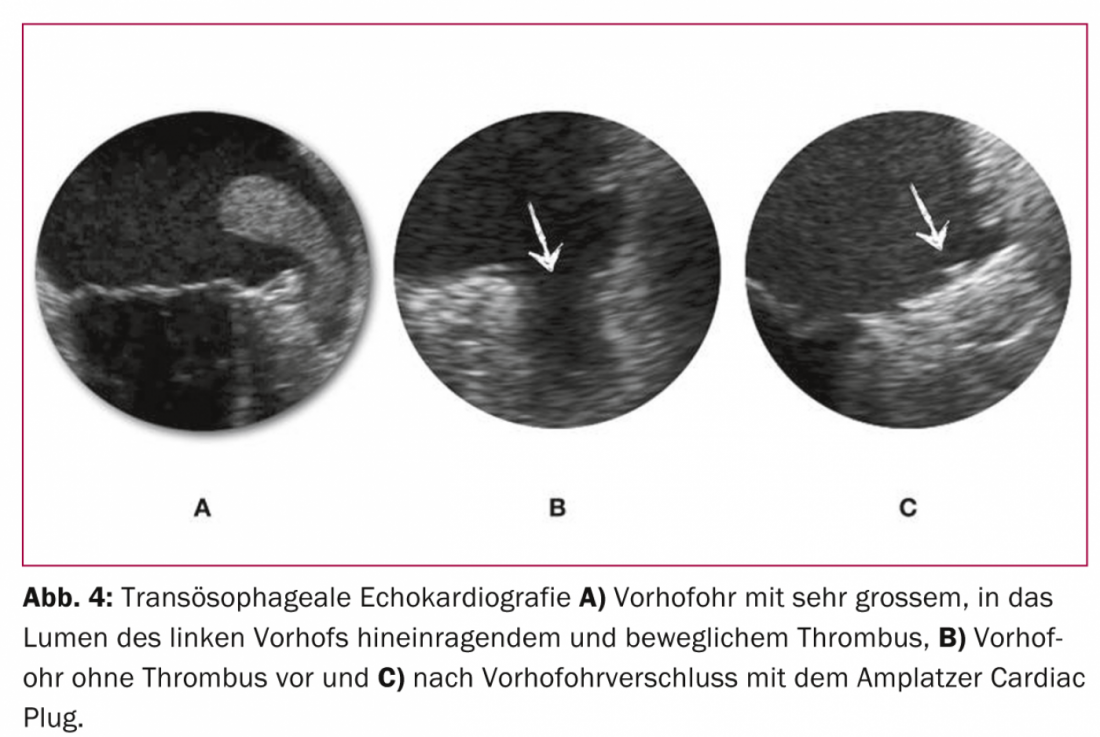
Come ogni intervento, la chiusura del VHO ha un certo tasso di complicanze. Con oltre 400 pazienti trattati nel nostro centro con il sistema Amplatzer e senza punta o anestesia generale, l’endpoint di sicurezza combinato delle complicanze rilevanti (morte, ictus procedurale, tamponamento pericardico o necessità di revisione chirurgica) è dell’8,5%. Questo dato si confronta con un tasso di emorragia maggiore annuale di circa il 4% con rivaroxaban nello studio ROCKET AF [11], che ha studiato pazienti a rischio comparabile di eventi cerebrovascolari ed emorragie. In linea di principio, quindi, i tassi previsti di complicanze periprocedurali una tantum della chiusura VHO devono essere soppesati rispetto a quelli delle complicanze cumulative della (N)OAK. Quindi, con un’aspettativa di vita residua approssimativa di tre anni o più, si può ipotizzare un beneficio clinico e prognostico netto della chiusura del VHO rispetto all’anticoagulazione permanente. Ciò è confermato dai dati non ancora pubblicati dello studio PROTECT AF, con l’evidenza per la prima volta di una riduzione significativa della mortalità per tutte le cause a favore della chiusura del VHO.
Sulla base di questi dati, la chiusura del VHO mediante catetere è un’alternativa equivalente all’anticoagulazione permanente nel medio termine e superiore nel lungo termine. Gli studi comparativi con NOAK dovranno aspettare. Data la comprovata efficacia dell’occlusione VHO e le limitazioni delle NOAK, si può ipotizzare che l’occlusione VHO sia fondamentalmente competitiva o addirittura superiore a causa delle differenze concettuali nella profilassi dell’ictus cerebrale.
Sebbene l’ablazione con radiofrequenza mediante catetere sia una terapia valida per controllare i sintomi, non è curativa e raramente salva la profilassi dell’ictus mediante (N)OAK o l’occlusione del VHO mediante catetere nel lungo termine. Si tratta quindi di un’aggiunta preziosa alla profilassi dell’ictus piuttosto che di un’alternativa [31].
Embolia paradossale dovuta a un forame ovale persistente o a un difetto del setto atriale.
Un collegamento tra ictus criptogenetico e PFO è stato descritto già nel 1877 da Julius Conheim e successivamente da numerosi altri [32]. La ricerca di un PFO è una procedura diagnostica standard dopo un evento cerebrovascolare in tutti i pazienti, soprattutto in quelli più giovani che non hanno ancora l’aterosclerosi [33]. Rispetto ai molto più rari ASD, che sono veri e propri difetti strutturali del setto, il PFO è una fessura o un tunnel residuo dovuto alla fusione incompleta delle due parti del setto interatriale nel periodo postnatale. Dopo la pubblicazione dei tre studi randomizzati CLOSURE I (“Evaluation of the STARFlex Septal Closure System in Patients with a Stroke and/or Transient Ischemic Attack due to Presumed Paradoxycal Embolism through
un Forame Ovale Brevettato”) [34]PC (“Studio clinico di confronto tra la chiusura percutanea del paziente Forame Ovale con l’occlusore Amplatzer PFO e il trattamento medico nei pazienti con embolia criptogenetica”). [35] e RESPECT (“Randomized Evaluation of Recurrent Stroke Comparing PFO Closure to Established Current Standard of Care Treatment”). [36]La situazione rimane controversa in considerazione delle limitazioni insite in ogni studio, come il tipo di sistema di chiusura, il numero di pazienti e la durata del periodo di osservazione. Questi studi non sono riusciti a dimostrare una superiorità significativa della chiusura del PFO rispetto alla terapia farmacologica [34–38]. Tuttavia, almeno nei sottogruppi con shunt di grandi dimensioni, aneurismi settali o la coincidenza di strutture come la valvula eustachii o le reti di Chiari, si può ipotizzare la superiorità della chiusura del PFO rispetto alla terapia farmacologica. In termini di sicurezza della procedura, il sistema Amplatzer è superiore al sistema Starflex testato nello studio CLOSURE I [39]. A causa del numero ridotto di eventi in tutti e tre gli studi randomizzati, non hanno la potenza statistica ipotizzata al momento della loro progettazione: ad esempio, nello studio CLOSURE I, su 909 pazienti, il 5,5 contro il 6,8% (p=0,37) ha raggiunto l’endpoint combinato di ictus, attacco ischemico transitorio (TIA) ed embolia sistemica durante un periodo di follow-up di due anni, e il 2,9 contro il 3,1% (p=0,79) ha raggiunto l’endpoint del solo ictus. [34]. Nello studio PC, un altro studio prospettico e randomizzato con 414 pazienti, che, come lo studio RESPECT, ha eseguito la chiusura del PFO con i sistemi amplatzer (Fig. 5) rispetto alla terapia farmacologica in un periodo di follow-up da due a quattro anni, 3,4 (n=7) contro 5,2% (n=11) hanno raggiunto l’endpoint combinato di morte, ictus, TIA o embolia sistemica (p=0,34) [35]. Nello studio RESPECT, 980 pazienti sono stati randomizzati e seguiti per 2,5 anni: Nove pazienti nel gruppo occlusione rispetto a 16 pazienti nel gruppo farmaco hanno subito un evento cerebrovascolare durante questo periodo (p=0,08) [36]. Ci sarà un’ulteriore raccolta di dati in questi due studi ed è probabile che con un periodo di follow-up prolungato, la precedente tendenza a favore della chiusura del PFO con il sistema Amplatzer si trasformerà in una differenza significativa.
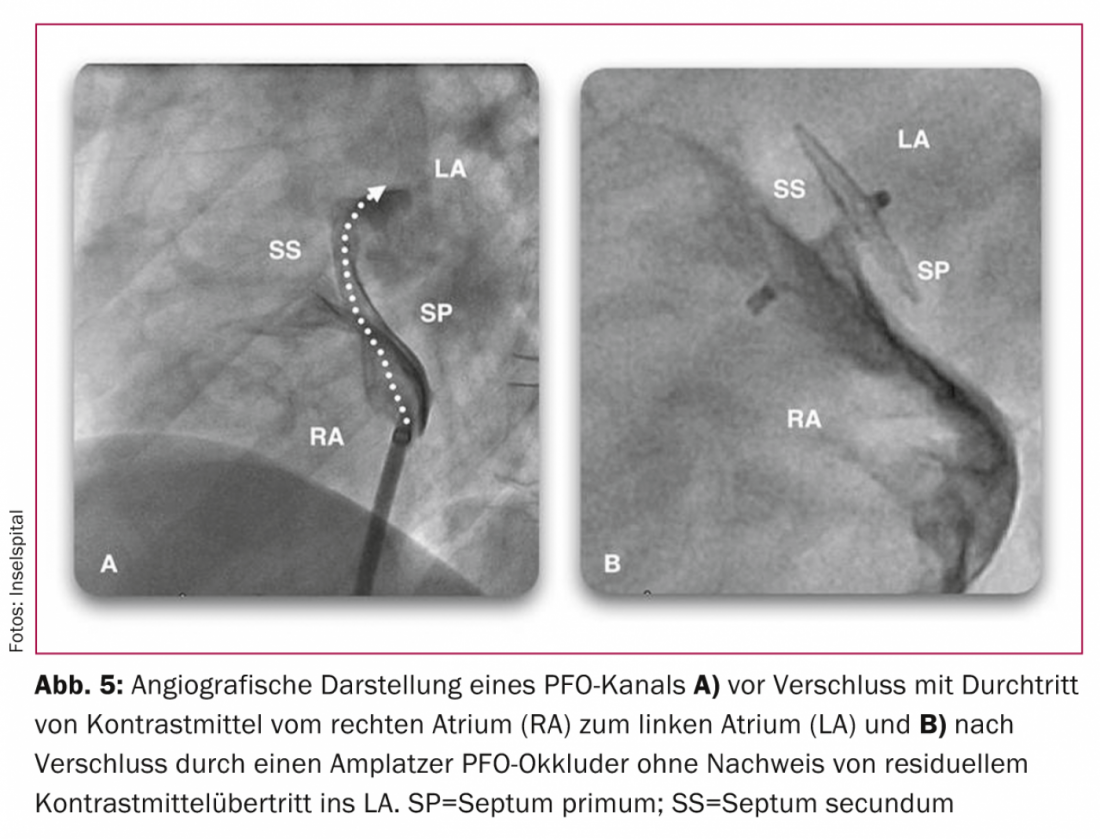
Coerentemente con i risultati attesi dalla prossima raccolta di dati degli studi PC e RESPECT, in uno studio osservazionale a lungo termine che ha confrontato i due gruppi utilizzando la corrispondenza di propensione con un periodo di osservazione medio di nove anni, la chiusura del PFO si è dimostrata superiore alla terapia farmacologica in 308 pazienti per quanto riguarda il raggiungimento dell’endpoint combinato (11 contro 21%, p=0,033). Anche un significativo beneficio di sopravvivenza della chiusura del PFO è stato dimostrato quando si sono confrontati gli anni di osservazione con o senza chiusura del PFO [40]. Una meta-analisi ha mostrato una riduzione del rischio di eventi neurologici ricorrenti dell’84% (un evento contro cinque per 100 anni-paziente) e una differenza significativa a favore della chiusura del PFO nei pazienti anziani e in quelli con aneurismi del setto atriale o trombofilia [41].
A causa del numero relativamente piccolo di casi con una durata di follow-up ancora insufficiente, del basso numero di eventi neurologici e della qualità variabile dei sistemi di chiusura, i tre grandi studi sopra citati non mostrano ancora singolarmente una chiara superiorità significativa della chiusura del PFO rispetto alla terapia puramente farmacologica, ma mostrano una solida tendenza in questa direzione. Si può quindi ipotizzare che a medio termine, le prove derivanti da un tempo di osservazione prolungato degli studi precedenti, le meta-analisi o nuovi studi più conclusivi dimostreranno la superiorità della chiusura del PFO nella profilassi secondaria degli eventi cerebrovascolari ischemici. La chiusura del PFO, tecnicamente facile da eseguire, con un’eccellente percentuale di successo di quasi il 100% e praticamente senza complicazioni, dovrebbe, in considerazione degli effetti potenzialmente catastrofici di qualsiasi evento cerebrovascolare, in base alla visione complessiva dei dati attuali, essere disponibile per ogni paziente per la profilassi secondaria nel senso di una vaccinazione meccanica, soprattutto per quelli di età più giovane con aneurismi settali o shunt più grandi. Oltre ad alcuni utili effetti collaterali, come la riduzione dell’emicrania, dell’apnea del sonno o persino degli infarti miocardici dovuti a occlusioni coronariche paradosso-emboliche, è possibile evitare un’anticoagulazione associata per tutta la vita e ad alto rischio cumulativo. Per prevenire un ictus nell’arco di 20 anni, è necessario eseguire solo nove chiusure del PFO.
Altre fonti di embolia cardiogena
Oltre alla fibrillazione atriale e al PFO, i trombi cardiaci negli infarti miocardici acuti o come conseguenza tardiva di infarti miocardici transmurali, le embolie nella stenosi della valvola mitrale, la sindrome del seno malato, i mixomi atriali, nonché i depositi trombotici sulle protesi valvolari meccaniche o biologiche o le embolie settiche nell’endocardite sono cause rare di apoplessia (Fig. 1).
A seconda della gravità dei risultati, la prima fase del trattamento è l’inizio dell’anticoagulazione orale, seguita da controlli di imaging. In secondo luogo, la rimozione chirurgica deve essere presa in considerazione in assenza di risoluzione di trombi, coaguli fluttuanti, tumori o endocardite florida.
L’intero letto venoso della vena polmonare è una fonte potenziale non visibile di insulti embolici cerebrali. Dovrebbe diventare sempre più il fulcro degli studi clinici a questo proposito.
PD Dr. med. Steffen Gloekler
Potenziali conflitti d’interesse: Bernhard Meier ha ricevuto un sostegno istituzionale alla ricerca e compensi per parlare da parte di St.
Letteratura:
- Go AS, et al. (Comitato Statistiche dell’American Heart Association e Sottocomitato Statistiche Ictus): Statistiche sulle malattie cardiache e l’ictus – aggiornamento 2014: un rapporto dell’American Heart Association. Circolazione 2014; 129: e28-e292.
- Lozano R, et al: Mortalità globale e regionale da 235 cause di morte per 20 gruppi di età nel 1990 e nel 2010: un’analisi sistematica per il Global Burden of Disease Study 2010. Lancet 2012; 380: 2095-2128.
- Feigin VL, et al. (Global Burden of Diseases, Injuries, and Risk Factors Study 2010 [GBD 2010] e il GBD Stroke Experts Group): Onere globale e regionale dell’ictus nel periodo 1990-2010: risultati del Global Burden of Disease Study 2010. Lancet 2014; 383: 245-254.
- Gowers W: Su un caso di embolia simultanea delle arterie retiniche centrali e cerebrali medie. Lancet 1875; 2: 794.
- Miyasaka Y, et al: Tendenze della mortalità nei pazienti con diagnosi di prima fibrillazione atriale: uno studio di 21 anni basato sulla comunità. J Am Coll Cardiol 2007; 49: 986-992.
- Go S: Prevalenza della fibrillazione atriale diagnosticata negli adulti: implicazioni nazionali per la gestione del ritmo e la prevenzione dell’ictus: lo studio AnTicoagulation and Risk Factors In Atrial Fibrillation (ATRIA). J Am Med Assoc 2001; 285: 2370-2375.
- Gladstone DJ, et al. (Investigatori e coordinatori di EMBRACE): Fibrillazione atriale nei pazienti con ictus criptogenetico. N Engl J Med 2014; 370: 2467-2477.
- Sanna T, et al. (Investigatori di CRYSTAL AF): Ictus criptogenetico e fibrillazione atriale sottostante. N Engl J Med 2014; 370: 2478-2486.
- Hart RG, Pearce LA, Aguilar MI: Meta-analisi: terapia antitrombotica per prevenire l’ictus nei pazienti con fibrillazione atriale non valvolare. Ann Intern Med 2007; 146: 857-867.
- Connolly SJ, et al. (Comitato direttivo e sperimentatori di RE-LY): Dabigatran rispetto a warfarin nei pazienti con fibrillazione atriale. N Engl J Med 2009; 361: 1139-1151.
- Patel MR, et al. (Investigatori ROCKET AF): Rivaroxaban rispetto a warfarin nella fibrillazione atriale non valvolare. N Engl J Med 2011; 365: 883-891.
- Granger CB, et al. (Comitati e sperimentatori ARISTOTLE): Apixaban rispetto a warfarin nei pazienti con fibrillazione atriale. N Engl J Med 2011; 365: 981-992.
- Giugliano RP, et al. (Investigatori ENGAGE AF-TIMI 48): Edoxaban rispetto a warfarin nei pazienti con fibrillazione atriale. N Engl J Med 2013; 369: 2093-2104.
- Casciano JP, et al: I costi del sottoutilizzo di warfarin e della non aderenza nei pazienti con fibrillazione atriale: una prospettiva degli assicuratori commerciali. J Manag Care Pharm 2013; 19: 302-316.
- Gladstone DJ, et al: Ictus potenzialmente prevenibili nei pazienti ad alto rischio con fibrillazione atriale che non sono adeguatamente anticoagulati. Stroke 2009; 40: 235-240.
- Wrigley BJ, Lip GY: Il dispositivo WATCHMAN può davvero PROTEGGERE dall’ictus nella fibrillazione atriale? Lancet Neurol 2009; 8: 877-878.
- Waldo AL, et al. (Comitato direttivo NABOR): I pazienti ospedalizzati con fibrillazione atriale e un alto rischio di ictus non ricevono un’adeguata anticoagulazione. J Am Coll Cardiol 2005; 46: 1729-1736.
- Glader EL, et al: L’uso persistente di farmaci di prevenzione secondaria diminuisce rapidamente nei primi 2 anni dopo l’ictus. Stroke 2010; 41: 397-401.
- Onalan O, et al: Prevenzione non farmacologica dell’ictus nella fibrillazione atriale. Expert Rev Cardiovasc Ther 2005; 3: 619-633.
- Steffel J: Nuovi anticoagulanti orali – 10 domande dall’uso quotidiano. Cardiovasc 2014; 13: 12-16.
- Blackshear JL, Odell JA: Obliterazione dell’appendice per ridurre l’ictus nei pazienti cardiochirurgici con fibrillazione atriale. Ann Thorac Surg 1996; 61: 755-759.
- Di Biase L, et al: La morfologia dell’appendice atriale sinistra è correlata al rischio di ictus nei pazienti con fibrillazione atriale? Risultati di uno studio multicentrico. J Am Coll Cardiol 2012; 60: 531-538.
- Madden JL: Resezione dell’appendice auricolare sinistra; una profilassi per le embolie arteriose ricorrenti. J Am Med Assoc 1949; 140: 769-772.
- Holmes DR, et al. (Investigatori PROTECT AF): Chiusura percutanea dell’appendice atriale sinistra rispetto alla terapia con warfarin per la prevenzione dell’ictus nei pazienti con fibrillazione atriale: uno studio randomizzato di non inferiorità. Lancet 2009; 374: 534-542.
- Holmes DR, et al: Valutazione prospettica randomizzata del dispositivo di chiusura dell’appendice atriale sinistra Watchman nei pazienti con fibrillazione atriale rispetto alla terapia a lungo termine con Warfarin. J Am Coll Cardiol 2014; 64: 1-12.
- Gangireddy SR, et al: Chiusura percutanea dell’appendice atriale sinistra per la prevenzione dell’ictus nei pazienti con fibrillazione atriale: una valutazione del beneficio clinico netto. Eur Heart J 2012; 33: 2700-2708.
- Park JW, et al: Chiusura dell’appendice atriale sinistra con Amplatzer Cardiac Plug nella fibrillazione atriale: prima esperienza europea. Catheter Cardiovasc Interv 2011; 77: 700-706.
- Nietlispach F, et al: Occlusione dell’appendice atriale sinistra con Amplatzer: esperienza decennale di un singolo centro. Catheter Cardiovasc Interv 2013; 82: 283-289.
- Nietlispach F, et al: Chiusura percutanea dell’appendice atriale sinistra. Europ Geriat Med 2012; 3: 308-311.
- Nietlispach F, et al: Chiusura percutanea ad hoc dell’appendice atriale sinistra. J Invasive Cardiol 2013; 25: 683-686.
- Calkins H, et al: Dichiarazione di consenso degli esperti HRS/EHRA/ECAS del 2012 sull’ablazione catetere e chirurgica della fibrillazione atriale: raccomandazioni per la selezione dei pazienti, le tecniche procedurali, la gestione dei pazienti e il follow-up, le definizioni, gli endpoint e il disegno degli studi di ricerca. Europace 2012; 14: 528-606.
- Lechat P, et al: Prevalenza del forame ovale pervio nei pazienti con ictus. N Engl J Med 1988; 318: 1148-1152.
- Meier B, et al: Prevenzione secondaria dell’ictus: forame ovale pervio, placca aortica e stenosi carotidea. Eur Heart J 2012; 33: 705-713, 713a, 713b.
- Furlan AJ, et al. (Investigatori di CLOSURE I): Chiusura o terapia medica per l’ictus criptogenetico con forame ovale pervio. N Engl J Med 2012; 366: 991-999.
- Meier B, et al. (Investigatori della sperimentazione PC): Chiusura percutanea del forame ovale pervio nell’embolia criptogenetica. N Engl J Med 2013; 368: 1083-1091.
- Carroll JD, et al. (Investigatori RESPECT): Chiusura del forame ovale pervio rispetto alla terapia medica dopo un ictus criptogenetico. N Engl J Med 2013; 368: 1092-1100.
- Spencer FA, et al: Revisione sistematica della chiusura percutanea rispetto alla terapia medica nei pazienti con ictus criptogenetico e forame ovale pervio. BMJ Open 2014; 4: e004282.
- Meier B: Il forame ovale pervio, è più pericoloso chiuderlo che lasciarlo aperto? Cardiovasc Med 2012; 15: 183-185.
- Messé SR, Kent DM: Ancora nessuna chiusura sulla questione della chiusura del PFO. N Engl J Med 2013; 368: 1152-1153.
- Wahl A, et al: Confronto a lungo termine propensity score-matched tra chiusura percutanea del forame ovale pervio e trattamento medico dopo embolia paradossa. Circolazione 2012; 125: 803-812.
- Agarwal S, et al: Meta-analisi della chiusura transcatetere rispetto alla terapia medica per il forame ovale pervio nella prevenzione di eventi neurologici ricorrenti dopo una presunta embolia paradossa. JACC Cardiovasc Interv 2012; 5: 777-789.
CARDIOVASC 2014; 13(4): 3-8