Per rallentare la progressione della malattia renale cronica, esistono misure specifiche e non specifiche per la malattia. La diagnostica di base per l’insufficienza renale cronica comprende lo stato delle urine e l’ecografia dei reni. Se la malattia renale non corrisponde chiaramente a una nefropatia ipertensiva o diabetica, di solito è utile un chiarimento specialistico per cercare una diagnosi esatta e, se necessario, per consentire una terapia specifica. La misura non specifica di inibizione della progressione meglio dimostrata è il trattamento dei pazienti proteinurici con ACE-inibitori o ARB. Ulteriori misure includono un adeguato controllo della pressione sanguigna, il trattamento dell’acidosi, se necessario, e la limitazione dell’assunzione di sale. I pazienti con malattia renale cronica sono sensibili ai “secondi colpi”. Occorre quindi evitare i FANS, i lassativi contenenti fosfati e i mezzi di contrasto a raggi X contenenti iodio.
L’incidenza e la prevalenza della malattia renale cronica (CKD) sono aumentate costantemente negli ultimi decenni. Dal punto di vista eziologico, la CKD può essere causata da un’ampia varietà di malattie renali. Le più comuni – e anche largamente responsabili dell’aumento della prevalenza della CKD – sono la nefropatia diabetica e ipertensiva. Oltre al rischio di sviluppare una malattia renale in fase terminale, la CKD comporta un aumento significativo della morbilità e della mortalità cardiovascolare [1]. La malattia renale cronica rappresenta quindi un onere rilevante per il sistema sanitario. La maggior parte dei pazienti con CKD è assistita principalmente dai medici di base. Pertanto, è importante che i pazienti che necessitano di una terapia specifica siano identificati in tempo e che le misure non specifiche di riduzione della progressione siano conosciute e implementate.
Trattamento specifico per la malattia
Come già detto, una serie di malattie renali eziologicamente diverse possono portare alla CKD. Per alcuni di essi esistono terapie specifiche (ad esempio, immunosoppressive). Per consentire una terapia causale, si deve quindi puntare alla diagnosi della malattia di base. Un buon triage nello studio medico di base è fondamentale per garantire che i pazienti con una specifica malattia renale curabile vengano visitati dal punto di vista nefrologico. Valgono le seguenti regole empiriche:
- La diagnostica di base di ogni paziente con un’alterazione rilevante della funzione renale, che non può essere spiegata a livello pre-renale e che è rapidamente reversibile, comprende un esame delle urine e un’ecografia dei reni. La sonografia aiuta ad escludere una causa postrenale, può essere diagnostica nelle nefropatie cistiche e talvolta permette di trarre conclusioni sulla cronicità o sulla potenziale reversibilità della nefropatia in base alle dimensioni del rene.
- I pazienti con nefropatia ipertensiva sono di solito più anziani, mostrano un deterioramento progressivo piuttosto lento della funzione renale, di solito non hanno una proteinuria rilevante (al massimo una “microalbuminuria”), un sedimento urinario poco evidente e di solito una storia di ipertensione di lunga data con altri danni agli organi terminali ipertesi. Tipica di questi pazienti è anche un’alterata capacità autoregolatoria dei reni, con fluttuazioni pronunciate della creatinina sierica a seconda dell’idratazione e della pressione sanguigna. Nei pazienti anziani, spesso non è necessaria una visita specialistica.
- La nefropatia diabetica è tipicamente caratterizzata da albuminuria lentamente progressiva seguita da un declino più rapido della velocità di filtrazione glomerulare (GFR) rispetto alla nefropatia ipertensiva. A quel punto, di solito si riscontrano altre complicazioni microvascolari (retinopatia). Se il decorso è atipico, vale la pena cercare cause alternative.
- Nei pazienti che non rientrano in una delle categorie precedenti, in particolare quelli con proteinuria rilevante, sedimenti urinari anormali o rapida diminuzione del GFR, si deve prendere in considerazione un work-up mediante biopsia renale e di solito è indicato il ricovero in nefrologia. Questo potrebbe essere dovuto a una causa specifica trattabile (ad esempio, vasculite ANCA, nefropatia membranosa, nefropatia IgA, ecc.)
Fattori di progressione non specifici e loro trattamento
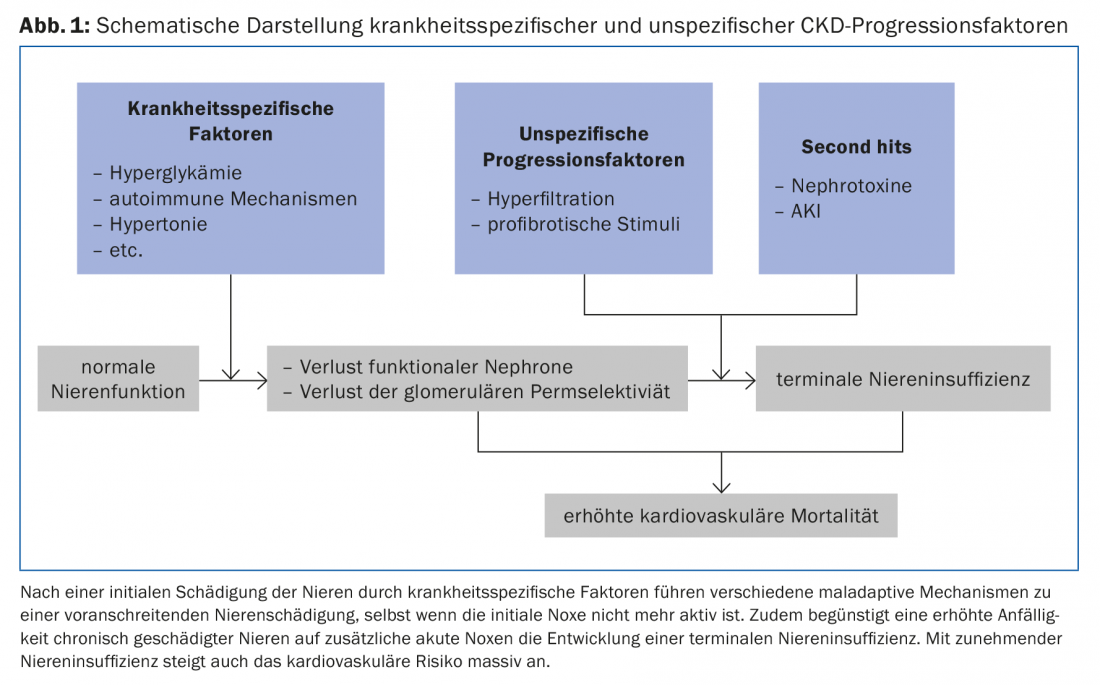
Una volta che si è verificato un danno renale rilevante, una serie di meccanismi di disadattamento contribuiscono all’ulteriore deterioramento della funzione renale, indipendentemente dalla malattia di base (Fig. 1).
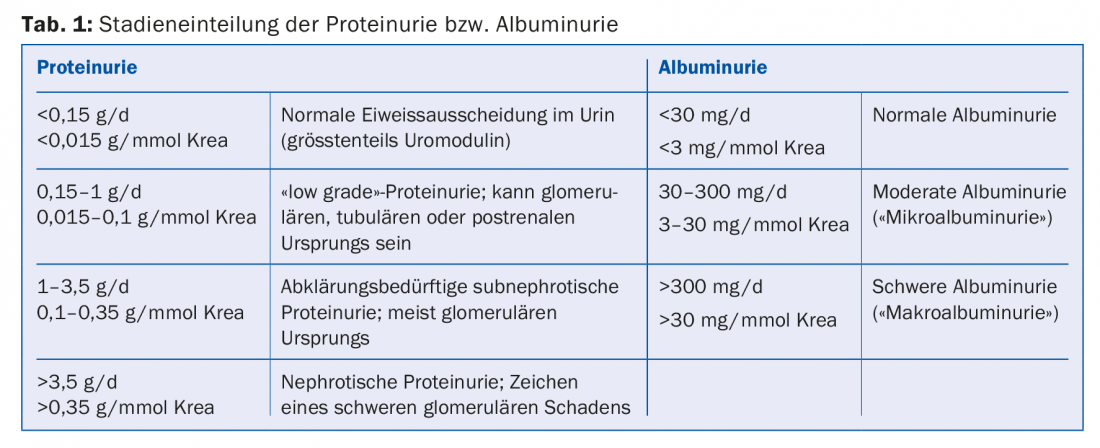
Proteinuria/albuminuria: la proteinuria o l’albuminuria sono solitamente il risultato di un’alterata permeabilità glomerulare (riquadro, scheda 1). La sua estensione è correlata alla progressione dell’insufficienza renale [2]. Gli interventi che riducono la proteinuria o l’albuminuria portano anche a un rallentamento della progressione della CKD. Gli ACE-inibitori e i bloccanti del recettore dell’angiotensina (ARB) riducono la pressione intraglomerulare, l’iperfiltrazione glomerulare e l’albuminuria. La loro efficacia nel ridurre la progressione nei pazienti con CKD con proteinuria è ben consolidata sia per i diabetici [3] che per i non diabetici [4]. Il dosaggio deve essere aumentato fino a quando la proteinuria non è stata ridotta al range target (che varia a seconda della malattia renale di base) o la dose è limitata da effetti collaterali inaccettabili (ad esempio ipotensione/vertigini ortostatiche) o è stato raggiunto il dosaggio massimo consentito del farmaco. La terapia combinata di ACE-inibitori e ARB, precedentemente consigliata, è stata ampiamente abbandonata.

Ipertensione: l’ipertensione arteriosa può portare alla nefropatia ipertensiva, ma può anche promuovere la progressione di altre malattie renali, e quindi deve essere trattata adeguatamente. Per la nefroprotezione, i valori target abituali di <140/90 mmHg sembrano essere sufficienti nei pazienti senza albuminuria patologicamente aumentata, e gli ACE-inibitori o gli ARB non sono chiaramente superiori ad altri farmaci. Nei pazienti con albuminuria grave e probabilmente anche in quelli con albuminuria moderata, è ragionevole mirare a valori di <130/80 mmHg. In questo caso, è necessario dosare prima un ACE-inibitore o un ARB e solo successivamente aggiungere altri antipertensivi, se necessario [5]. Nella maggior parte dei pazienti con funzione renale significativamente compromessa, un controllo adeguato della pressione sanguigna può essere ottenuto solo con l’aggiunta di un diuretico dell’ansa. Va ricordato che i valori target menzionati si applicano per quanto riguarda la nefroprotezione e il recente studio SPRINT ha dimostrato un possibile beneficio di valori target più bassi sulla mortalità per tutte le cause [6].
Acidosi metabolica e sua correzione: con l’aumento dell’insufficienza renale, la capacità di escrezione acida dei reni diminuisce e nel corso del tempo si sviluppa un’acidosi metabolica, che ha effetti negativi sul metabolismo osseo e sulla muscolatura, tra le altre cose. Oltre a questi effetti extrarenali, tuttavia, l’esposizione agli acidi sembra danneggiare anche i reni stessi [7]. Dagli studi osservazionali si sa che il bicarbonato sierico è inversamente correlato alla progressione nei pazienti con CKD. In caso di acidosi renale, la terapia può essere mirata a ridurre l’apporto di acido attraverso l’alimentazione (soprattutto le proteine animali) o a neutralizzare l’apporto di acido attraverso una terapia orale con bicarbonato di sodio. Alcuni piccoli studi randomizzati hanno dimostrato un impressionante effetto di riduzione della progressione per questo intervento semplice ed economico [6], ma i risultati di studi più ampi sono ancora in attesa. Gli svantaggi della terapia con bicarbonato sono l’elevato “carico di pillole” (di solito sono necessarie 3-6 capsule da 500 mg di NaBic per un effetto sufficiente) e l’assunzione di sodio associata.
Interventi sulla nutrizione e sullo stile di vita: Sebbene l’influenza positiva dell’attività fisica e dell’obiettivo di un peso corporeo “sano” (BMI 20-25) sulla progressione dell’insufficienza renale non sia stata formalmente dimostrata in studi controllati, questi interventi sono in grado di influenzare favorevolmente vari fattori di rischio cardiovascolare e la proteinuria.
Una dieta a basso contenuto di proteine è stata promossa da tempo come misura per ridurre l’iperfiltrazione glomerulare. Tuttavia, i dati sull’efficacia della restrizione proteica nella CKD non sono del tutto chiari e gli studi esistenti sono precedenti all’uso diffuso degli ACE-inibitori e degli ARB. Inoltre, una grave restrizione proteica può portare alla malnutrizione, che è molto sfavorevole in termini di prognosi se è necessaria la dialisi in una fase successiva. Pertanto, una severa restrizione proteica non è più raccomandata oggi, ma l’assunzione eccessiva di proteine (ad esempio sotto forma di integratori proteici per l’allenamento con i pesi) deve essere evitata nei pazienti con CKD.
Il consumo elevato di sale è stato associato negli studi epidemiologici a un aumento della pressione sanguigna, a un aumento della proteinuria e a una diminuzione più rapida del GFR nei pazienti renali [8]. Inoltre, un’elevata assunzione di sale riduce notevolmente gli effetti antiproteinurici e prognostici positivi degli ACE-inibitori e degli ARB [9]. Limitare l’assunzione di sale a 5-6 g NaCl/giorno è raccomandato per la maggior parte dei pazienti con insufficienza renale cronica. Al momento non è chiaro se un’ulteriore restrizione sia utile o addirittura sfavorevole in alcuni pazienti.
Il fumo è stato associato in diversi studi di popolazione non solo agli eventi cardiovascolari, ma anche all’albuminuria e all’insufficienza renale [10]. Sono stati condotti solo pochi studi di intervento sull’influenza della cessazione della nicotina sul decorso della CKD, ma tutti positivi.
Approcci terapeutici dall’effetto incerto o non dimostrato: numerosi studi epidemiologici mostrano un legame tra iperuricemia e insufficienza renale, nonché rischio cardiovascolare, anche se la causalità non è ancora stata completamente chiarita [11]. Singoli piccoli studi hanno dimostrato un effetto favorevole della terapia uricostatica con allopurinolo sul decorso dell’insufficienza renale cronica. Tuttavia, poiché l’allopurinolo non è privo di rischi per quanto riguarda gli effetti collaterali, soprattutto in caso di funzionalità renale compromessa, sono necessari studi più ampi per raccomandare l’uso dell’allopurinolo nei pazienti con CKD senza gotta in linea di principio e, se necessario, per definire livelli target di acido urico ragionevoli. Febuxostat, che non viene eliminato per via renale e ha meno effetti collaterali, potrebbe svolgere un ruolo in futuro. L’iperlipidemia è stata considerata un possibile fattore di progressione della CKD sulla base di considerazioni fisiopatologiche e di dati epidemiologici. Tuttavia, una valutazione dello studio SHARP (il più grande studio sulla riduzione dei lipidi nei pazienti con CKD) non ha dimostrato un effetto positivo della simvastatina e dell’ezetimibe sulla progressione della CKD [12]. Le statine non sembrano quindi avere un effetto rilevante sulla progressione della CKD, ma sono utili per ridurre il rischio cardiovascolare in molti pazienti con CKD. Gli analoghi attivi della vitamina D sembrano avere un effetto positivo sulla proteinuria, ma un effetto sulla progressione dell’insufficienza renale deve essere ancora dimostrato [13].
“I secondi colpi e la loro prevenzione: i reni pre-danneggiati sono molto più sensibili alle noxae acute rispetto a quelli sani. Ciò significa che i pazienti con insufficienza renale cronica hanno un rischio massicciamente aumentato di subire un danno renale acuto (AKI) [5], che spesso viene recuperato in modo incompleto [14].
I farmaci antinfiammatori non steroidei (FANS) sono tra i medicinali più prescritti in tutto il mondo. Nei pazienti con insufficienza cardiaca grave o funzione renale compromessa, l’inibizione della sintesi intrarenale di prostaglandine può portare a una riduzione critica della perfusione glomerulare e scatenare l’AKI [15]. I FANS sono quindi controindicati nei pazienti con una funzione renale gravemente compromessa e devono essere utilizzati solo con moderazione e a breve termine nei pazienti con una funzione renale leggermente ridotta [5].
I mezzi di contrasto a raggi X contenenti iodio possono provocare un danno renale acuto in caso di funzione renale compromessa preesistente, disidratazione e insufficienza cardiaca scompensata. Le misure più importanti per la profilassi della nefropatia da contrasto nei pazienti con CKD sono: (a) mettere in discussione in modo critico l’indicazione e la conseguenza terapeutica di un esame, (b) Considerare metodi di esame alternativi a seconda del problema (ad esempio, ecografia, scintigrafia), (c) se un esame con mezzo di contrasto a raggi X è inevitabile: preidratarsi, ridurre al minimo la quantità di mezzo di contrasto applicato e scegliere un mezzo di contrasto a raggi X isoosmolare [5,16].
I lassativi contenenti fosfato sono occasionalmente utilizzati nella preparazione alla colonscopia come alternativa ai lassativi contenenti polietilenglicole. Nel processo, una quantità considerevole di fosfato viene assorbita attraverso l’intestino. Con una funzione renale normale, questo carico di fosfato può essere espulso in modo relativamente rapido attraverso i reni. Tuttavia, in caso di compromissione della funzione renale, si raggiungono livelli di fosfato estremamente elevati nel sangue e la conseguente concentrazione di fosfato molto elevata nelle urine primarie può portare a una nefropatia acuta da cristalli di fosfato di calcio [17]. I lassativi contenenti fosfato sono quindi controindicati con un GFR <60 ml/min/1.73m2 ; altri fattori di rischio per la nefropatia acuta da cristalli di fosfato sono la deplezione di volume, i diuretici, gli ACE-inibitori e l’età [17].
Letteratura:
- Matsushita K, et al: Associazione della velocità di filtrazione glomerulare stimata e dell’albuminuria con la mortalità per tutte le cause e la mortalità cardiovascolare in coorti di popolazione generale: una metaanalisi collaborativa. Lancet 2010; 375: 2073-2081.
- Gansevoort RT, et al.: Consorzio per la prognosi della malattia renale cronica. Una GFR stimata più bassa e un’albuminuria più elevata sono associate a esiti renali avversi. Una meta-analisi collaborativa di coorti di popolazione generale e ad alto rischio. Kidney Int. 2011; 80(1): 93-104.
- Kistler AD: Albuminuria nei diabetici: gestione pratica. Pratica (Berna 1994). 2013;102(20): 1229-35.
- Jafar TH, et al.: Inibitori dell’enzima di conversione dell’angiotensina e progressione della malattia renale non diabetica. Una meta-analisi dei dati a livello di paziente. Ann Intern Med. 2001; 135(2): 73-87.
- Linea guida di pratica clinica KDIGO 2012 per la valutazione e la gestione della malattia renale cronica. Kidney Int Suppl 2013;3(1). (www.kdigo.org/home/guidelines)
- Gruppo di ricerca SPRINT, Wright JT Jr, et al: Uno studio randomizzato sul controllo intensivo della pressione sanguigna rispetto a quello standard. N Engl J Med. 2015 Nov 26;373(22): 2103-16
- Kovesdy CP: Acidosi metabolica e malattia renale: la terapia con bicarbonato rallenta la progressione della CKD? Nephrol Dial Transplant. 2012;27(8): 3056-62.
- Meier P, et al: Sale e insufficienza renale. Switzerland Med Forum 2014;14(04): 50-53
- Lambers Heerspink HJ, et al: La moderazione del sodio nella dieta potenzia gli effetti protettivi renali e cardiovascolari dei bloccanti dei recettori dell’angiotensina. Kidney Int. 2012; 82(3): 330-7.
- Orth SR, et al: Il fumo: un fattore di rischio per la progressione della malattia renale cronica e per la morbilità e la mortalità cardiovascolare nei pazienti renali – assenza di prove o prove di assenza? Clin J Am Soc Nephrol. 2008;3(1): 226-36.
- Jalal DI, et al: L’acido urico come obiettivo della terapia nella CKD. Am J Kidney Dis. 2013;61(1): 134-46.
- Haynes R, et al. per il Gruppo Collaborativo SHARP: Effetti della riduzione del colesterolo LDL sulla progressione della malattia renale. J Am Soc Nephrol. 2014;25(8): 1825-33.
- de Borst MH, et al: Trattamento attivo con vitamina D per la riduzione della proteinuria residua: una revisione sistematica. J Am Soc Nephrol. 2013;24(11): 1863-71.
- Chawla LS, et. al.: Lesione renale acuta e malattia renale cronica come sindromi interconnesse. N Engl J Med. 2014; 371(1): 58-66.
- Harirforoosh S, et al: Effetti avversi renali dei farmaci antinfiammatori non steroidei. Expert Opin Drug Saf. 2009;8(6): 669-81.
- Linea guida di pratica clinica KDIGO 2012 per l’infortunio renale acuto. Kidney Int Suppl 2012;2(1). (www.kdigo.org/home/guidelines)
- Markowitz GS, et. al: Verso l’incidenza della nefropatia acuta da fosfato. J Am Soc Nephrol. 2007;18(12): 3020-2.
PRATICA GP 2016; 11(12): 35-38