La radioterapia è una componente integrante della gestione del NSCLC. I recenti progressi nella radioterapia nel NSCLC si basano sia sui progressi tecnici che sulla migliore comprensione della biologia delle radiazioni delle tolleranze dei tessuti normali e delle massime dosi tumorali tollerabili. La radioterapia stereotassica del corpo è oggi un’opzione di trattamento accettabile per il NSCLC in stadio precoce e situato in posizione periferica, nei pazienti non idonei a sottoporsi a un intervento chirurgico definitivo. Altre strategie recenti riguardano l’escalation della dose di radiazioni, l’uso della pianificazione del trattamento basata sulla PET-CT, la radioterapia isotossica e l’uso della radioterapia a fascio di particelle.
Il cancro al polmone è uno dei tumori più comuni registrati a livello globale. Secondo il GLOBOCAN 2012 [1], si stima che in tutto il mondo, con un’incidenza del 16,7%, il cancro al polmone sia il tumore più comune negli uomini e contribuisca anche alla più alta mortalità annuale legata al cancro, pari al 34,2%. Nelle donne, l’incidenza è dell’8,8% con una mortalità del 13,8%. Le incidenze del tasso standardizzato per età (ASR) per i maschi e le femmine sono state riportate rispettivamente come 34,2 per 100.000 e 8,8 per 100.000. Per entrambi i sessi combinati, il cancro ai polmoni è stato segnalato come la malattia più mortale, con la mortalità più alta del 19,4% di tutti i tumori maligni.
Nel 2012, l’Istituto Nazionale di Epidemiologia e Registrazione del Cancro (NICER) ha riferito che in Svizzera vengono rilevati circa 2500 e 1200 nuovi casi all’anno, rispettivamente nei maschi e nelle femmine [2]. Di conseguenza, il cancro ai polmoni rappresenta il secondo e il terzo tumore più comune nei maschi e nelle femmine, rispettivamente, nel Paese. Nel periodo compreso tra il 1995-1999 e il 2005-2009, la percentuale di sopravvivenza relativa standardizzata per età per uomini e donne combinati ha mostrato un miglioramento per il 1° anno successivo alla diagnosi, dal 37,8 al 44,5% e per il 5° anno dal 12,4 al 15,9%. La sopravvivenza relativa è risultata essere costantemente migliore nelle donne rispetto agli uomini durante entrambi i periodi di calendario.
Circa l’85-90% di tutti i tumori al polmone sono tumori al polmone non a piccole cellule (NSCLC). La diagnosi precoce e il miglioramento degli interventi terapeutici attraverso la chirurgia, la radioterapia e la chemioterapia, potrebbero certamente aver contribuito al miglioramento degli esiti evidenziato in questo periodo. La chirurgia è ancora considerata la modalità primaria per il trattamento dei pazienti clinicamente idonei con NSCLC in stadio precoce operabile. La chemioterapia dispone oggi di una serie di nuovi agenti chemioterapici e di diversi composti mirati promettenti. Anche la radioterapia, una componente chiave nella gestione di questi tumori, ha subito notevoli miglioramenti tecnici negli ultimi anni. Questo articolo intende presentare una panoramica delle varie indicazioni della radioterapia nei vari stadi del NSCLC e discutere i recenti sviluppi dello stato dell’arte della radioterapia per il NSCLC.
Opzioni di radioterapia nel NSCLC
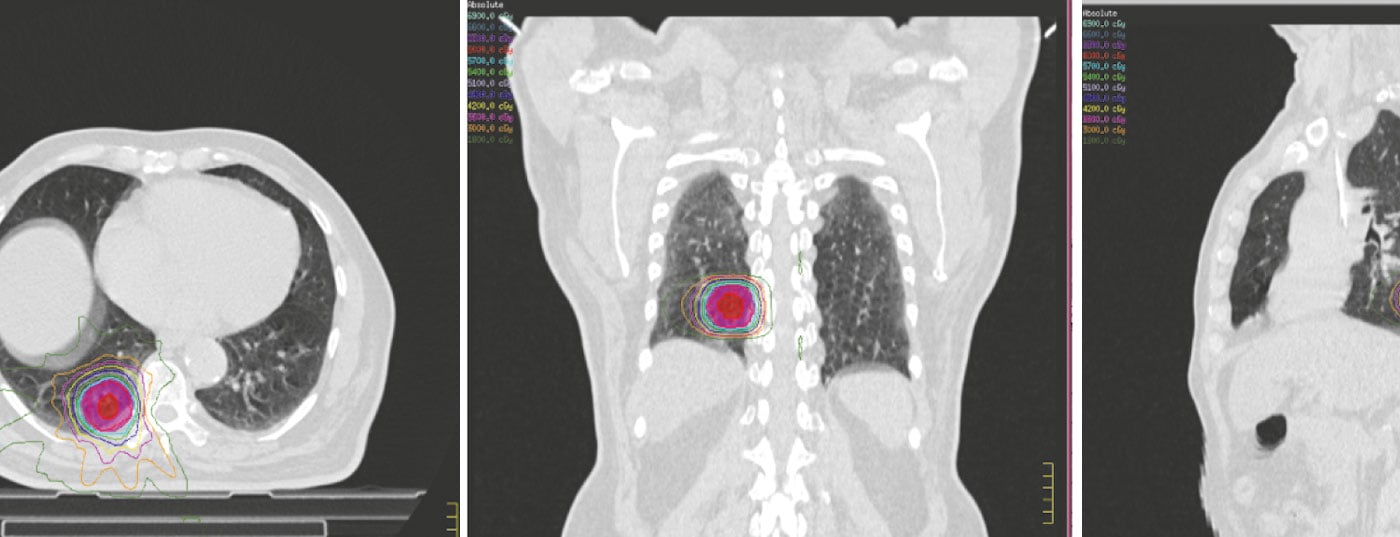
Le varie opzioni di radioterapia utilizzate nel NSCLC dipendono dallo stadio della malattia, dalle condizioni generali del paziente e dalla disponibilità di strutture di radioterapia specifiche in un determinato istituto. Quindi, in base alle linee guida NCCN, ESMO e DEGRO, la radioterapia nel NSCLC potrebbe essere ampiamente utilizzata come riassunto (Fig. 1) [3–5]:
– Radioterapia definitiva o radicale da sola:
- a) Con i fotoni: radioterapia conformazionale 3D (3D CRT), radioterapia a intensità modulata (IMRT) o terapia ad arco modulata volumetrica (VMAT) supportata da radioterapia a guida d’immagine (IGRT) e radioterapia stereotassica del corpo (SBRT). Tutte queste operazioni possono essere eseguite con varie tecniche di gating respiratorio disponibili in un determinato centro;
- b) Terapia con fascio di protoni
– Radioterapia preoperatoria o postoperatoria: utilizzando la tecnica appropriata come indicato sopra.
– Radioterapia in combinazione con la chemioterapia: Chemioradioterapia concomitante (CTRT) o uso sequenziale delle due modalità
– Radioterapia palliativa con radioterapia a fasci esterni o brachiterapia intraluminale.

I recenti approcci alla radioterapia per il NSCLC, che comprendono la pianificazione del trattamento con gating respiratorio, la pianificazione del trattamento basata sulla PET-CT, l’escalation della dose con strategie di frazionamento modificate, la radioterapia stereotassica del corpo (SBRT), gli approcci di radioterapia isotossica e l’uso di fasci di particelle – protoni e ioni di carbonio, sono riassunti nelle sezioni seguenti.
Pianificazione del trattamento e gating respiratorio
La maggior parte dei pazienti viene sottoposta a una valutazione dettagliata presso le varie commissioni tumorali multidisciplinari, per delineare l’approccio terapeutico ottimale in base alle caratteristiche del tumore e del paziente. Una volta preso in considerazione per la radioterapia, il paziente viene sottoposto a una serie di fasi per la pianificazione della radioterapia, finalizzate principalmente a minimizzare la dose alle strutture critiche, fornendo al contempo dosi adeguate al tumore e alle stazioni nodali adiacenti (Fig. 2).
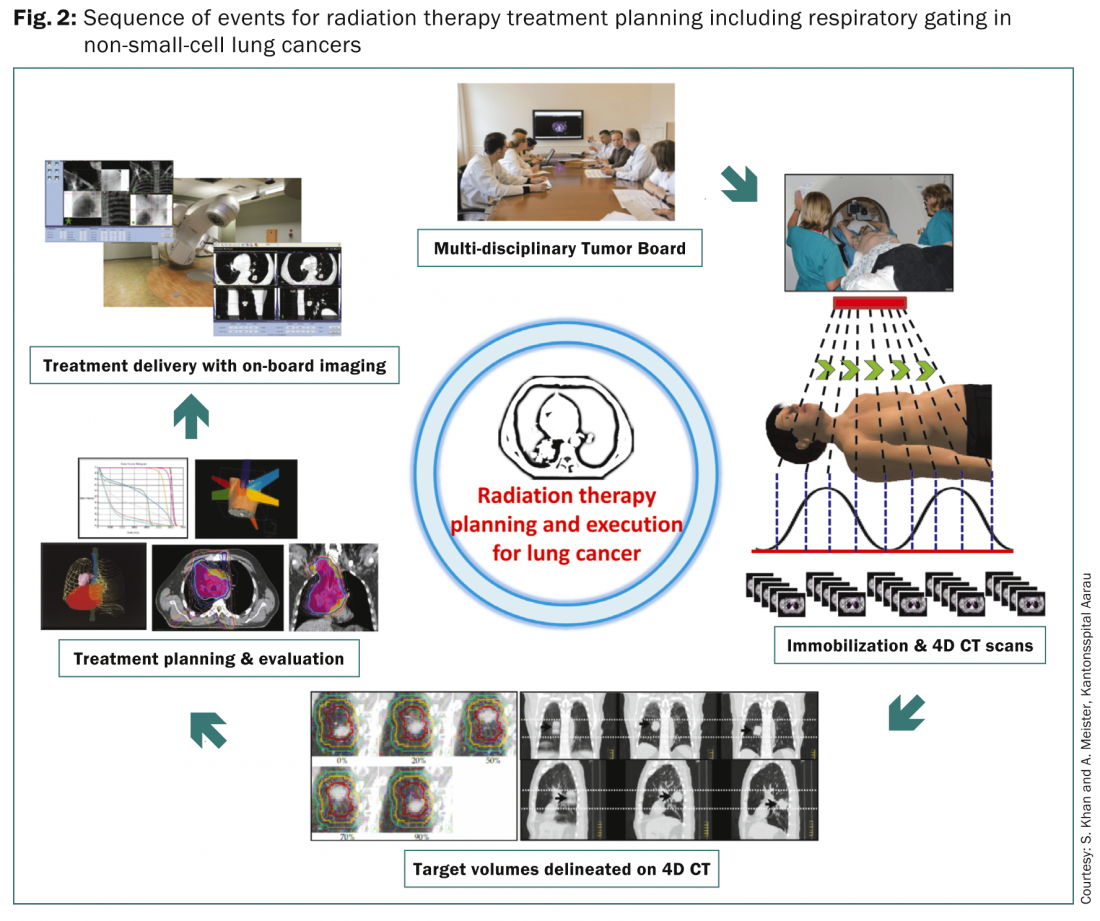
Poiché i tumori polmonari seguono i movimenti respiratori, è obbligatorio prendere in considerazione il movimento respiratorio e i conseguenti spostamenti della lesione primaria nel polmone. Attualmente sono disponibili diversi metodi. Questi includono la respirazione libera o il volume target non interno (non-ITV) utilizzando una simulazione TC standard senza TC 4D o fusione di scansioni di inspirazione o espirazione; l’approccio breath-hold o gating non-ITV in cui viene acquisita una singola immagine TC 3D a un livello di respirazione predeterminato; l’uso di compressioni addominali durante la TC; Approccio TC 4D, che prevede l’acquisizione di almeno due serie di immagini TC 3D a fine inspirazione o fine espirazione e fino a dieci serie di dati TC 3D corrispondenti ai vari livelli del ciclo respiratorio. La TAC 4D verrebbe utilizzata per definire i volumi bersaglio, mentre una TAC separata a respiro libero viene acquisita per la pianificazione del trattamento e il calcolo della dose. I volumi target risultanti sono solitamente definiti secondo i rapporti ICRU 62 e 83 [6,7]. Una discussione dettagliata su questi aspetti esula dallo scopo di questo articolo e i lettori interessati possono fare riferimento ai rapporti 62 e 83 dell’ICRU per una rassegna completa.
Una volta delineati i volumi bersaglio e gli organi a rischio, si procede alla pianificazione del trattamento per ottimizzare la combinazione di fasci co-planari o non-coplanari con pesi, angoli, forme e tempi di accensione dei fasci diversi, a seconda della tecnica di trattamento da utilizzare – CRT 3D, IMRT e VMAT. Vengono delineati una dose di radiazioni definita e il programma di frazionamento, con vincoli di dose specificati per vari organi a rischio, in particolare polmoni, midollo spinale, esofago, plesso brachiale e cuore. I vari piani di trattamento alternativi vengono sottoposti a un’attenta valutazione e il piano finale viene selezionato in base alla valutazione degli istogrammi dose-volume per le dosi ai volumi bersaglio e ai vari organi a rischio. L’erogazione del trattamento avviene di solito sotto un’attenta supervisione e viene eseguita in respiro libero, in apnea o in gating. Tutti questi elementi necessitano di imaging a bordo per ridurre al minimo gli errori tra i piani di trattamento e la loro esecuzione quotidiana.
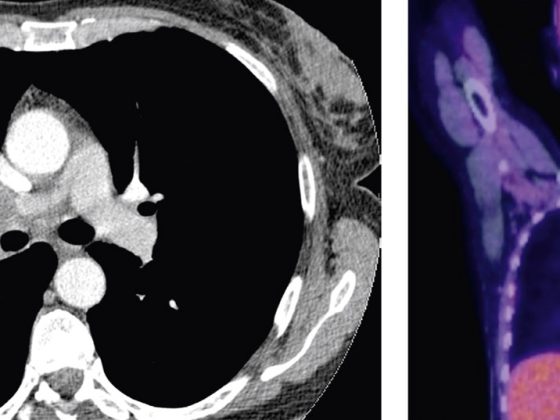
Pianificazione del trattamento radiante basata sulla PET-CT
La FDG PET-CT è oggi una delle modalità diagnostiche utilizzate di routine per la stadiazione nel NSCLC. Viene utilizzato anche per la pianificazione del trattamento radioterapico, grazie a diversi vantaggi [8] (Fig. 3) .
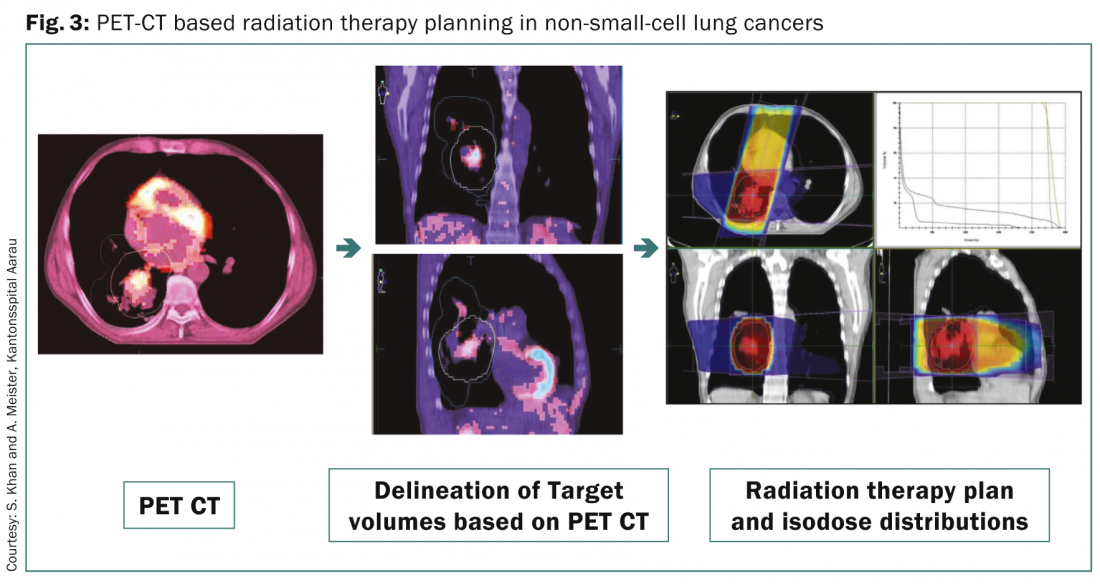
Questi includono la delineazione dei volumi bersaglio lordi in un polmone collassato; l’assistenza nell’identificazione dei linfonodi regionali coinvolti per l’irradiazione e la pianificazione del CTV; l’individuazione di qualsiasi diffusione della malattia extratoracica che potrebbe alterare lo stadio della malattia e il piano di trattamento per l’escalation della dose alla malattia lorda, sulla base delle immagini anatomo-metaboliche ottenute mediante FDG-PET. La PET-CT 4D si è dimostrata utile anche nella localizzazione accurata dei pazienti con piccoli tumori che necessitano di un trattamento e di una pianificazione della radioterapia con gated respiratorio.
I risultati clinici basati sulla pianificazione basata sulla PET-CT sono piuttosto promettenti e sembrano avere una bassa incidenza di recidiva loco-regionale. In uno studio su 137 pazienti, con NSCLC in stadio III, la recidiva loco-regionale era del 14,6% per i pazienti pianificati con la PET-CT [9]. I risultati di uno studio pilota su 32 pazienti, hanno riportato solo un paziente ciascuno con fallimento regionale e progressione locale del tumore dopo la chemioradioterapia concomitante basata sulla PET-CT [10]. Attualmente, diversi gruppi in Europa e negli Stati Uniti stanno esplorando l’uso della FDG-PET per la radioterapia nel NSCLC (Identificatore ClinicalTrials.gov: NCT01024829 e 01507428). L’applicazione della pianificazione basata sulla PET-CT potrebbe essere ulteriormente ampliata in studi futuri che prevedono l’escalation della dose ai tumori primari. Questo potrebbe essere realizzato con la PET utilizzando traccianti ipossici, come F-MISO, 18F-FAZA o 18F-HX4, che possono identificare le aree ipossiche radioresistenti che potrebbero trarre particolare beneficio da un’escalation selettiva della dose [8].
Strategie di escalation della dose e frazionamenti alterati
Studi di escalation della dose sono stati intrapresi nel tentativo di migliorare il controllo locale e hanno dimostrato di migliorare la sopravvivenza mediana da 20 a 26 mesi con dosi escalation fino a 74 Gy in studi multipli di fase I/II di gruppi cooperativi insieme alla chemioradioterapia concomitante [11–13]. Tuttavia, i risultati recentemente riportati dello studio di fase III, RTOG 0617, che ha randomizzato i pazienti a 74 Gy in 37 frazioni rispetto a 60 Gy standard in 30 frazioni con paclitaxel/carboplatino settimanali con o senza cetuximab, non hanno mostrato alcun beneficio con 74 Gy [14]. Sorprendentemente, i fallimenti locali e loco-regionali sono stati peggiori nel braccio con la dose più alta, sebbene le tossicità tra i due gruppi fossero comparabili. Le possibili ragioni di ciò potrebbero essere l’aumento della dose cardiaca e il prolungamento della durata complessiva del trattamento nel braccio ad alto dosaggio. Il rapporto finale e le possibili ragioni dell’assenza di miglioramento con dosi più elevate sono in fase di studio.
Anche gli schemi di frazionamento modificati che utilizzano l’iperfrazionamento (ad esempio, CHART: 54 Gy in tre frazioni giornaliere di 1,5 Gy durante dodici giorni continui) sono stati esplorati nel NSCLC e gli studi randomizzati hanno dimostrato un beneficio nei risultati di sopravvivenza rispetto agli schemi di frazionamento convenzionali [15–17]. Il regime, tuttavia, è logisticamente difficile da realizzare, anche se promette di migliorare i risultati di sopravvivenza.
Con la disponibilità di una pianificazione del trattamento basata sulla PET-CT e di tecniche di trattamento radioterapico all’avanguardia, si stanno attualmente esplorando programmi di radiazioni ipofrazionate con l’erogazione di dosi superiori ai 2 Gy standard per frazione, che si sono dimostrati promettenti per i tumori in stadio precoce, con una sopravvivenza mediana di 38,5 mesi [18]. Ciò ha portato al loro utilizzo nella radioterapia stereotassica del corpo nel NSCLC precoce, soprattutto nei pazienti non idonei dal punto di vista medico alla chirurgia.
Radioterapia stereotassica del corpo (SBRT)
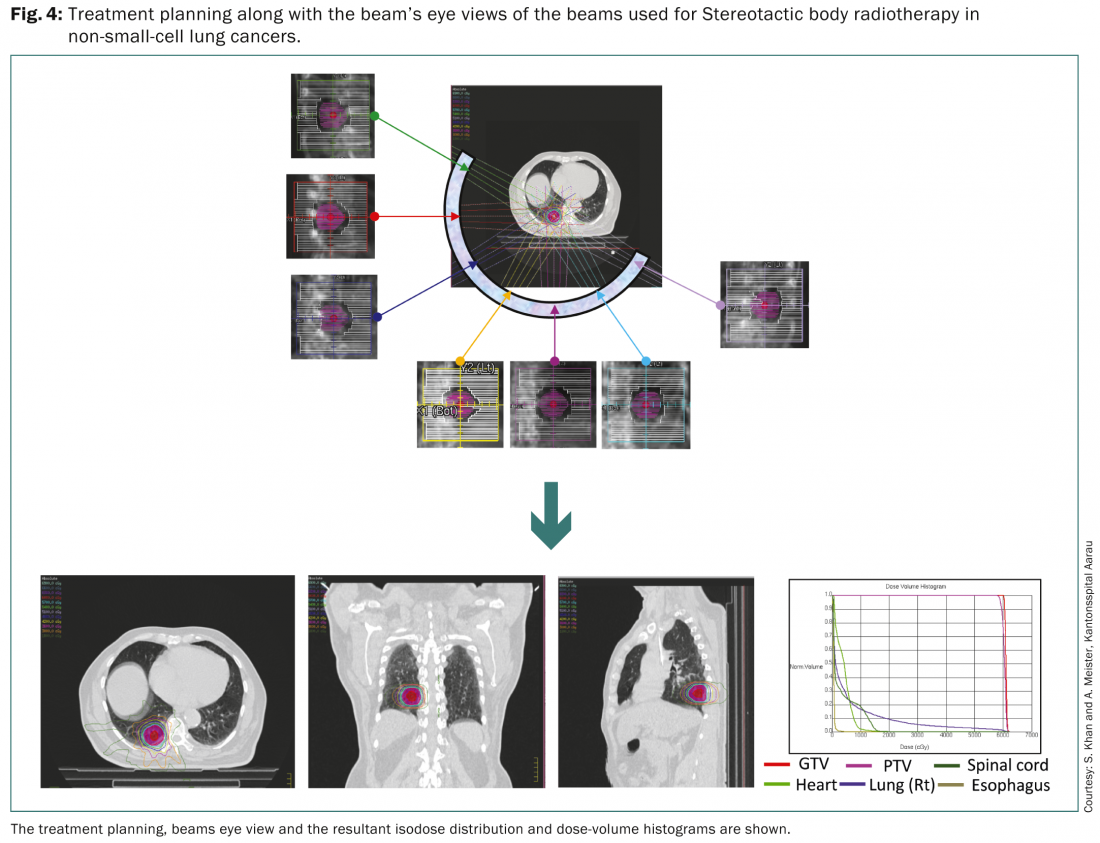
La SBRT consente di erogare un’elevata dose di radiazioni a piccoli volumi tumorali con precisione e permette di praticare una radioterapia iperfrazionata ad alto dosaggio. Secondo l’Organizzazione Europea per la Ricerca e il Trattamento del Cancro (EORTC), la SBRT è un approccio adatto per i pazienti con lesioni periferiche negative ai linfonodi, inferiori a 6 cm e potrebbe essere utilizzata per i pazienti anziani che non sono idonei alla chirurgia [19]. Potrebbe essere applicato anche ai pazienti che hanno subito una precedente pneumonectomia. Il gating respiratorio insieme alla pianificazione del trattamento basata sulla FDG PET-CT è consigliato per delineare i diversi volumi target.
Una revisione sistematica riportata da Soldà et al. ha confrontato gli esiti con una coorte chirurgica proveniente da una serie di 45 relazioni che comprendevano 3771 pazienti [20]. È stata riportata un’ampia gamma di schemi di frazionamento della dose. Queste variavano da 30 Gy in una singola frazione a 45-72,5 Gy in tre-dieci frazioni. La sopravvivenza a 2 anni di 3201 pazienti con NSCLC in stadio I con SBRT è stata del 70%, con un controllo locale a 2 anni del 91%. Questo dato si confronta bene con la sopravvivenza a 2 anni del 68% in 2038 pazienti di stadio I trattati con la chirurgia. Non c’è stata alcuna differenza nella sopravvivenza o nella sopravvivenza libera da progressione locale tra i pazienti trattati con le diverse tecniche di radioterapia utilizzate per la SBRT.
Una recente meta-analisi appena riportata, è stata condotta su 4850 pazienti di 40 studi SBRT e confrontata con gli esiti chirurgici di 23 studi comprendenti 7071 pazienti in stadio I di NSCLC [21]. L’età media dei pazienti sottoposti a SBRT era inferiore a quella dei pazienti della serie chirurgica, rispettivamente 74 e 66 anni. Aggiustando la proporzione di pazienti operabili e l’età, la sopravvivenza globale, la sopravvivenza libera da malattia e il controllo locale non differivano significativamente tra SBRT e chirurgia. Gli autori hanno concluso che gli approcci chirurgici rimangono l’attuale standard di cura per i pazienti operabili dal punto di vista medico, ma a coloro che non sono idonei dal punto di vista medico o che possono rifiutare l’intervento chirurgico, la SBRT dovrebbe essere offerta come standard di cura grazie alla sua comprovata efficacia e alla bassa tossicità.
La SBRT è solitamente consigliata per i tumori periferici e il suo uso nei tumori centrali è ancora incerto a causa di un rischio di tossicità più elevato. Gli esiti della SBRT in 90 pazienti con NSCLC di stadio I centrale (50%) e periferico (56%) sono stati riportati da un database combinato di 13 centri di radioterapia accademici tedeschi e austriaci [22]. I tumori periferici avevano ricevuto una dose biologicamente efficace (BED10) più elevata (72 Gy per i tumori centrali contro 84 Gy per quelli periferici). La sopravvivenza globale attuariale a 3 anni è stata del 29% per i tumori centrali rispetto al 51% per quelli periferici (p<0,001), mentre la corrispondente libertà di progressione locale è stata rispettivamente del 52% e dell’84% (p<0,001). Non sono state segnalate differenze significative nelle tossicità correlate al trattamento. Questi risultati indicano tuttavia che i tumori centrali potrebbero essere trattati con la SBRT, ma i suoi risultati sono forse limitati da una dose ridotta nei tumori centrali.
Pertanto, la SBRT per il tumore al polmone è un approccio terapeutico praticabile per i tumori periferici fino a 6 cm e potrebbe essere considerata un’alternativa per i pazienti che non sono altrimenti idonei dal punto di vista medico alla chirurgia [3–5]. Per ottenere risultati ottimali, di solito è auspicabile un BED di >100Gy, prescritto con un’isodose comprensiva.
Radioterapia isotossica o personalizzata
La radioterapia isotossica o personalizzata prevede la somministrazione di dosi di radiazioni basate sui vincoli del tessuto normale del singolo paziente. L’attuale pratica della radioterapia prevede fasci di radiazioni modellati individualmente e conformati alle dimensioni del tumore di ogni singolo paziente, aprendo un passo verso la pianificazione del trattamento radiante individualizzato. Tuttavia, il trattamento individualizzato potrebbe anche essere esteso per includere la dose totale di tumore (TTD) più alta e tollerabile che potrebbe essere erogata e tollerata in un determinato paziente, rispettando i vincoli del tessuto normale. Baardwijk et al. hanno ipotizzato che il miglior programma di radiazioni realizzabile includa il più alto TTD basato su vincoli di dose di tessuto normale individualizzati, erogato in un tempo di trattamento complessivo inferiore a cinque settimane [23]. Sono riusciti a dimostrare la sua fattibilità e hanno erogato una dose tumorale media di 63 Gy (range 46,8-79,2 Gy) in pazienti non operabili dal punto di vista medico con NSCLC localmente avanzato, con una tossicità tissutale acuta e tardiva accettabile. Hanno ottenuto una risposta metabolica completa nel 44% dei pazienti, con una sopravvivenza globale a 1 anno del 57,1%. Sono in corso diversi studi in diversi centri del Regno Unito e dell’Europa.
Reymen et al. hanno recentemente riportato i risultati negli stadi T4N0-1 e stazione linfonodale singola IIIA-N2 della radioterapia accelerata isotossica individualizzata (INDAR) e della chemioterapia nel NSCLC [24]. 83 pazienti sono stati trattati con una dose mediana di 65 Gy (43,5-72 Gy) in un tempo di trattamento complessivo mediano di 30 giorni (17-48 giorni). Il trattamento consisteva in 30 frazioni di 1,5 Gy due volte al giorno, seguite da 2 Gy per frazione fino a un TTD massimo limitato dai vincoli del tessuto normale. 52 pazienti hanno ricevuto una chemioterapia concomitante, mentre 31 sono stati trattati con una chemioterapia sequenziale insieme a INDAR. Le sopravvivenze complessive per T4N0-1 a 2 e 5 anni sono state rispettivamente del 55 e del 25%, mentre le sopravvivenze corrispondenti per IIIA-N2 sono state rispettivamente del 53 e del 24%. L’effetto collaterale più grave osservato è stata l’esofagite di grado 3 in sette pazienti, ma tutti sono stati risolti con un trattamento conservativo.
Questi risultati indicano che la radioterapia isotossica con prescrizioni di dosi personalizzate potrebbe migliorare ulteriormente gli esiti di questi tumori inoperabili localmente avanzati e raggiungere una sopravvivenza a lungo termine con una bassa morbilità. Un’ulteriore escalation della dose con una migliore pianificazione e somministrazione della radioterapia, nuovi farmaci chemioterapici o agenti biologicamente mirati o persino una combinazione con la chirurgia potrebbero essere certamente esplorati in futuri studi di radioterapia isotossica.
Terapia con fascio di particelle – terapia con fascio di protoni e carbonio
Il caratteristico picco di Bragg (bassa dose all’ingresso del fascio e rapida caduta al momento del deposito della dose massima) fornisce un vantaggio dosimetrico unico dei protoni e dei fasci di carbonio rispetto ai fotoni [25]. Dal punto di vista radiobiologico, sebbene si ritenga che i fotoni siano quasi simili ai protoni, le elevate proprietà di trasferimento di energia lineare degli ioni carbonio conferiscono un vantaggio radiobiologico agli ioni carbonio rispetto ai protoni e ai fotoni. Quindi, teoricamente, le distribuzioni di dose di protoni e ioni di carbonio potrebbero essere più conformi ai volumi bersaglio con dosi integrali inferiori rispetto alla radioterapia basata sui fotoni.
Numerosi studi di fase I/II con fasci di particelle sono risultati sicuri ed efficaci nel NSCLC in stadio I. Una meta-analisi condotta da Grutters et al. ha esaminato l’efficacia comparativa di protoni, fotoni e carboni [26]. La sopravvivenza globale corretta a 2 anni è stata del 53% per la radioterapia convenzionale con fotoni, del 70% per la SBRT, del 61% per i protoni e del 74% per il carbonio. A 5 anni, le sopravvivenze complessive per la radioterapia convenzionale (20%) erano significativamente inferiori a quelle della SBRT (42%), della terapia con protoni (40%) e della terapia con ioni di carbonio (42%). Quindi, sembra che, sebbene i risultati con le terapie con particelle siano migliori rispetto al fascio di fotoni convenzionale, siano ancora paragonabili a quelli della SBRT. Si ritiene che la terapia con particelle potrebbe forse essere più vantaggiosa nello stadio III del NSCLC, dove la sopravvivenza globale a 2 anni scende a un mero 26-36% con la chemioradioterapia convenzionale [26].
Un recente rapporto di Chang et al. ha evidenziato la capacità della terapia protonica a intensità modulata (IMPT) di essere fattibile insieme alla gestione del movimento respiratorio basata sulla TC 4D per il NSCLC. In uno studio pilota che ha coinvolto 34 pazienti consecutivi, è stato riscontrato che l’IMPT con gating respiratorio produce una riduzione significativa di tutti i parametri dosimetrici considerati rispetto all’IMRT standard [27].
Con l’aumento delle strutture di fasci di protoni, l’introduzione della terapia con fasci di protoni a modulazione d’intensità (IMPT) e la guida di immagini volumetriche a bordo, si può prevedere un miglioramento dei risultati con la terapia con protoni, anche se questo deve essere confermato da studi randomizzati con la SBRT.
Conclusioni
Il NSCLC continua a rappresentare una sfida per gli oncologi curanti, che devono integrare le migliori opzioni possibili con una combinazione di chirurgia, radioterapia e chemioterapia. Anche con gli ultimi sviluppi in ciascuna di queste modalità, sia il controllo locale che la sopravvivenza complessiva continuano a preoccupare gli oncologi curanti.
Gli attuali sviluppi tecnologici della radioterapia, insieme alla comprensione delle implicazioni radiobiologiche dei vari schemi di frazionamento della dose, hanno certamente permesso una somministrazione più sicura e precisa della radioterapia. Questo ha aperto le varie opzioni come la SBRT, la radioterapia isotossica, il fascio di particelle, ecc. come possibile alternativa per un gruppo selezionato di pazienti. Tuttavia, l’integrazione con altre modalità, come gli agenti chemioterapici e le terapie a bersaglio molecolare di recente sviluppo, necessita di ulteriori indagini basate sia sull’evidenza che sulla medicina personalizzata per ottenere i risultati desiderati.
Prof. Dr. med. Niloy Ranjan Datta
Dr. med. Silvia Gómez Ordóñez
Prof. Dr. med. Stephan Bodis
Literatur:
- Ferlay J, et al: GLOBOCAN 2012 v1.0, Incidenza e mortalità del cancro nel mondo: IARC Cancer Base No. 11 [Internet]. Lione, Francia: Agenzia Internazionale per la Ricerca sul Cancro; 2013. Disponibile all’indirizzo: http://globocan.iarc.fr.
- Bordoni A, et al: Tendenze nella sopravvivenza del cancro al polmone in Svizzera. Schweizer Krebsbulletin 2012; 3. Disponibile all’indirizzo: www.nicer.org/assets/files/skb_3-2012_nicer_lung_cancer_survival_in_ch.pdf.
- Vansteenkiste J, et al…: Annl Oncol 2013; 24(suppl 6): vi89-vi98.
- Linee guida di pratica clinica NCCN in oncologia: Carcinoma polmonare non a piccole cellule, versione 4. 2014. Disponibile all’indirizzo: www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
- Società tedesca di radioterapia (DEGRO): Linee guida per la radioterapia stereotassica extracranica. Disponibile all’indirizzo: www.degro.org/dav/html/download/pdf/ESRT_Leitlinie.pdf.
- Commissione Internazionale sulle Unità e le Misure di Radiazione: Prescribing, Recording and Reporting Photon Beam Therapy (Supplement to ICRU Report 50), ICRU Report 62, Bethesda, MD, 1999.
- Commissione internazionale sulle unità e le misure di radiazione: Prescribing, Recording and Reporting Photon Beam Intensity Modulated Radiation Therapy, Rapporto ICRU 83, Bethesda, MD, 2010.
- Chi A, Nguyen NP: Front Oncol 2014 Oct 7; 4: 273.
- van Baardwijk A, et al: Eur J Cancer 2012; 48: 2339-2346.
- Fleckenstein J, et al: Int J Radiat Oncol Biol Phys 2011; 81: e282-289.
- Bradley JD, et al: Int J Radiat Oncol Biol Phys 2010; 77: 367-372.
- Schild SE, et al: Int J Radiat Oncol Biol Phys 2006; 65: 1106-1111.
- Sociniski MA, et al: J Clin Oncol 2008; 26: 2457-2463.
- Bradley J, et al: J Clin Oncol 2013; 31(15): 7501.
- Belani CP, et al: J Clin Oncol 2005; 23: 3760-3767.
- Hatton M, et al: Int J Radiat Oncol Biol Phys 2011; 81: 712-718.
- Saunders M, et al: Lancet 1977; 350: 161-165.
- Bogart JA, et al: J Clin Oncol 2010; 28: 202-206.
- Ruysscher DD, et al: J Clin Oncol 2010; 28: 5301-5310.
- Soldà F, et al: Radiother Oncol 2013; 109: 1-7.
- Zheng X, et al: Int J Radiat Oncol Biol Phys 2014; 90: 603-611.
- Schanne DH, et al: Strahlenther Onkol 2014, doi: 10.1007/s00066-014-0739-5.
- van Baardwijk A, et al…: Int J Radiat Oncol Biol Phys 2008; 71: 1394-1401.
- Reymen B, et al: Radiother Oncol 2014; 110: 482-487.
- Grant JD, Chang JY: Biomed Res Int 2014: 389048. doi: 10.1155/2014/389048.
- Grutters JPC, et al…: Radiother Oncol 2010; 95: 32-40.
- Chang JY, et al: Int J Radiat Oncol Biol Phys 2014; 90: 809-818.
InFo ONKOLOGIE & HÄMATOLOGIE 2015; 3(1): 6-12