La fibrillazione atriale è un disturbo del ritmo dinamico che richiede chiarimenti e approcci terapeutici individuali e ampi. Il trattamento completo dei pazienti con fibrillazione atriale si basa su cinque pilastri: 1. prevenzione degli eventi tromboembolici; 2. controllo dei sintomi; 3. Se possibile, ripristinare o mantenere il ritmo sinusale; 4. Altrimenti, un buon controllo della frequenza; 5. trattamento della cardiopatia di base e dei fattori predisponenti.
La fibrillazione atriale colpisce l’1-2% dell’intera popolazione, diventando così l’aritmia cardiaca più comune [1–3]. A causa dell’aumento della prevalenza dei fattori di rischio e delle malattie cardiovascolari e dell’aumento dell’età media della popolazione generale, nella pratica clinica ci troviamo di fronte a un numero crescente di pazienti con fibrillazione atriale [1–3]. Il trattamento completo è una sfida. Oltre a mantenere la qualità della vita, è importante ridurre il rischio di tromboembolismo e l’aumento generale del rischio di morbilità e mortalità associato alla fibrillazione atriale [1,2]. I risultati della ricerca epidemiologica e clinica, l’avvento di nuovi anticoagulanti orali (“anticoagulanti orali non antagonisti della vitamina K” (NOAC) e i progressi nel campo dell’elettrofisiologia interventistica hanno rivoluzionato il trattamento della FA. Questo articolo si propone di fornire una panoramica dei concetti principali e degli ultimi paradigmi nel trattamento della fibrillazione atriale.
Chiarimenti iniziali e stratificazione del rischio
Oltre alla valutazione clinica e di laboratorio, i pazienti con fibrillazione atriale appena scoperta e documentata elettrocardiograficamente devono essere valutati anche con l’ecocardiografia e, se necessario, con un ECG a lungo termine [1,2]. L’anamnesi e i reperti costituiscono la base per classificare il tipo di fibrillazione atriale (parossistica, persistente, persistente da lungo tempo [>1 anno], o permanente), graduare i sintomi e valutare il rischio di tromboembolismo ed emorragia. Il processo di valutazione e di trattamento primario è riassunto in modo approssimativo nella Figura 1. Va notato che il punteggio CHA2DS2-VASc ha sostituito efficacemente il punteggio CHADS2 per il rischio di ictus [4].

Profilassi del tromboembolismo nella fibrillazione atriale
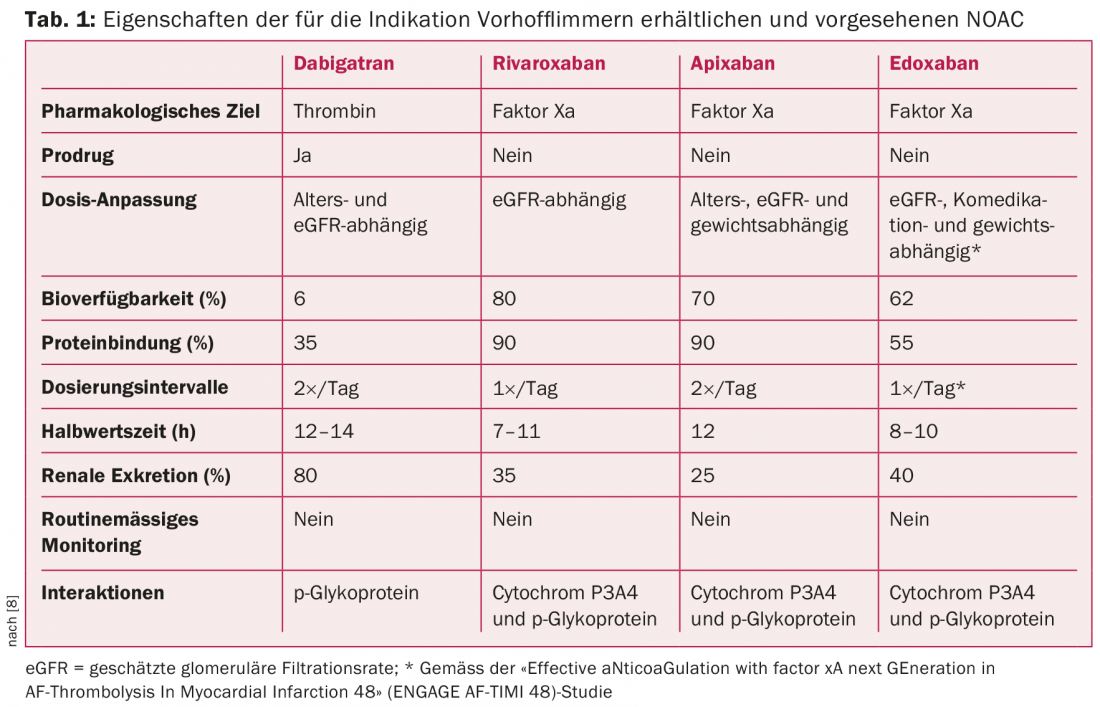
Contemporaneamente all’introduzione del punteggio CHA2DS2-VASc, alcuni anni fa si è verificato un cambiamento di paradigma nell’anticoagulazione per la FA [1,2,4]. Questo riorientamento è stato decisamente plasmato dall’emergere del NOAC [4,5]. Ad oggi, tre NOAC – apixaban, dabigatran e rivaroxaban (ordine alfabetico) – si sono affermati nella pratica clinica di routine per la profilassi degli eventi tromboembolici [4–7]. Con edoxaban, sta per essere lanciato un quarto preparato (nota del redattore: ora approvato) (Tab. 1) [7]. I NOAC hanno rivoluzionato e semplificato l’anticoagulazione.
Inoltre, il ruolo dei farmaci antiaggreganti per la prevenzione dell’ictus nella fibrillazione atriale è stato ridefinito [1,2]. Oggi è generalmente sconsigliato prescrivere l’aspirina per la profilassi dell’ictus ai pazienti con fibrillazione atriale, in quanto non garantisce una profilassi sufficiente contro le tromboembolie e allo stesso tempo aumenta significativamente il rischio di sanguinamento [1,4].
Studi randomizzati molto ampi hanno dimostrato che i NOAC sono equivalenti o addirittura superiori agli antagonisti della vitamina K (VKA) nei pazienti con FA [1,5–8]. In particolare, la superiorità in termini di rischio di emorragia intracranica è una caratteristica importante dei NOAC [1,5–8]. In generale, si deve notare che prima di iniziare la terapia anticoagulante, si deve valutare il rischio di interazione, emorragia e complicazioni generali, includendo i punteggi di rischio (ad esempio il punteggio HAS-BLED), se necessario. In vista della crescente diffusione dei NOAC, è importante tenere presente che una riduzione della funzione renale può anche portare ad un accumulo di anticoagulanti. L’entità dell’accumulo è correlata alla gravità della disfunzione renale e dipende anche dalla sostanza utilizzata. (Tab. 1). Bisogna anche essere preparati alle potenziali interazioni farmacologiche e sapere che – come i VKA – anche i NOAC possono essere influenzati in modo rilevante nel loro metabolismo dalla co-somministrazione di farmaci e dalla funzione epatica. (Tab.1) [4,5].
A volte, vengono trattati pazienti con fibrillazione atriale e un rischio elevato di tromboembolismo, ma che sono a rischio di emorragia o che non sono a rischio di tromboembolismo. -Le complicazioni non sono idonee all’anticoagulazione. Oggi è noto che l’orecchio atriale sinistro è una fonte centrale di formazione di trombi nella fibrillazione atriale [9,10]. Per i pazienti ben selezionati che non sono idonei all’anticoagulazione a causa di controindicazioni, negli ultimi anni è emersa un’alternativa con l’introduzione dei cosiddetti sistemi di chiusura dell’appendice atriale per ridurre il rischio di ictus o di morte per ictus. per contenere il rischio di emorragia [1,2,9,10]. Diversi studi hanno già dimostrato che questi sistemi di chiusura dell’orecchio atriale possono essere un’opzione di trattamento efficace [9,10].
Controllo del ritmo – Opzioni farmacologiche
Oltre alla profilassi del tromboembolismo, il secondo elemento centrale per i pazienti con fibrillazione atriale è la terapia dell’aritmia in sé. La strategia di trattamento deve basarsi sulle circostanze individuali ed è quindi orientata ai sintomi del paziente, alla durata dell’episodio di fibrillazione atriale e alla situazione clinica generale.
Le possibili strategie per il controllo del ritmo nei pazienti con fibrillazione atriale parossistica o persistente sono elencate nella Figura 2. I pazienti sintomatici e quelli con una funzione cardiaca ridotta nella fibrillazione atriale (ad esempio, la tachicardiomiopatia) spesso beneficiano della terapia di controllo del ritmo [2,3,11]. A seconda dei sintomi e della durata dell’episodio di fibrillazione atriale, dopo aver chiarito la necessità della terapia anticoagulante o della terapia anticoagulante, il paziente può essere ricoverato in ospedale. dopo l’esclusione di un trombo intracardiaco, si deve tentare la terapia farmacologica o la cardioversione elettrica. In generale, se la fibrillazione atriale persiste da più di 48 ore o più, l’anticoagulazione deve essere stabilita per almeno tre settimane prima della cardioversione e poi continuata per almeno quattro settimane e successivamente a tempo indeterminato, a seconda del punteggio CHA2DS2 VASc [1,2].
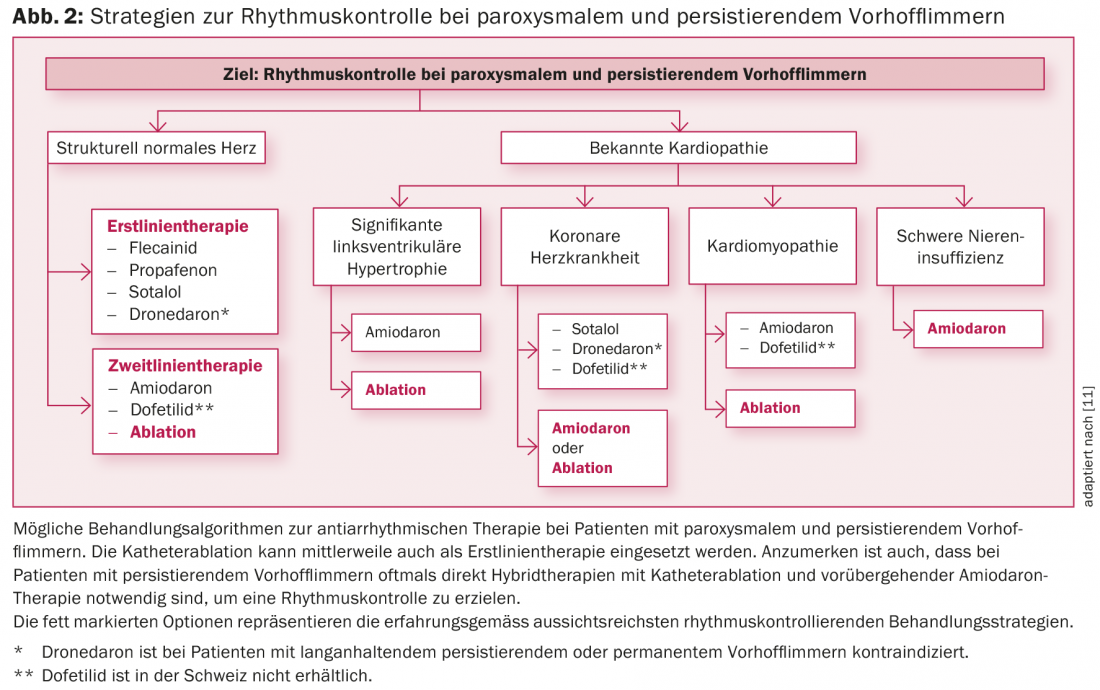
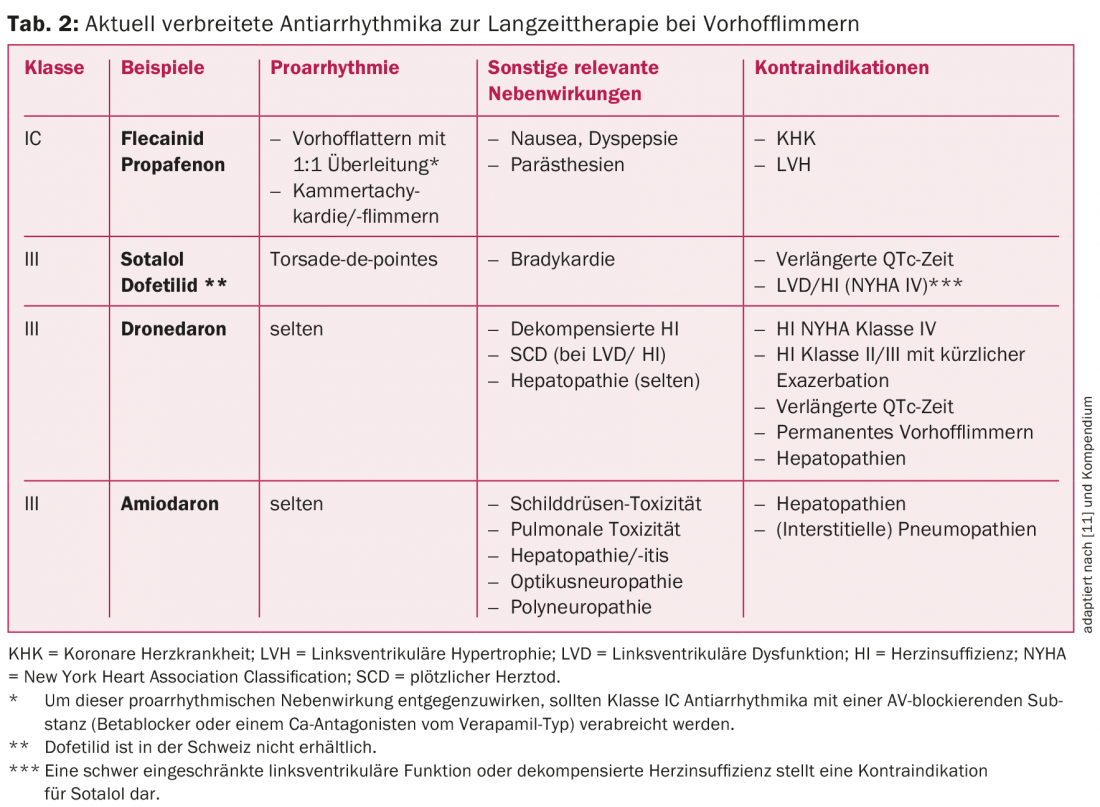
I farmaci antiaritmici attualmente più diffusi per il controllo del ritmo a lungo termine e le loro indicazioni nella fibrillazione atriale sono elencate nella tabella 2 e nella figura 2. Nei pazienti senza cardiopatia strutturale, i farmaci antiaritmici di classe IC (ad esempio flecainide o propafenone) in combinazione con un β-bloccante cardioselettivo sono la prima scelta [1]. L’amiodarone e la dofetilide (quest’ultima non disponibile in Svizzera) sono gli agenti terapeutici di scelta, in particolare nei pazienti con cardiopatia strutturale o funzione di pompa compromessa (fig. 2) [1,3]. L’amiodarone è il più potente farmaco antiaritmico disponibile e deve essere somministrato su base limitata nel tempo, se possibile, a causa del suo considerevole profilo di effetti collaterali e di interazioni [2,3,11]. I farmaci antiaritmici più recenti, come il vernakalant (disponibile solo per via endovenosa) e il dronedarone, non sono stati in grado di affermarsi a lungo termine a causa dell’efficacia limitata e degli studi sfavorevoli. Il dronedarone, in particolare, deve essere usato con cautela a causa dei risultati degli studi PALLAS e ANDROMEDA [2,3,11]. Per esempio, il dronedarone non è raccomandato per i pazienti con fibrillazione atriale permanente o fibrillazione atriale. L’insufficienza cardiaca è addirittura controindicata [2,3,11]. Tuttavia, poiché anche i farmaci antiaritmici di classe IC e III hanno un effetto limitato e la fibrillazione atriale è una malattia dinamica, i farmaci a lungo termine per mantenere il ritmo spesso non hanno molto successo [2,3,11].
Controllo del ritmo – Opzioni elettrofisiologiche
Con la crescente comprensione fisiopatologica dello sviluppo della fibrillazione atriale, emergono costantemente nuovi target terapeutici. Da quando sono state eseguite le prime procedure ritmico-chirurgiche (procedure MAZE) per preservare il ritmo sinusale, molto è accaduto nel campo del trattamento interventistico della fibrillazione atriale. Oggi, l’obiettivo è quello di isolare elettricamente le vene polmonari nei pazienti con fibrillazione atriale parossistica e anche persistente, mediante procedure di ablazione basate su cateteri e il posizionamento di linee di scleroterapia, poiché si ritiene che i focolai elettricamente attivi siano importanti fattori scatenanti dell’aritmia (Fig. 3) [1,2,11].
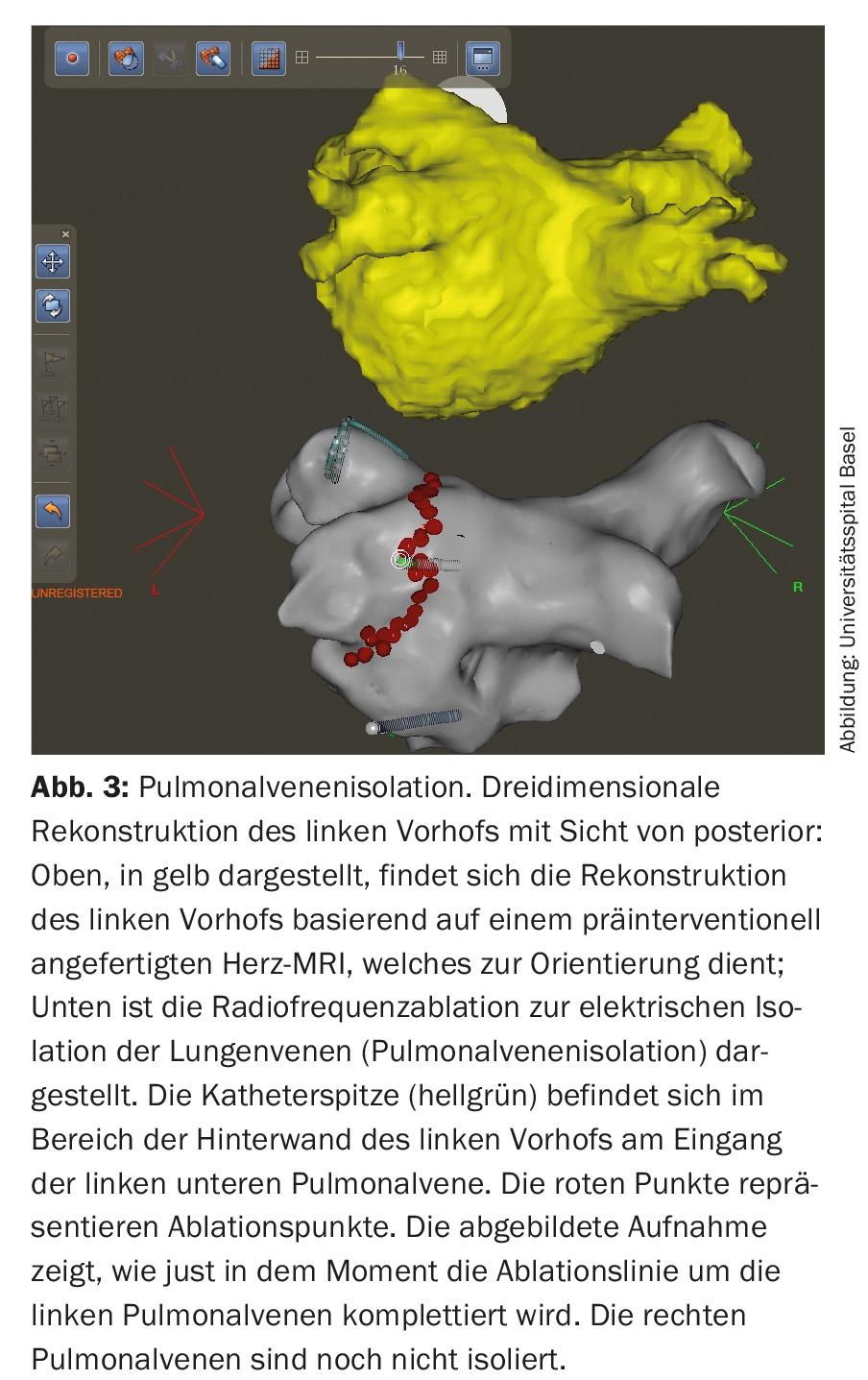
L’isolamento della vena polmonare viene eseguito con la radiofrequenza o la crioablazione ed è diventata una procedura cardiaca di routine. Il rischio di complicazioni è ora molto basso nei centri con un numero elevato di procedure. Oltre alle complicazioni nel sito di puntura inguinale (circa il 2%), in rari casi può verificarsi un tamponamento pericardico che richiede un drenaggio (<1%). Anche la TIA o l’ictus sono rari (<1%) e la complicanza più temuta, la fistola atrio-esofagea, è molto rara (0,01-0,2%) [2,10,11]. Sempre più spesso, la terapia di ablazione è il trattamento primario per molti pazienti sintomatici con FA [1–3,11]. Tuttavia, l’indicazione alla terapia interventistica deve essere fatta solo dopo un’attenta valutazione del rapporto rischio/beneficio. In generale, oltre alla preferenza del paziente, devono essere valutati i seguenti fattori: tipo e durata della fibrillazione atriale, dimensioni dell’atrio e cardiopatie sottostanti [1,2,11].
Le percentuali di successo dell’ablazione della fibrillazione atriale sono migliorate in modo significativo negli ultimi anni. Una meta-analisi pubblicata di recente ha mostrato che l’ablazione con catetere ha fatto sì che il 77% di tutti i pazienti fosse libero da FA sintomatica dopo un anno, rispetto al 52% con la terapia farmacologica antiaritmica [2]. Tuttavia, l’esperienza dimostra che circa un quarto o un terzo di tutti i pazienti ha bisogno di un secondo intervento (la cosiddetta redo-ablazione) per ottenere un controllo duraturo dei sintomi [3,11].
Controllo della frequenza
Nei pazienti asintomatici e soprattutto anziani e polimorfi con fibrillazione atriale, l’attenzione si concentra spesso sul controllo della frequenza cardiaca. Questo approccio si basa sui dati di diversi studi randomizzati (ad esempio, lo studio AFFIRM e RACE), che non sono riusciti a dimostrare un beneficio discernibile in termini di mortalità della terapia di controllo del ritmo rispetto a quella di controllo della frequenza nelle rispettive popolazioni di pazienti [2,3,11]. Se la fibrillazione atriale è accettabile perché il paziente è asintomatico, solo la frequenza ventricolare viene controllata con un beta-bloccante o un calcio antagonista [2,3,11]. La digossina viene ancora utilizzata, ad esempio, quando è necessario il controllo della frequenza nel contesto dell’insufficienza cardiaca scompensata, ma gli autori la utilizzano solo in casi molto selezionati. Lo studio TREAT-AF pubblicato di recente, un’analisi retrospettiva di oltre 120.000 pazienti, punta nella stessa direzione dimostrando che la digossina è associata a un aumento della mortalità nella FA [12].
Se non si riesce a ottenere un adeguato controllo della frequenza con i farmaci, si deve cercare un controllo interventistico della frequenza [2]. Questo utilizza anche l’ablazione del catetere per tagliare il nodo AV, con conseguente controllo della frequenza ventricolare ma anche della dipendenza dal pacemaker [2]. Questa opzione terapeutica sta acquistando di nuovo importanza, in quanto ha un’alta percentuale di successo (>99%) e l’effetto collaterale positivo per il paziente che i farmaci bloccanti la frequenza (e i loro effetti collaterali) possono anche essere sospesi.
Trattamento dei fattori di rischio e concomitanti
Un gran numero di studi ha dimostrato che il trattamento ottimale dei classici fattori di rischio cardiovascolare (ipertensione arteriosa, diabete, dislipidemia e consumo di nicotina) e delle comuni malattie concomitanti, come l’obesità, la sindrome da apnea ostruttiva del sonno e l’insufficienza renale, influisce positivamente sull’incidenza e sul decorso della FA [2,3,11,13].
In un lavoro pubblicato di recente, è stato dimostrato in modo impressionante che una rigorosa riduzione del peso in combinazione con un trattamento ottimale dei fattori di rischio cardiometabolici porta a una riduzione della fibrillazione atriale sintomatica e a un’influenza positiva sul rimodellamento cardiaco [13]. Il termine “terapia a monte” è diventato di moda in relazione al trattamento completo della fibrillazione atriale [2,3,11]. Questo include la terapia farmacologica per fattori come l’infiammazione e la fibrosi che favoriscono la fibrillazione atriale. A questo proposito, diversi studi hanno dimostrato che gli ACE-inibitori/AT-2 antagonisti e le statine in particolare possono avere un effetto positivo a lungo termine e contrastare l’evoluzione della fibrillazione atriale.
Conflitti di interesse
- Matthias Bossard non ha conflitti di interesse in relazione a questo articolo.
- Stefan Osswald: onorari per consulenze/lezioni: Boehringer-Ingelheim
- Michael Kühne: onorari per consulenze/lezioni: Boehringer-Ingelheim, Bayer, Daiichi-Sankyo
Letteratura:
- Camm AJ, et al: Aggiornamento focalizzato del 2012 delle Linee guida ESC per la gestione della fibrillazione atriale: un aggiornamento delle Linee guida ESC 2010 per la gestione della fibrillazione atriale. Sviluppato con il contributo speciale dell’Associazione Europea del Ritmo Cardiaco. Eur Heart J 2012 Nov; 33(21): 2719-2747.
- European Heart Rhythm A, European Association for Cardio-Thoracic S, Camm AJ, et al: Linee guida per la gestione della fibrillazione atriale: la Task Force for the Management of Atrial Fibrillation della Società Europea di Cardiologia (ESC). Eur Heart J 2010 Oct; 31(19): 2369-2429.
- Trulock KM, Narayan SM, Piccini JP: Controllo del ritmo nei pazienti con insufficienza cardiaca e fibrillazione atriale: sfide contemporanee, compreso il ruolo dell’ablazione. J Am Coll Cardiol 2014 Aug 19; 64(7): 710-721.
- Lip GY: Valutazione del rischio di ictus ed emorragia nella fibrillazione atriale: quando, come e perché? Eur Heart J 2013 Apr; 34(14): 1041-1049.
- Heidbuchel H, et al: Guida pratica EHRA sull’uso dei nuovi anticoagulanti orali nei pazienti con fibrillazione atriale non valvolare: sintesi. Eur Heart J 2013 Jul; 34(27): 2094-2106.
- Granger CB, et al: Apixaban rispetto a warfarin nei pazienti con fibrillazione atriale. N Engl J Med 2011 Sep 15; 365(11): 981-992.
- Giugliano RP, et al: Edoxaban rispetto a warfarin nei pazienti con fibrillazione atriale. N Engl J Med 2013 Nov 28; 369(22): 2093-2104.
- Hart RG, et al: Anticoagulanti nei pazienti con fibrillazione atriale e malattia renale cronica. Nat Rev Nephrol 2012 Oct; 8(10): 569-578.
- Reddy VY, et al: Chiusura percutanea dell’appendice atriale sinistra vs warfarin per la fibrillazione atriale: uno studio clinico randomizzato. JAMA 2014 Nov 19; 312(19): 1988-1998.
- John Camm A, et al: Chiusura dell’appendice atriale sinistra: una nuova tecnica per la pratica clinica. Ritmo cardiaco 2014 Mar; 11(3): 514-521.
- Woods CE, Olgin J: La terapia della fibrillazione atriale oggi e in futuro: farmaci, biologici e ablazione. Circ Res 2014 Apr 25; 114(9): 1532-1546.
- Turakhia MP, et al: Aumento della mortalità associato alla digossina nei pazienti contemporanei con fibrillazione atriale: risultati dello studio TREAT-AF. J Am Coll Cardiol 2014 Aug 19; 64(7): 660-668.
- Abed HS, et al: Effetto della riduzione del peso e della gestione dei fattori di rischio cardiometabolici sul carico e sulla gravità dei sintomi nei pazienti con fibrillazione atriale: uno studio clinico randomizzato. JAMA 2013 Nov 20; 310(19): 2050-2060.
CARDIOVASC 2015











