Al primo simposio svizzero sulle neoplasie peritoneali e l’HIPEC a San Gallo, gli esperti hanno parlato dei temi del carcinoma ovarico e del carcinoma colorettale metastatico. Si trattava delle opzioni terapeutiche attuali e potenziali future. Qual è il valore correttivo di bevacizumab? Dove sono le possibilità di una terapia personalizzata? E quali sono i marcatori predittivi confermati che dovrebbero guidare le decisioni di trattamento?
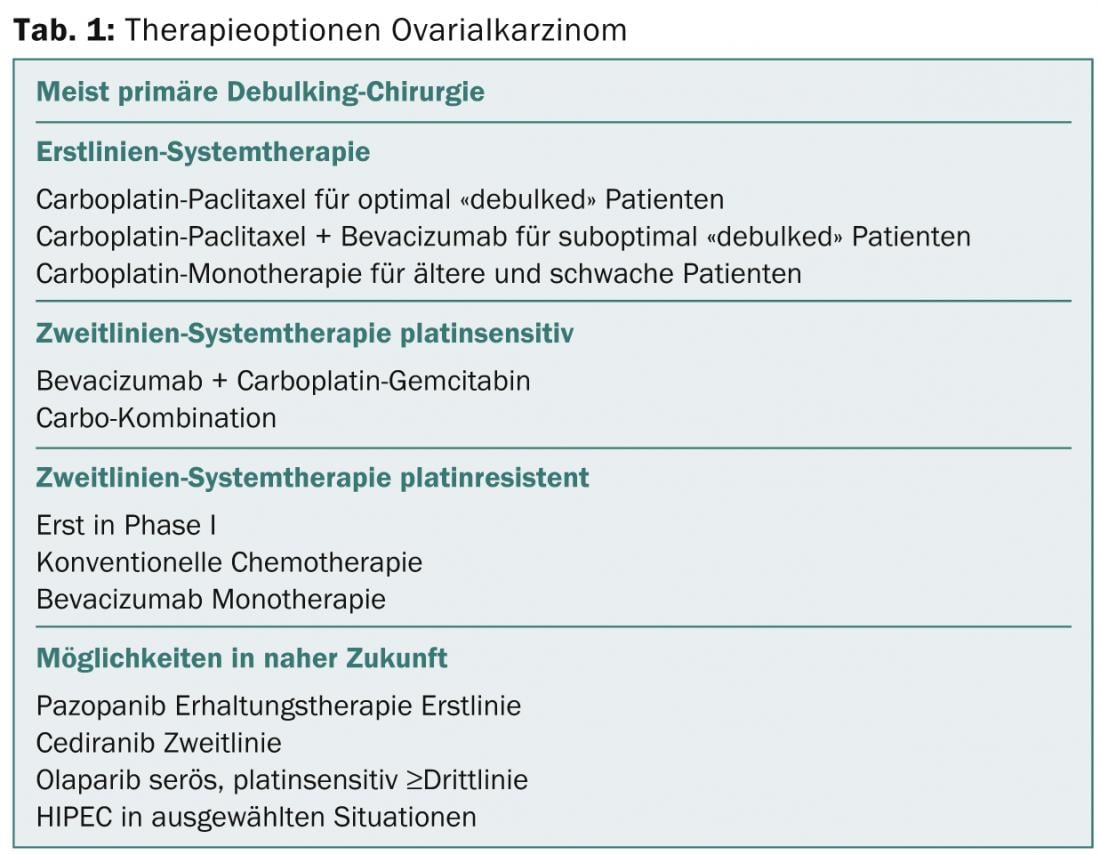
Per il trattamento oncologico del carcinoma ovarico valgono gli stessi principi del carcinoma tubarico e peritoneale. Secondo il Prof. Dr. med. Beat Thürlimann dell’Ospedale Cantonale di San Gallo, ci sono standard ben consolidati, ma quasi nessun gold standard. Tali sono:
- Chirurgia ottimale con debulking
- Chemioterapia di prima linea: a base di platino
- Chemioterapia di seconda linea: terapia combinata a base di platino
- Chirurgia palliativa.
Le tendenze relativamente nuove sono il bevacizumab dopo il debulking primario come aggiunta alla chemioterapia (disponibile) e cediranib e olaparib (presto disponibili) per le forme progressive sensibili al platino.

Bevacizumab (anti-VEGF): lo studio ICON7 (fase III) ha analizzato la sicurezza e l’efficacia di bevacizumab come aggiunta alla chemioterapia standard con carboplatino e paclitaxel in 1528 donne con tumore ovarico di nuova diagnosi (stadio FIGO I-IIA [klarzellig oder Grad 3] o stadio FIGO IIB-IV). Dopo che l’analisi primaria [1] sulla sopravvivenza libera da progressione aveva già dimostrato un beneficio dell’aggiunta, soprattutto nelle donne ad alto rischio di progressione, i risultati finali sulla sopravvivenza globale sono stati presentati al Congresso ECC 2013: Mentre non è stato possibile evidenziare alcuna differenza significativa tra il gruppo di controllo e quello di studio nell’intera popolazione, il sottogruppo ad alto rischio di progressione (pazienti in stadio III, IV e non operati “debulkati” in modo subottimale) ha tratto un beneficio particolarmente importante: in questo caso, la sopravvivenza globale è migliorata in modo significativo.
Lo studio AURELIA è stato il primo studio randomizzato ad analizzare l’aggiunta di bevacizumab alla chemioterapia in una popolazione di tumore ovarico resistente al platino. I partecipanti si erano già sottoposti a due o più terapie antitumorali. Sono stati randomizzati a ricevere la chemioterapia (paclitaxel, topotecan, “doxorubicina liposomiale pegilata” [PLD]) o bevacizumab più chemioterapia, fino alla progressione o a tossicità insostenibili. Di conseguenza, l’aggiunta di bevacizumab ha prolungato significativamente la sopravvivenza libera da progressione di circa tre mesi. Il beneficio nella sopravvivenza globale (anch’essa di circa tre mesi), invece, non ha raggiunto la significatività statistica, come ha chiarito un’altra presentazione al Congresso ECC 2013.
Cediranib (anti-VEGF): lo studio ICON6 (fase III) ha studiato il cediranib nel trattamento del carcinoma ovarico recidivato, sensibile al platino. I partecipanti avevano già ricevuto una chemioterapia di prima linea a base di platino e, dopo una nuova ricaduta, o hanno assunto la sola chemioterapia (Braccio A) o chemioterapia più cediranib (bracci B e C). Inoltre, è stata somministrata una fase di mantenimento con cediranib nel terzo gruppo di studio (braccio C) e una fase di mantenimento con cediranib negli altri due (bracci A e B) uno iniziato con placebo.
È stato dimostrato che la chemioterapia più cediranib, seguita dal mantenimento di cediranib, ha fornito un significativo beneficio di sopravvivenza per questa popolazione (rispetto alla sola chemioterapia). Esiste anche una forte evidenza di un effetto di cediranib sulla sopravvivenza libera da progressione durante e dopo la chemioterapia.
“Quindi ci sono molte opzioni per il trattamento del carcinoma ovarico primario. Le opzioni terapeutiche stanno aumentando, ma alla fine è sempre una questione di costi”, conclude il Prof. Thürlimann. La Tabella 1 fornisce una panoramica.
CRC metastatico peritoneale
I progressi nel cancro del colon-retto metastatico (mCRC) sono dovuti principalmente a una chirurgia più aggressiva, a una migliore terapia sistemica e a una più stretta collaborazione tra oncologia e chirurgia.
Il Prof. Dr. med. Ulrich Güller, dell’Ospedale Cantonale di San Gallo, ha parlato innanzitutto del trattamento sistemico: “La chemioterapia convenzionale viene oggi eseguita con successo come trattamento mono o combinato con l’aiuto dei principi attivi 5-fluorouracile (5-FU), capecitabina (preparato orale di 5-FU), irinotecan e oxaliplatino. Tuttavia, abbiamo sempre bisogno di nuovi bersagli e li troveremo solo se impareremo a capire meglio e più dettagliatamente la proliferazione delle cellule tumorali.
Ad esempio, un nuovo farmaco che ha mostrato un beneficio in termini di sopravvivenza in uno studio di fase III come terapia di seconda linea è l’aflibercept [2]. Blocca l’attività di tre fattori di crescita pro-angiogenici: VEGF-A, VEGF-B e il cosiddetto “fattore di crescita placentare” (PIGF). Impedisce a questi fattori di crescita di legarsi ai recettori delle cellule tumorali e quindi sopprime la crescita di nuovi vasi sanguigni.
Gli anticorpi utilizzati oggi nel mCRC sono bevacizumab (anti-VEGF-A), cetuximab (anti-EGFR) e panitumumab (anti-EGFR). Diversi studi hanno dimostrato che questi agenti possono migliorare il tasso di risposta e la sopravvivenza.

Inoltre, è stato approvato regorafenib [3], un inibitore multichinasico orale con attività intracellulare. In particolare, blocca diverse chinasi coinvolte nell’angiogenesi/oncogenesi tumorale (tra cui VEGFR1, VEGFR2, VEGFR3, KIT, RET, PDGF).
“Quindi questa è la nostra situazione oggi: Abbiamo la chemioterapia convenzionale, l’aflibercept, tre anticorpi e un inibitore della tirosin-chinasi”, ha spiegato il Prof. Güller. “Nei prossimi anni, si prevede che gli inibitori di BRAF, PIK3, MEK e mTOR acquisteranno importanza nel mCRC. Inoltre, l’obiettivo in futuro è quello di somministrare un trattamento su misura per il singolo paziente”, ha detto il Prof. Güller. “La determinazione dello stato RAS (KRAS/NRAS) è un primo passo verso tale terapia individualizzata: è stato dimostrato che solo i pazienti con RAS wild type beneficiano degli anticorpi anti EGFR [4, 5]. La determinazione dello stato RAS è quindi necessaria in ogni caso prima di iniziare il trattamento con un anticorpo anti EGFR, poiché lo stato RAS ha un chiaro valore predittivo”.
Questo è stato recentemente confermato dallo studio FIRE-3, dove in un’analisi post-hoc il beneficio in termini di sopravvivenza globale dell’aggiunta di cetuximab a FOLFIRI (rispetto a bevacizumab/FOLFIRI) era ancora significativamente maggiore per i pazienti di tipo RAS wild-type rispetto alla popolazione originale di tipo KRAS wild-type.
Fonte: 1° Simposio svizzero sulle neoplasie peritoneali e l’HIPEC, 23 gennaio 2014, San Gallo.
Letteratura:
- Perren TJ, et al: Uno studio di fase 3 sul bevacizumab nel carcinoma ovarico. N Engl J Med 2011 Dec 29; 365(26): 2484-2496. doi: 10.1056/NEJMoa1103799.
- Van Cutsem E, et al: L’aggiunta di aflibercept a fluorouracile, leucovorin e irinotecan migliora la sopravvivenza in uno studio randomizzato di fase III nei pazienti con carcinoma colorettale metastatico precedentemente trattati con un regime a base di oxaliplatino. J Clin Oncol 2012 Oct 1; 30(28): 3499-3506. Epub 2012 Sep 4.
- Grothey A, et al: monoterapia con regorafenib per il carcinoma colorettale metastatico trattato in precedenza (CORRECT): studio internazionale, multicentrico, randomizzato, controllato con placebo, di fase 3. Lancet 2013 Jan 26; 381(9863): 303-312. doi: 10.1016/S0140-6736(12)61900-X. Epub 2012 Nov 22.
- Van Cutsem E, et al: Cetuximab più irinotecan, fluorouracile e leucovorina come trattamento di prima linea per il carcinoma colorettale metastatico: analisi aggiornata della sopravvivenza globale in base allo stato di mutazione KRAS e BRAF del tumore. J Clin Oncol 2011 20 maggio; 29(15): 2011-2019. doi: 10.1200/JCO.2010.33.5091. epub 2011 apr 18.
- Douillard JY, et al: Trattamento Panitumumab-FOLFOX4 e mutazioni RAS nel cancro del colon-retto. N Engl J Med 2013 Sep 12; 369(11): 1023-1034. doi: 10.1056/NEJMoa1305275.
InFo Oncologia & Ematologia 2014; 2(2): 18-21