Spesso si presta poca attenzione ai linfomi cutanei. Eppure sono successe molte cose negli ultimi anni. Pertanto, stanno emergendo anche opzioni di trattamento innovative per queste malattie rare, attraverso nuove opzioni terapeutiche come i coniugati anticorpo-farmaco, l’immunoterapia e i virus oncolitici. La caratterizzazione genetica e immunobiologica sempre più precisa consente anche una diagnostica sempre più differenziata.
Spesso si presta poca attenzione ai linfomi cutanei. Eppure sono successe molte cose negli ultimi anni. Questo è stato chiarito da diversi esperti di Zurigo, Leida e Birmingham al Congresso EADO di quest’anno. Pertanto, stanno emergendo anche opzioni di trattamento innovative per queste malattie rare, attraverso nuove opzioni terapeutiche come i coniugati anticorpo-farmaco, l’immunoterapia e i virus oncolitici. La caratterizzazione genetica e immunobiologica sempre più precisa consente anche una diagnosi sempre più differenziata, sia per i linfomi cutanei primari a cellule B che per quelli a cellule T.
Linfomi cutanei primari a cellule B: dei virus oncolitici e dei checkpoint immunitari
Sebbene i linfomi cutanei siano più comunemente considerati come neoplasie a cellule T, circa un linfoma cutaneo primario su cinque è un linfoma a cellule B. Si distinguono tre sottotipi: il linfoma primario cutaneo della zona marginale, il linfoma primario cutaneo follicolare e il linfoma primario cutaneo a grandi cellule B. Secondo il Dr. med. Egle Ramelyte dell’Ospedale Universitario di Zurigo, nel prossimo futuro potrebbero aprirsi nuove possibilità terapeutiche per tutte le entità, ad esempio attraverso l’uso mirato di virus oncolitici. È già stato approvato per il trattamento del melanoma maligno dal 2015 e recentemente è stato testato anche nelle neoplasie cutanee a cellule B [1]. Attraverso l’iniezione intralesionale del virus dell’herpes simplex 1 geneticamente modificato talimogene laherparepvec (T-VEC). si potrebbero ottenere risultati promettenti.
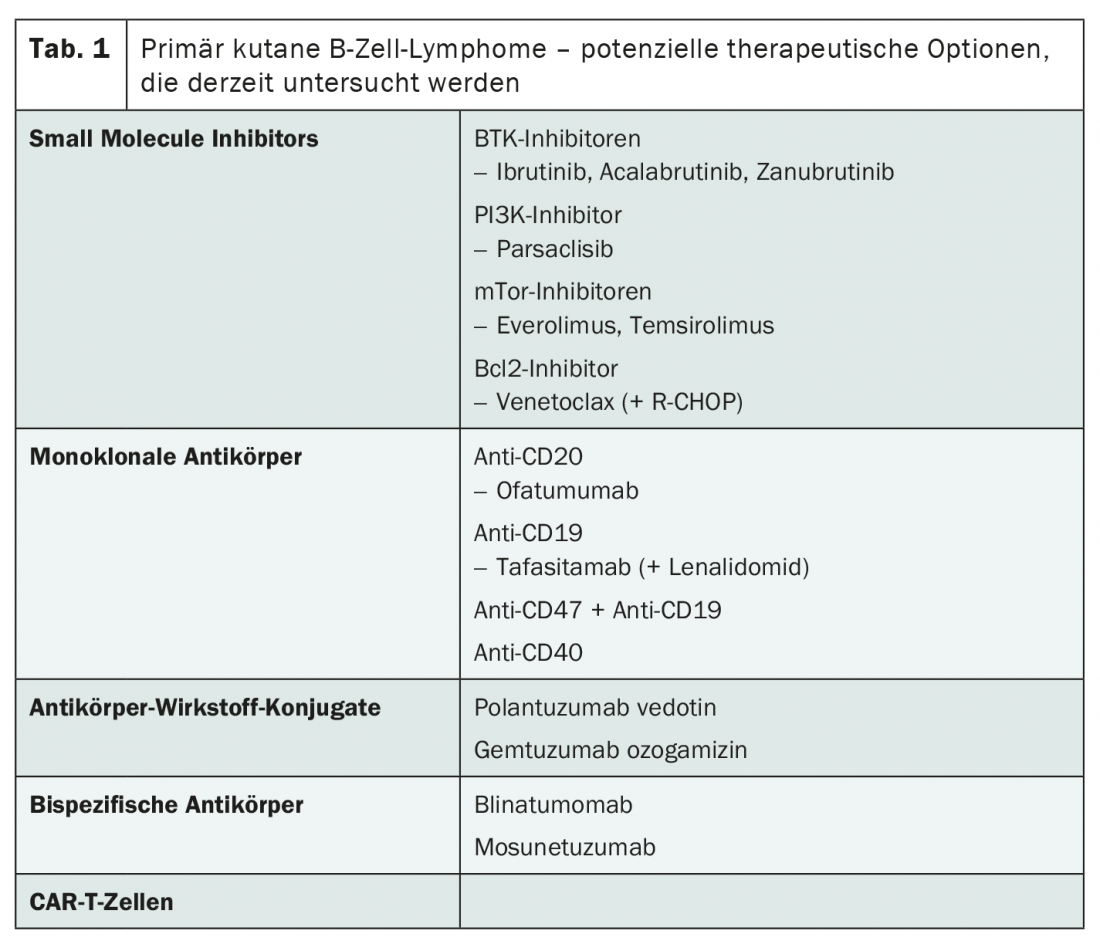
L’attuale panorama della ricerca ha molto da offrire anche in termini di terapia per gli stadi avanzati. Sebbene la maggior parte dei composti sia stata studiata nel linfoma diffuso a grandi cellule B (DLBCL) nodale, i risultati dello studio dovrebbero essere rilevanti anche per i linfomi cutanei primari a cellule B, afferma Ramelyte. Pertanto, presto potrebbero esserci alternative alla radioterapia, al rituximab e alla chemioterapia con R-CHOP. Oltre agli inibitori di piccole molecole e agli anticorpi monoclonali, vengono presi in particolare considerazione i coniugati anticorpo-farmaco, gli anticorpi bispecifici e le cellule CAR-T ( Tab. 1). Questi ultimi sono già approvati in Svizzera per il trattamento del DLBCL recidivato o refrattario – con grande successo.
A differenza di altre opzioni immunoterapeutiche, come gli anticorpi bispecifici, che legano la cellula tumorale da un lato e le cellule T dell’organismo dall’altro e quindi portano alla lotta contro la neoplasia, l’esperto vede minori probabilità di successo per gli inibitori del checkpoint nella terapia delle neoplasie cutanee a cellule B. Sebbene abbiano cambiato il panorama terapeutico dei tumori solidi a lungo termine, hanno avuto poco successo con le neoplasie ematologiche, a parte il linfoma di Hodgkin. Il tasso di risposta nel DLBCL alla terapia di combinazione anti-PD1/anti-CTLA4 è inferiore al 30%, ha detto Ramelyte. Tuttavia, sono attualmente in fase di sperimentazione diversi trattamenti di combinazione con gli inibitori del checkpoint. Inoltre, si sta studiando LAG3, un potenziale nuovo checkpoint immunitario che è espresso da oltre il 70% dei DLBCL. Secondo un recente studio, LAG3 è probabilmente associato a una prognosi peggiore, indipendentemente dall’Indice prognostico internazionale [2]. Questo nuovo checkpoint potrebbe quindi acquisire una rilevanza sia diagnostica che terapeutica.
Di importanza diagnostica possono essere anche i risultati nei campi della genetica tumorale e dell’immunoistochimica. Attualmente, si sta testando il valore dei due marcatori immunoistochimici IRTA1 e MNDA, che sono stati utilizzati principalmente per la diagnosi dei linfomi MALT extracutanei [3]. Negli ultimi anni è stato anche dimostrato che la maggior parte dei DLBCL cutanei – quasi l’80% – presenta una mutazione nel gene MYD88. Questo porta all’attivazione del fattore di trascrizione NF-κB. Nei tumori il cui gene MYD88 non è mutato, nella maggior parte dei casi si può rilevare un’altra mutazione che attiva NF-κB [4].
Linfomi cutanei a cellule T: della citometria a flusso e della varianza genetica
Secondo gli attuali risultati della ricerca, il panorama genetico dei linfomi cutanei a cellule T è molto più eterogeneo di quello dei DLBCL cutanei. Questo potrebbe essere analizzato in modo più dettagliato attraverso l’uso del sequenziamento di nuova generazione. Nel complesso, sono state riscontrate grandi differenze genetiche sia tra gli individui colpiti che all’interno dello stesso tumore. In particolare, secondo il Prof. Maarten Vermeer, MD, Capo del Dipartimento di Dermatologia dell’Ospedale Universitario di Leiden, Paesi Bassi, l’integrità genomica è influenzata dalle mutazioni di P53, da varie vie di segnalazione come le vie di segnalazione NF-κB e JAK/STAT, e il paesaggio epigenetico è influenzato dalle aberrazioni genomiche. Nonostante la diversità del quadro, i cambiamenti caratteristici nella metilazione del DNA e nella modificazione degli istoni potrebbero avere un valore diagnostico e potenzialmente servire come marcatori nel futuro – con nomi come CMTM2, PROM1 o GNMT [5,6]. Questo perché attualmente mancano strumenti diagnostici affidabili per l’identificazione chiara dei linfomi cutanei a cellule T. E questo non è l’unico svantaggio della grande varianza genetica: Vermeer avverte della potenziale resistenza alle terapie mirate attraverso la selezione di sottopopolazioni di cellule tumorali.
Anche se oggi c’è ancora un po’ di incertezza nella diagnostica, soprattutto nel campo della diagnostica del sangue, sono stati fatti importanti progressi dall’epoca dell’identificazione morfologica delle cellule tumorali circolanti. La corretta classificazione di queste cellule maligne circolanti è importante in quanto è fondamentale per la stadiazione e quindi per la prognosi e la terapia. Con l’introduzione diffusa della citometria a flusso per la stadiazione, questo aspetto è stato standardizzato e migliorato negli ultimi anni, anche se la standardizzazione della procedura e l’identificazione dei marcatori adatti rimangono delle sfide [7].
Prognosi e terapia in transizione
Ci sono ancora incertezze anche per quanto riguarda i fattori prognostici dei linfomi a cellule T cutanei. Tuttavia, negli ultimi anni sono emersi nuovi marcatori prognostici, come il carico totale di mutazioni e la frequenza dei cloni tumorali (TCF) nella lesione. Un TCF superiore al 25% era un predittore di progressione più forte di tutti gli altri fattori prognostici stabiliti nello studio corrispondente [8]. Un prerequisito per la determinazione del TCF è l’identificazione del clone di cellule T, che oggi può essere effettuata mediante sequenziamento high-throughput con una sensibilità significativamente più elevata rispetto alla tradizionale PCR (reazione a catena della polimerasi) . Tuttavia, questo metodo è costoso e finora è stato utilizzato solo in pochi centri. Per fare finalmente chiarezza nel campo della prognostica, nel 2015 è stato lanciato lo studio PROCLIPI (Prospective Cutaneous Lymphoma International Prognostic Index Study), in cui vengono raccolti continuamente dati e materiali definiti per una biobanca appositamente creata. È prevista una durata dello studio di 10 anni e sono già stati reclutati 1991 pazienti da 19 Paesi.
Oltre a ricercare i fattori prognostici, lo studio PROCLIPI mira anche a valutare le terapie attuali. Dal 2017, tre nuove sostanze sono state approvate nell’Unione Europea per il trattamento dei linfomi cutanei a cellule T: Brentuximab vedotin, Mogamulizumab e Gel di Clormetina. Il primo è disponibile anche in Svizzera. Mentre il gel di clormetina può essere utilizzato per la terapia topica in tutte le fasi della micosi fungoide, il coniugato anticorpo-farmaco brentuximab vedotin e l’anticorpo monoclonale mogamulizumab sono utilizzati per il trattamento dei linfomi cutanei a cellule T ricorrenti.
Anche con questi sviluppi, il trapianto di cellule staminali allogeniche, eseguito dal 1980, rimane l’unica opzione curativa. I miglioramenti nei metodi di deplezione delle cellule T, i regimi meno intensivi e le nuove conoscenze sulla gestione della malattia del trapianto contro l’ospite (GvHD) l’hanno resa più tollerabile. Una revisione pubblicata nel 2019 ha riportato una mortalità a 1 anno del 15% con un tasso di recidiva del 50% [9]. In questo contesto, la Prof.ssa Dr. med. Julia Scarisbrick dell’Ospedale Universitario di Birmingham, in Inghilterra, ha sottolineato che l’uso precoce del trapianto di cellule staminali allogeniche dovrebbe essere sempre più valutato. Infine, una risposta completa a qualsiasi terapia è rara negli stadi avanzati, e i trapianti nei pazienti con malattia residua non si sono dimostrati efficaci. Ha quindi chiesto di valutare il trapianto di cellule staminali nella prima remissione.
Fonte: Simposio SY13 “Linfomi cutanei: quali sono le novità?” del Prof. Dr med. Maarten Vermeer (Leids Universitair Medisch Centrum), Dr med. Egle Ramelyte (Ospedale Universitario di Zurigo) e Prof. Dr med. Julia Scarisbrick (Ospedale Universitario di Birmingham), 15 aprile 2021, 10° Congresso Mondiale del Melanoma/17. Congresso EADO, il congresso si è svolto virtualmente.
Letteratura:
- Ramelyte E, et al.: Risposta antitumorale mediata dalla viroterapia oncolitica: una prospettiva a livello di singola cellula. Cellula del cancro. 2021; 39(3): 394-406. e4.
- Keane C, et al: LAG3: un nuovo checkpoint immunitario espresso da molteplici sottoinsiemi di linfociti nel linfoma diffuso a grandi cellule B. Blood Adv. 2020; 4(7): 1367-77.
- Wang Z, Cook JR: Espressione di IRTA1 e MNDA nel linfoma della zona marginale: utilità nella diagnosi differenziale e implicazioni per la classificazione. Am J Clin Pathol. 2019; 151(3): 337-343.
- Zhou XA, et al: Le analisi genomiche identificano alterazioni ricorrenti nei geni di evasione immunitaria nel linfoma diffuso a grandi cellule B, tipo gamba. J Invest Dermatol. 2018; 138(11): 2365-2376.
- Qu K, et al.: Paesaggio dell’accessibilità cromatinica del linfoma cutaneo a cellule T e risposta dinamica agli inibitori HDAC. Cellula del cancro. 2017; 32(1): 27-41. e4.
- van Doorn R, et al.: L’analisi epigenomica della sindrome di Sézary definisce i modelli di metilazione aberrante del DNA e identifica i marcatori diagnostici . J Invest Dermatol. 2016; 136(9): 1876-1884.
- Scarisbrick JJ, et al: Sviluppi nella comprensione del coinvolgimento del sangue e dello stadio nella micosi fungoide/sindrome di Sezary. Eur J Cancer. 2018; 101: 278-280.
- de Masson A, et al: Il sequenziamento ad alta velocità del gene del recettore delle cellule T β identifica una micosi fungoide aggressiva in fase iniziale. Sci Transl Med. 2018; 10(440).
- Johnson WT, et al: Trapianto allogenico di cellule staminali ematopoietiche nella micosi fungoide in fase avanzata e nella sindrome di Sézary: una revisione concisa. Chin Clin Oncol. 2019; 8(1): 12.
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(3): 28-29 (pubblicato il 15.6.21, prima della stampa).