La malattia del fegato grasso non alcolica è la patologia epatica più diffusa a livello mondiale. La linea guida tedesca S2k, aggiornata nel 2022, raccomanda lo screening dei pazienti a rischio. L’algoritmo di screening proposto include la valutazione della fibrosi e il rilevamento della steatosi come elementi principali ed è ampiamente in linea con le raccomandazioni dell’EASL. I pilastri principali della terapia sono la modifica dello stile di vita e il controllo delle comorbidità.
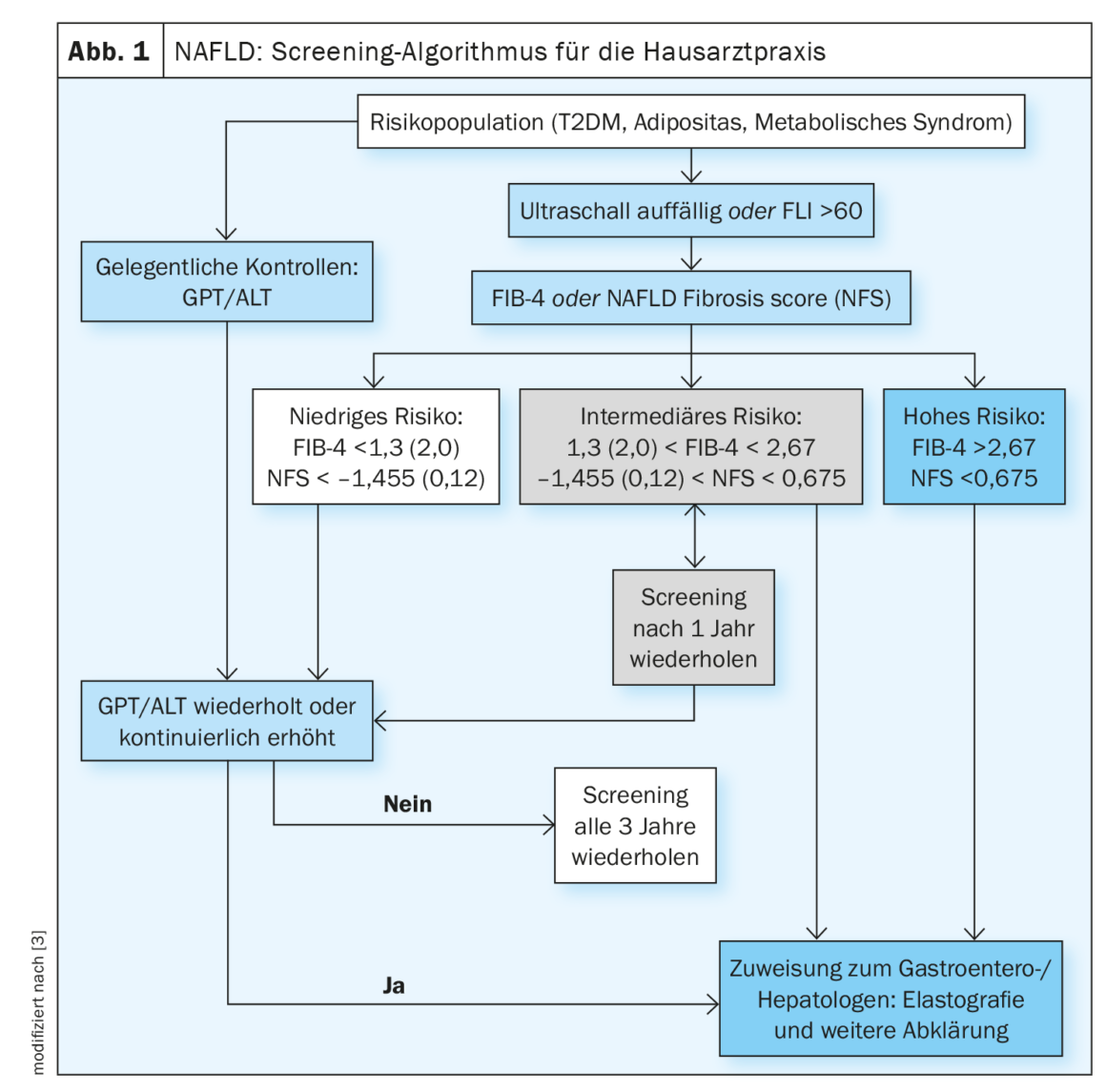
La malattia del fegato grasso non alcolica è una delle principali cause di complicazioni e morte associate al fegato. Un livello di fibrosi elevato è associato a un rischio maggiore di complicazioni. La regressione dal rimodellamento cirrotico è possibile [1]. In uno studio pubblicato nel 2022, è stato dimostrato che il miglioramento della fibrosi epatica riduce il rischio di complicanze di 10 volte (HR, 0,08; 95% CI: 0,02-0,32) [2]. L’algoritmo di screening per la NAFLD proposto per l’assistenza primaria (Fig. 1) comprende punteggi come il quoziente AST/ALT o la FIB-4 [3]. I pazienti che presentano uno o più fattori di rischio per la fibrosi avanzata devono essere sottoposti a screening: Età >45-55 anni, diabete di tipo 2 (T2DM), sindrome metabolica, obesità (IMC >30 kg/m²), ipertensione arteriosa [2,3]. Il T2DM e l’obesità sono fattori di rischio indipendenti per lo sviluppo della fibrosi legata alla NASH [4]. Nei pazienti con sospetta NAFLD, l’ecografia transaddominale è la modalità di imaging principale per lo screening.
A seconda dello stadio della fibrosi, i pazienti con NAFLD presentano un aumento della mortalità legata al fegato e della mortalità per tutte le cause rispetto ai controlli sani [5,6]. Le cause di morte cardiovascolari sono in cima alla lista [7,8].
In un’analisi retrospettiva di 619 pazienti affetti da NAFLD nel periodo 1975-2005 e con un follow-up mediano di 12,6 anni, la malattia cardiovascolare è stata la causa più comune di morte (38%), seguita dalla malattia tumorale non epatica (19%) e dalle complicazioni della cirrosi epatica (8%) [9]. Dati simili provengono da due studi prospettici svedesi con un follow-up fino a 33 anni: cause di morte cardiovascolari 43% e 48%, tumori non epatici 23% e 22%, e mortalità legata al fegato 9% e 10% [10,11].
Screening della progressione della fibrosi nei pazienti ad alto rischio
La linea guida s2k suggerisce di sottoporre a screening i pazienti a rischio ogni 2-3 anni, utilizzando un algoritmo che è in gran parte coerente con quello delle Linee Guida di Pratica Clinica dell’Associazione Europea per lo Studio del Fegato (EASL) e con altre raccomandazioni di consenso per i medici di base e i diabetologi, ma è più semplice da usare (Fig. 1) [3,12]. L’FLI (indice di fegato grasso) può essere utilizzato per determinare in modo non invasivo il contenuto di grasso del fegato. Gli strumenti comunemente utilizzati per la previsione della fibrosi non invasiva sono il FIB-4 e il NAFLD Fibrosis Score (NFS).
Il FIB-4 è facile da calcolare in base ai valori di AST, ALT, piastrine e all’età del paziente. La valutazione si basa su due valori di cut-off: i pazienti con un valore <1,45 haben ein geringes Fibroserisiko, während Patienten mit einem Wert>2,67 hanno un rischio elevato di fibrosi avanzata [13].
Il punteggio di fibrosi della NAFLD (NFS) è facile da calcolare dai valori di laboratorio standard tramite una maschera di input online. Per il calcolo vengono inseriti i seguenti parametri: Età, BMI, diabete sì/no, AST, ALT, piastrine e albumina. Un valore inferiore a -1,455 esclude la fibrosi avanzata con una sensibilità del 90%. Un NFS >0,676 diagnostica la fibrosi avanzata con una specificità del 97% e una sensibilità del 67%.
Poiché entrambi i punteggi si basano in gran parte su parametri di routine, sono adatti all’uso nello screening. Altri punteggi di fibrosi non invasivi, come il rapporto AST/piastrine (APRI) o il punteggioBARD (BMI, rapporto AST/ALT e diabete)mostrano buoni valori predittivi negativi e sono quindi adatti per escludere la fibrosi avanzata.
La sequenza di FLI (Fatty Liver Index) e FIB-4 è stata studiata in una popolazione a rischio di diabetici di tipo 2 per lo screening [14].
L’uso di valori di cut-off aggiustati per l’età può essere utile per ridurre l’alta percentuale di individui testati in modo intermedio. La gestione dei pazienti a rischio intermedio è una questione di discussione e può essere organizzata in modo diverso (re-screening o invio diretto a un epatologo). Gli studi futuri devono dimostrare se nuovi marcatori surrogati (ad esempio NIS4, punteggio FAST) o tecniche di imaging come l’elastografia MR o MR-PDFF possono essere utilizzati per valutare la progressione della fibrosi individuale e il decorso della NASH [15].
I dati del registro NAFLD forniscono risultati interessanti
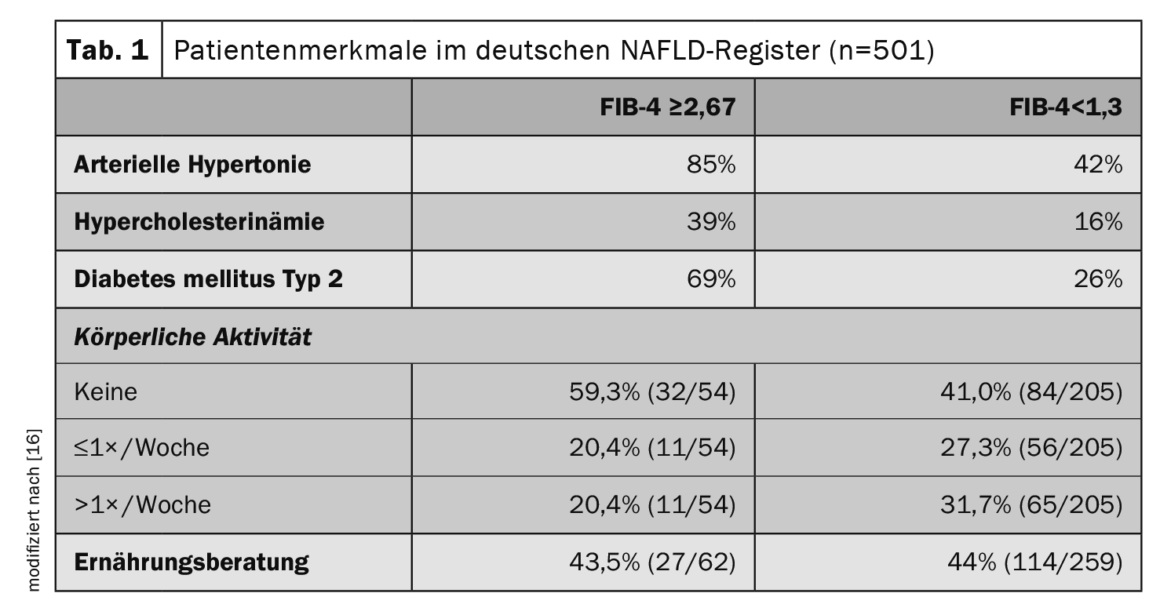
Per saperne di più sui marcatori di rischio e sui fattori prognosticamente significativi associati alla NAFLD, i dati del registro sono informativi. Il Registro tedesco della NAFLD è uno studio prospettico non interventistico della Fondazione tedesca per il fegato per descrivere le caratteristiche cliniche e il decorso della malattia dei pazienti con NAFLD nelle strutture di cura secondarie e terziarie [16]. Su 501 pazienti con NAFLD (età media 54 anni, 48% donne), il 13% era ad alto rischio di fibrosi avanzata (indice FIB-4 ≥2,67) e il 10% aveva una diagnosi clinica di cirrosi. Le statine sono state utilizzate nel 22% della popolazione totale dello studio, mentre tra i diabetici, la metformina, gli agonisti GLP-1 e gli inibitori SGLT2 sono stati utilizzati rispettivamente nel 65%, 17% e 17%. Tra i pazienti con fibrosi avanzata (FIB-4 ≥2,67), l’85% presentava ipertensione arteriosa, il 69% diabete di tipo 2 e il 39% ipercolesterolemia (tab. 1). Il controllo delle comorbidità metaboliche e i cambiamenti dello stile di vita (perdita di peso ed esercizio fisico) sono il pilastro della terapia della NAFLD.
Congresso: Aggiornamento sulla pratica
Letteratura:
- «Leber», Gastroenterologie, Prof. Dr. med. Andreas Stallmach, Praxis Update, Berlin, 28-29.04.2023.
- Sanyal AJ, et al.: Cirrhosis regression is associated with improved clinical outcomes in patients with nonalcoholic steatohepatitis. Hepatology 2022; 75: 1235–1246.
- Roeb E, et al.; Collaborators: Aktualisierte S2k-Leitlinie nicht-alkoholische Fettlebererkrankung der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) – April 2022 – AWMF-Registernummer: 021–025. Z Gastroenterol 2022; 60(9): 1346–1421.
- Jarvis H, et al.: Metabolic risk factors and incident advanced liver disease in non-alcoholic fatty liver disease (NAFLD): A systematic review and meta-analysis of population-based observational studies. PLoS Med 2020; 17: e1003100
- Dulai PS, et al.: Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: Systematic review and meta-analysis. Hepatology 2017; 65: 1557–1565.
- Vilar-Gomez E, et al.: Fibrosis Severity as a Determinant of Cause-Specific Mortality in Patients With Advanced Nonalcoholic Fatty Liver Disease: A Multi-National Cohort Study. Gastroenterology 2018; 155: 443–457.
- Younossi ZM, et al.: Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology 2016; 64: 73–84.
- Kim D, et al.: Association between noninvasive fibrosis markers and mortality among adults with nonalcoholic fatty liver disease in the United States. Hepatology 2013; 57: 1357–1365.
- Angulo P, et al.: Liver Fibrosis, but No Other Histologic Features, Is Associated With Long-term Outcomes of Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 2015; 149: 389-397.e310
- Nasr P, et al.: Natural history of nonalcoholic fatty liver disease: A prospective follow-up study with serial biopsies. Hepatol Commun 2018; 2: 199–210.
- Ekstedt M, et al.: Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up. Hepatology 2015; 61: 1547–1554.
- Berzigotti A, et al.: EASL Clinical Practice Guidelines (Cpgs) On Non-Invasive Tests For Evaluation Of Liver Disease Severity And Prognosis- 2020 Update. J Hepatol 2021; DOI: 10.1016/j.jhep.2021.05.025.
- Kaswala DH, Lai M, Afdhal NH: Fibrosis Assessment in Nonalcoholic Fatty Liver Disease (NAFLD) in 2016. Dig Dis Sci 2016; 61: 1356–1364.
- Ciardullo S, et al.: Screening for non-alcoholic fatty liver disease in type 2 diabetes using non-invasive scores and association with diabetic complications. BMJ Open Diabetes Res Care 2020; 8.
DOI: 10.1136/bmjdrc-2019-000904. - Loomba R, et al.: Multicenter Validation of Association Between Decline in MRI-PDFF and Histologic Response in NASH. Hepatology 2020;
DOI: 10.1002/hep.31121. - Geier A, et al.: Clinical characteristics of patients with nonalcoholic fatty liver disease (NAFLD) in Germany – First data from the German NAFLDRegistry. Zeitschrift für Gastroenterologie 2023; 61: 60–70.
| Immagine di copertina: micrografia della malattia del fegato grasso non alcolica (NAFLD). Masson’s trichrome & Verhoeff stain. Autore: Nephron, wikimedia |
HAUSARZT PRAXIS 2023; 18(7): 28–29