Fattori come il pre-trattamento, l’età, la performance e le comorbidità del paziente determinano la terapia della ricaduta nel mieloma multiplo. Gli standard sono le combinazioni triple con un inibitore del proteasoma e/o un IMID. Anche le terapie con anticorpi svolgono un ruolo importante nel trattamento del mieloma.
Per i pazienti idonei con mieloma multiplo di nuova diagnosi, viene eseguito un trattamento di induzione seguito da una chemioterapia consolidativa ad alte dosi con trapianto di cellule staminali autologhe (ASZT). Per ottenere un buon controllo della malattia per un periodo più lungo possibile, si segue un trattamento di consolidamento e/o una terapia di mantenimento. L’obiettivo terapeutico è una remissione completa, se possibile molecolare. Nei pazienti anziani e/o non in forma, l’obiettivo è ottenere la migliore risposta possibile al trattamento di prima linea, con pochi effetti collaterali e la conservazione della qualità di vita.
Quasi tutti i pazienti soffrono successivamente di una recidiva. In questa situazione, le combinazioni lenalidomide/desametasone (RD) e bortezomib/desametasone (VD) sono state a lungo i trattamenti standard [1–3]. Tuttavia, entrambe le sostanze sono oggi ampiamente utilizzate nel trattamento di prima linea, il che significa che il numero di pazienti refrattari a questi farmaci è in aumento. Da qualche anno sono disponibili molti nuovi farmaci per questi pazienti. La scelta della terapia tiene conto delle terapie precedenti (cambio di classe di sostanze, risposta, tolleranza), dell’età, delle prestazioni, delle comorbidità e, naturalmente, dell’approvazione in Svizzera. Nei pazienti idonei con un periodo libero da progressione di almeno 12 mesi dopo una prima ASCT, si dovrebbe prendere in considerazione una seconda ASCT, poiché i risultati dopo l’ASCT di salvataggio in questi pazienti sono equivalenti o superiori a quelli delle combinazioni di tre farmaci più efficaci, con una durata del trattamento più breve e costi totali mediamente inferiori (Tab. 1) [4,5].
Prima ricaduta dopo la terapia a base di bortezomib
Dopo la terapia di prima linea a base di bortezomib, fino a pochi anni fa veniva suggerito ai pazienti il trattamento con lenalidomide/desametasone [1,2]. Oggi, in seconda linea, con una migliore sopravvivenza libera da progressione (PFS), l’attenzione dovrebbe concentrarsi su una combinazione di tre farmaci.
La combinazione di RD con l’anticorpo monoclonale SLAMF7 (“molecola di attivazione linfocitaria di segnalazione F7”) elotuzumab ha mostrato una PFS mediana di 19,4 mesi (rispetto ai 14,9 mesi con RD) nello studio ELOQUENT-2. Sono stati inclusi 646 pazienti con una media di due terapie precedenti. Il trattamento con ERD è stato continuato fino alla progressione o agli effetti collaterali inaccettabili. Il tasso di risposta globale (ORR) con ERD è stato del 79% (vs. 66%). Il tempo al trattamento successivo (TTNT) è stato prolungato di un anno (33 vs. 21 mesi), la sopravvivenza mediana nel gruppo ERD è stata di 43,7 mesi (vs. 39,6 mesi). Gli effetti collaterali di grado 3 o 4 più comuni sono stati quelli ematologici (neutropenia 34% vs. 44% e linfopenia 77% vs. 49%). I benefici clinici sono stati accompagnati da una maggiore frequenza di infezioni (88% contro 74%), soprattutto da herpes zoster [6,7]. In Svizzera, la combinazione di elotuzumab con lenalidomide e desametasone (ERD) è approvata dalla seconda linea di terapia.
Come ulteriore triplice terapia, la combinazione di lenalidomide/desametasone insieme a carfilzomib, un inibitore del proteasoma di seconda generazione, è approvata dalla seconda linea di terapia. Nello studio ASPIRE, questa combinazione ha mostrato un prolungamento della PFS mediana di 8,7 mesi (26,3 vs. 17,6 mesi) in 792 pazienti rispetto alla sola RD. Carfilzomib con RD (KRD) è stato somministrato per un massimo di 18 cicli, RD fino alla progressione. L’ORR è stato un impressionante 87,1% (vs. 66,7%), con un tasso di CR per KRD del 31,8% (vs. 9,3% nel gruppo RD). La sopravvivenza a 2 anni nel gruppo KRD è stata del 73,3% (vs. 65%). Carfilzomib viene somministrato in questa combinazione fino a un massimo di 27 mg/m2 due volte alla settimana. Il tasso di effetti collaterali, anche per quanto riguarda la neuropatia, è paragonabile. Di particolare interesse sono stati i problemi cardiaci con carfilzomib: dispnea (2,8% vs. 1,8%), insufficienza cardiaca (3,8% vs. 1,8%), cardiopatia ischemica (3,3% vs. 2,1%), ipertensione (4,3% vs. 1,8%) e insufficienza renale acuta (3,3% vs. 3,1%) [8].
Prima ricaduta dopo la terapia basata su IMID
Dopo la terapia di prima linea a base di IMID, la terapia contenente inibitori del proteasoma è raccomandata come terapia di seconda linea. Tradizionalmente, viene utilizzata la combinazione bortezomib/desametasone (VD) [3]. La combinazione di carfilzomib con desametasone (KD) si è dimostrata più efficace nello studio ENDEAVOR. La PFS mediana è stata significativamente più lunga, 18,7 contro 9,4 mesi, rispetto alla VD. Il 54% dei 929 pazienti di questo studio è stato pretrattato con bortezomib, anche se non refrattario. Anche in questi pazienti, la PFS era più lunga con la KD, 15,6 contro 8,1 mesi. Carfilzomib è stato somministrato alla dose di 56 mg/m2 due volte alla settimana. Gli eventi avversi più comuni a questa dose comprendevano l’anemia (14% vs. 10%), l’ipertensione (9% vs. 3%), la trombocitopenia (8% vs. 9%) e la polmonite (7% vs. 8%), mentre il verificarsi di polineuropatie di grado 2 o superiore era significativamente meno frequente con carfilzomib (6% vs. 32%) [9]. Carfilzomib non è autorizzato in Svizzera in questo dosaggio.
Lo standard nella prima ricaduta dovrebbe essere una tripla combinazione, se possibile. Una combinazione piuttosto favorevole è bortezomib/desametasone in combinazione con ciclofosfamide (VCD o CyBorD). Tuttavia, questo trattamento è approvato in Svizzera solo per il trattamento di induzione prima di una ASZT pianificata. Al contrario, il regime KRD, significativamente più costoso, è approvato a partire dalla seconda linea di terapia.
Trattamento di ulteriori recidive
A partire dalla terza linea di terapia (dopo il fallimento di bortezomib e lenalidomide), la combinazione di pomalidomide con desametasone (Pom/D) è approvata in Svizzera [10]. A causa del costo elevato, il dosaggio approvato (4 mg/d) è stato recentemente messo in discussione a favore di un regime alternato (4 mg a giorni alterni), che è potenzialmente significativo in termini di economia sanitaria [11]. Come nel caso di carfilzomib, le questioni relative al dosaggio ottimale nella terapia del mieloma sono state risolte in modo insoddisfacente nel ritmo frenetico del lancio dei prodotti.
Come ulteriore farmaco, l’inibitore dell’istone deacetilasi panobinostat in combinazione con la VD è approvato a partire dalla terza linea. Nello studio PANORAMA-1, 768 pazienti fortemente pretrattati sono stati trattati con panobinostat/VD o panobinostat/VD. Trattamento placebo/VD. Panobinostat viene somministrato per via perorale tre giorni alla settimana nelle settimane 1 e 2 di un ciclo di 21 giorni, in aggiunta alla VD. C’è stato un miglioramento della PFS mediana di quasi quattro mesi (12 vs. 8 mesi) con la stessa sopravvivenza globale. L’ORR con panobinostat/VD è stato del 60,7%, con una risposta completa ottenuta nell’11% dei pazienti e una risposta parziale molto buona nel 17%. Gli effetti collaterali non ematologici più comuni comprendevano diarrea (68% vs. 42%), astenia o affaticamento (57% vs. 41%) e neuropatia periferica (61% vs. 67%). Anche gli effetti collaterali ematologici significativi erano più frequenti con panobinostat [12].
Il primo inibitore del proteasoma disponibile per via orale, ixazomib, è approvato in Svizzera in combinazione con lenalidomide e desametasone dalla terza linea di terapia (o dalla seconda linea di terapia se sono presenti caratteristiche ad alto rischio). Lo studio TOURMALINE-MM1 ha confrontato ixazomib in combinazione con RD rispetto a placebo/RD. La PFS mediana è stata significativamente più lunga nel gruppo ixazomib (20,6 contro 14,7 mesi). La tolleranza ematologica di entrambe le terapie era paragonabile. La neuropatia periferica si è verificata nel 27% dei pazienti (contro il 22%) con ixazomib [13]. Essendo una terapia completamente perorale, questa combinazione è indubbiamente adatta al paziente.
Nei pazienti refrattari ad almeno un inibitore del proteasoma e a un agente immunomodulatore, o che hanno avuto almeno tre terapie precedenti, l’anticorpo monoclonale CD38 daratumumab può essere somministrato anche in Svizzera. Come monoterapia, daratumumab mostra tassi di risposta di circa il 30% [14]. L’anticorpo, che inizialmente viene somministrato settimanalmente, rappresenta una sfida per gli ambulatori di oncologia quando verrà utilizzato in modo più diffuso, data la lunga durata dell’infusione di nove ore per la prima somministrazione (e ancora almeno cinque ore dalla terza somministrazione). Daratumumab è stato approvato di recente anche in seconda linea, in combinazione con desametasone e bortezomib o lenalidomide.
Ulteriori opzioni terapeutiche
Nella letteratura in rapida crescita si trovano numerosi altri regimi terapeutici per il trattamento del mieloma multiplo recidivato.
Nello studio CASTOR, 498 pazienti con una media di due terapie precedenti sono stati randomizzati a daratumumab/VD (Dara/VD) o alla sola VD. In entrambi i bracci di trattamento, la VD è stata interrotta dopo otto cicli ciascuno, mentre daratumumab poteva essere continuato fino alla progressione. Dopo un follow-up mediano di 7,4 mesi, si è registrata una PFS significativamente prolungata nel gruppo daratumumab. L’ORR è stato significativamente più alto nel braccio daratumumab (82,9% vs 63,2%) e, in particolare, i tassi di remissione parziale molto buona o migliore sono stati quasi raddoppiati (59,2% vs 29,1%) [15].
Nello studio POLLUX, 569 pazienti pretrattati con almeno una terapia hanno ricevuto RD o la combinazione con daratumumab. Dopo un follow-up mediano di 13,5 mesi, l’analisi ad interim ha mostrato una PFS prolungata nel gruppo sperimentale (non raggiunta vs. 18,4 mesi). Anche l’ORR è stato più alto nel braccio daratumumab, con il 92,9% (contro il 76,4%), così come il tasso di remissioni complete (43,1% contro il 19,2%) [16]. Il problema principale dell’uso di questo anticorpo sono le reazioni all’infusione e la trombopenia.
Esistono anche dati relativi a combinazioni di Pom/D con una terza sostanza per il mieloma recidivato, ad esempio in combinazione con 400 mg settimanali di ciclofosfamide perorale (PomCyDex) o bortezomib (PVD) [17,18]. Entrambi gli studi includevano pazienti con mieloma refrattario alla lenalidomide. La monoterapia con bendamustina può anche essere utilizzata, soprattutto nei pazienti con insufficienza renale o che richiedono la dialisi [19]. Quest’ultimo non è approvato per questa indicazione in Svizzera.
In due innovativi studi di fase II, l’Associazione Svizzera per la Ricerca Clinica sul Cancro (SAKK) ha testato l’associazione di nelfinavir con VD resp. RD ha indagato. Ciò si è basato sulle osservazioni che questo farmaco contro l’HIV può ripristinare la sensibilità ai due farmaci contro il mieloma. Nello studio SAKK 39/13, è stato raggiunto un promettente ORR del 65% in una popolazione pesantemente pretrattata e spesso refrattaria a bortezomib e lenalidomide [20]. Sono in fase di pianificazione ulteriori studi SAKK con combinazioni di conifinavir.
Prospettiva
I dati finora disponibili sugli inibitori del checkpoint nel mieloma multiplo non sono molto promettenti. Al contrario, dopo l’approvazione da parte della FDA della terapia cellulare CAR-T per i giovani pazienti con ALL recidivato o refrattario, questa opzione terapeutica è diventata oggetto di interesse anche per i pazienti affetti da mieloma. Ciò si basa sui dati dei primi studi clinici condotti su pazienti affetti da mieloma con cellule BCMA-CAR-T (“antigene di maturazione delle cellule B”), con tassi di remissione intorno al 100% [21–23].
Sono stati compiuti progressi senza precedenti nella terapia del mieloma. Se 15 anni fa il tempo medio di sopravvivenza era ancora di due o tre anni, oggi un buon 40% dei pazienti affetti da mieloma vive dieci anni o più. Tuttavia, questo miglioramento si è riflesso anche sui costi del trattamento (tab. 1) . Quest’ultimo aspetto dovrebbe essere preso in considerazione dai vari attori del sistema sanitario, soprattutto perché i nuovi farmaci molto costosi avanzano in prima linea. Per restare all’esempio di daratumumab, questo aumenterà anche la pressione organizzativa, infrastrutturale e di personale sugli ambulatori e sulle cliniche oncologiche, solo a causa della lunga durata dell’infusione (Tab. 2). L’applicazione sottocutanea di questo anticorpo allevierebbe il problema [24].
Oltre all’efficacia, il trattamento delle malattie non curabili deve innanzitutto migliorare la qualità della vita. Per i nuovi farmaci, questi dati sono ancora mancanti, oppure la qualità della vita era solo un endpoint secondario [25].
In sintesi, i pazienti affetti da mieloma hanno oggi a disposizione una serie di nuove opzioni terapeutiche. Se possibile, i pazienti devono essere inclusi negli studi (ad esempio, il SAKK). Sarebbe auspicabile che i protocolli esaminassero sempre più spesso anche le sequenze terapeutiche e la qualità della vita.
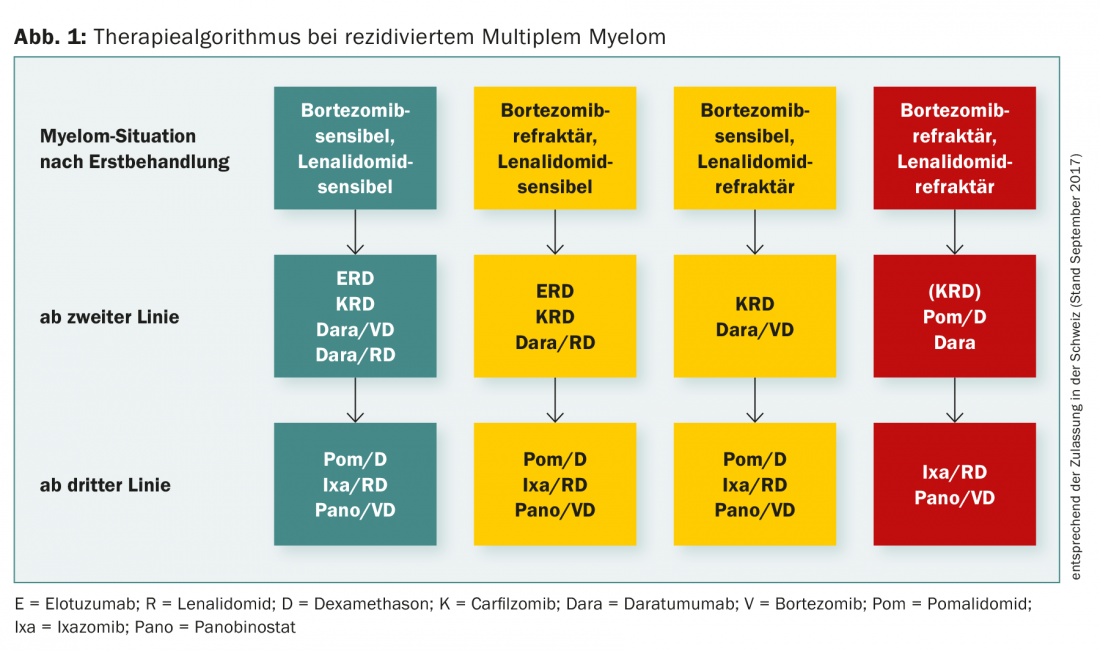
La Figura 1 riassume l’algoritmo di trattamento del mieloma multiplo recidivato.
Messaggi da portare a casa
- La scelta della terapia delle ricadute dipende dal pre-trattamento (classe di sostanze, risposta e tolleranza), dall’età, dal rendimento e dalle comorbidità dei pazienti, nonché dall’approvazione dei farmaci.
- Lo standard nel trattamento delle recidive sono le combinazioni triple con un inibitore del proteasoma e/o un IMID, a seconda del pre-trattamento.
- Le terapie anticorpali svolgono un ruolo importante nel trattamento del mieloma.
- I pazienti affetti da mieloma dovrebbero sempre essere trattati in protocolli (ad esempio SAKK), se possibile.
- La terapia con cellule CAR T potrebbe diventare un’opzione promettente nel mieloma.
Letteratura:
- Weber DM, et al: Lenalidomide più desametasone per il mieloma multiplo recidivato in Nord America. N Engl J Med 2007; 357(21): 2133-2142.
- Dimopoulos M, et al: Lenalidomide più desametasone per il mieloma multiplo recidivato o refrattario. N Engl J Med 2007; 357(21): 2123-2132.
- Richardson PG, et al: Bortezomib o desametasone ad alte dosi per il mieloma multiplo recidivato. N Engl J Med 2005; 352(24): 2487-2498.
- Grovdal M, et al.: Trapianto autologo di cellule staminali rispetto ai nuovi farmaci o alla chemioterapia convenzionale per i pazienti con mieloma multiplo recidivato dopo un precedente ASCT. Trapianto di midollo osseo 2015; 50(6): 808-812.
- Giralt S, et al.: Società Americana di Trapianto di Sangue e Midollo, Società Europea di Trapianto di Sangue e Midollo, Rete di Studi Clinici sul Trapianto di Sangue e Midollo e Gruppo di Lavoro Internazionale sul Mieloma Conferenza di Consenso sul Trapianto di Cellule Ematopoietiche di Salvataggio in Pazienti con Mieloma Multiplo Recidivato. Biol Blood Marrow Transplant 2015; 21(12): 2039-2051.
- Dimopoulos MA, et al: Elotuzumab più lenalidomide/desametasone per il mieloma multiplo recidivato o refrattario: follow-up ELOQUENT-2 e analisi post-hoc sulla sopravvivenza libera da progressione e sulla crescita tumorale. Br J Haematol 2017; 178(6): 896-905.
- Lonial S, et al: Terapia con elotuzumab per il mieloma multiplo recidivato o refrattario. N Engl J Med 2015; 373(7): 621-631.
- Stewart AK, et al: Carfilzomib, lenalidomide e desametasone per il mieloma multiplo recidivato. N Engl J Med 2015; 372(2): 142-152.
- Dimopoulos MA, et al: Carfilzomib e desametasone rispetto a bortezomib e desametasone per i pazienti con mieloma multiplo recidivato o refrattario (ENDEAVOR): uno studio multicentrico randomizzato, di fase 3, in aperto. Lancet Oncol 2016; 17(1): 27-38.
- Dimopoulos MA, et al: Sicurezza ed efficacia di pomalidomide più desametasone a basso dosaggio in STRATUS (MM-010): uno studio di fase 3b nel mieloma multiplo refrattario. Sangue 2016; 128(4): 497-503.
- Zander T, et al.: Riflettori puntati sulla pomalidomide: meno è meglio? Leucemia 2017; 31(9): 1987-1989.
- San-Miguel JF, et al: Panobinostat più bortezomib e desametasone rispetto a placebo più bortezomib e desametasone nei pazienti con mieloma multiplo recidivato o recidivato e refrattario: studio multicentrico, randomizzato, in doppio cieco di fase 3. Lancet Oncol 2014; 15(11): 1195-1206.
- Moreau P, et al: Ixazomib orale, lenalidomide e desametasone per il mieloma multiplo. N Engl J Med 2016; 374(17): 1621-1634.
- Usmani SZ, et al: Efficacia clinica della monoterapia con daratumumab nei pazienti con mieloma multiplo recidivato o refrattario pesantemente pretrattati. Sangue 2016; 128(1): 37-44.
- Palumbo A, et al: Daratumumab, Bortezomib e Desametasone per il mieloma multiplo. N Engl J Med 2016; 375(8): 754-766.
- Dimopoulos MA, et al: Daratumumab, lenalidomide e desametasone per il mieloma multiplo. N Engl J Med 2016; 375(14): 1319-1331.
- Baz RC, et al: Studio multicentrico randomizzato di fase 2 su pomalidomide, ciclofosfamide e desametasone nel mieloma refrattario recidivato. Sangue 2016; 127(21): 2561-2568.
- Paludo J, et al: Pomalidomide, bortezomib e desametasone per i pazienti con mieloma multiplo recidivato e refrattario alla lenalidomide. Sangue 2017; 130(10): 1198-1204.
- Hoy SM: Bendamustina: una revisione del suo utilizzo nella gestione della leucemia linfatica cronica, del linfoma non-Hodgkin indolente refrattario al rituximab e del mieloma multiplo. Farmaci 2012; 72(14): 1929-1950.
- Driessen C, et al: L’inibitore della proteasi dell’HIV Nelfinavir in combinazione con Bortezomib e Desametasone (NVd) ha un’eccellente attività nei pazienti con mieloma multiplo avanzato, refrattario agli inibitori del proteasoma: uno studio multicentrico di fase II (SAKK 39/13). Blood 2016; 128: Abstract 487.
- Ali SA, et al: Le cellule T che esprimono un recettore chimerico dell’antigene di maturazione delle cellule B causano remissioni del mieloma multiplo. Sangue 2016; 128(13): 1688-1700.
- Berdeja J, et al: Studio multicentrico first-in-human della terapia con cellule T CAR anti-BCMA bb2121 per il mieloma multiplo recidivato/refrattario: risultati aggiornati. J Clin Oncol 2017; 35(15 suppl): 3010.
- Fan F, et al: Remissioni durature con cellule T modificate con recettori chimerici dell’antigene (CAR) specifici per il BCMA in pazienti con mieloma multiplo refrattario/recidivato. J Clin Oncol 2017; 35(18 suppl): 3001.
- Usmani S, et al: Studio di fase 1b, multicentrico, di escalation della dose, in aperto, per valutare la somministrazione sottocutanea di daratumumab in pazienti (pts) con mieloma multiplo recidivato o refrattario (PAVO). Blood 2016; 128: Abstract 1149.
- Kvam AK, Waage A: Qualità di vita correlata alla salute nei pazienti con mieloma multiplo: è importante? Haematologica 2015; 100(6): 704-705.
InFo ONcOLOGIA & EMATOLOGIA 2017; 5(5): 16-20