Il trapianto di polmone (Lutx) è anche un’opzione terapeutica consolidata nell’infanzia e nell’adolescenza quando, nonostante l’esaurimento di tutte le misure terapeutiche disponibili, una malattia grave progredisce, la qualità della vita è significativamente compromessa di conseguenza e l’insufficienza terminale dell’organo sembra probabile nel prossimo futuro. Tuttavia, la lutx è un intervento significativo sull’integrità fisica del bambino, con molti rischi.
Il trapianto di polmone (Lutx) è anche un’opzione terapeutica consolidata nell’infanzia e nell’adolescenza quando, nonostante l’esaurimento di tutte le misure terapeutiche disponibili, una malattia grave progredisce, la qualità della vita è significativamente compromessa di conseguenza e l’insufficienza terminale dell’organo sembra probabile nel prossimo futuro.

L’obiettivo primario di prolungare la vita delle persone colpite e di migliorare la loro qualità di vita viene raggiunto nella maggior parte dei casi. [1,2] (Fig. 1 e 2). Tuttavia, la lutx rappresenta un intervento significativo sull’integrità fisica del bambino, con molti rischi, complicazioni potenzialmente gravi e la necessità di una terapia farmacologica a vita con molteplici effetti collaterali potenziali. Questo a sua volta ha notevoli effetti sociali e psicologici sul bambino o sull’adolescente in crescita, ma anche sull’ambiente familiare. Il tipo e l’estensione sono variabili e dipendono da molti fattori, come la malattia di base, le comorbidità aggiuntive, l’età, l’ambiente sociale e la stabilità psicologica delle persone colpite. Per questo motivo, a mio avviso, una lutx è una possibile opzione di trattamento, ma non una conclusione terapeutica obbligatoria per i bambini con malattia potenzialmente letale. La decisione consapevole di non sottoporsi a un trapianto non significa rinunciare al bambino, né è un segno di debolezza o di mancanza di cura, ma può addirittura essere una decisione migliore per alcuni e forse salvarli da una sofferenza inutile.
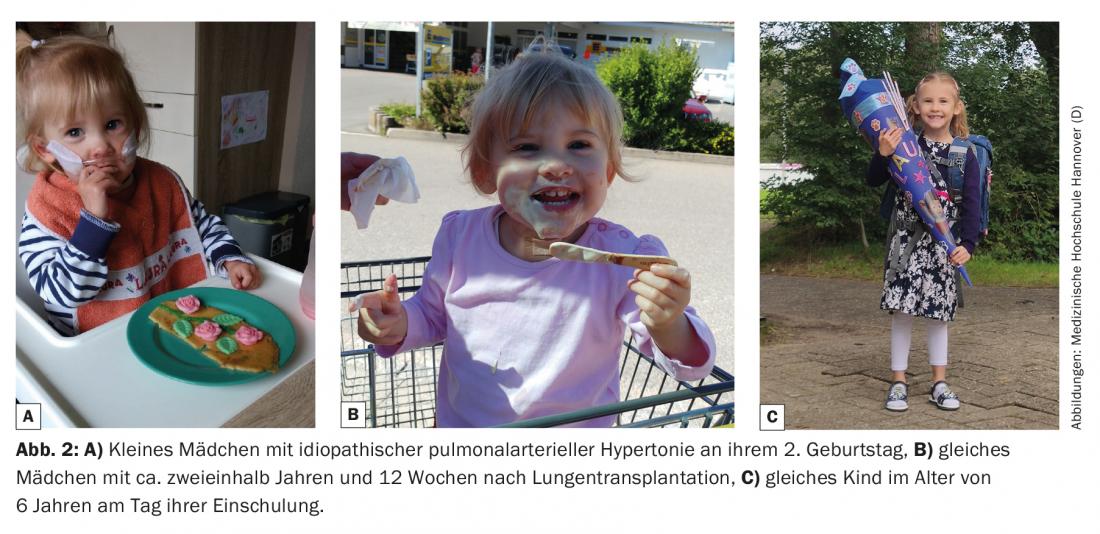
Per poter prendere questa seria decisione, a favore o contro un trapianto, è indispensabile una spiegazione dettagliata e onesta del paziente e dei tutori legali, tenendo conto delle circostanze mediche e sociali individuali. In particolare, è importante non solo accettare il desiderio del bambino (che non sempre corrisponde a quello dei genitori), a condizione che il bambino abbia l’età per prendere decisioni, ma anche sostenerlo attivamente.
È difficile per me scrivere della crescita dopo il trapianto di polmone nell’infanzia e nell’adolescenza in generale. Per questo motivo, ho deciso di fornire innanzitutto una panoramica degli aspetti medici importanti della luttazione nell’infanzia e nell’adolescenza, per poi affrontare alcune caratteristiche speciali e sfide selezionate a seconda della fase della vita.
Trapianto di polmone nei bambini e negli adolescenti
I trapianti di polmone vengono eseguiti su 120-140 bambini ogni anno in circa 40 centri in tutto il mondo. La maggior parte dei centri esegue meno di 5 trapianti all’anno e meno di 5 centri segnalano 10 o più trapianti all’anno al Registro Internazionale dei Trapianti di Organi Toracici della Società Internazionale per il Trapianto di Cuore e Polmone (ISHLT) [3]. Il numero di trapianti combinati cuore-polmoni è diminuito costantemente negli ultimi 20 anni e ora è indicato solo in casi eccezionali. L’età media al momento del trapianto è tra i 12-15 anni e la fibrosi cistica (FC) è ancora l’indicazione più comune, circa il 60%, seguita dall’ipertensione arteriosa polmonare (PAH) [4]. Tuttavia, si può ipotizzare che la percentuale di pazienti pediatrici affetti da FC con malattia polmonare terminale diminuirà costantemente nei prossimi anni, grazie alla diagnosi precoce e alla terapia specifica attraverso uno screening neonatale completo e alla disponibilità di modulatori FC altamente efficienti. D’altra parte, il numero di bambini più piccoli con gravi malattie polmonari diffuse, come le disfunzioni del surfattante, è destinato ad aumentare, soprattutto grazie alle opzioni di terapia medica intensiva sempre più migliorate.
La determinazione di quando inserire il listino dipende in gran parte dalla gravità e dalla progressione della malattia di base. Criteri decisionali importanti per l’inserimento nell’elenco dei pazienti con FC sono FEV1 inferiore a <30% del target, declino rapido e inarrestabile della funzione polmonare, ripetute esacerbazioni infettive pericolose per la vita, emottisi grave ricorrente o insufficienza ipercapnica polmonare cronica [5,6]. Per altre condizioni, mancano criteri decisionali validati per i bambini e soprattutto per i pazienti con ipertensione arteriosa polmonare ereditaria o idiopatica (PAH), la valutazione della prognosi è molto difficile a causa delle opzioni terapeutiche sempre migliori. Spesso i pazienti vengono presentati al centro trapianti troppo tardi, per cui non è più possibile effettuare una valutazione e un’educazione sufficienti, oppure non possono nemmeno essere inseriti in lista a causa delle loro condizioni critiche (ad esempio, ventilati e/o sottoposti a ECMO). Pertanto, ogni paziente con malattia polmonare grave, cronica e progressiva dovrebbe essere valutato precocemente in un centro [5]. Quando si decide di entrare in lista, bisogna considerare anche un lungo periodo di attesa. Il tempo medio di attesa per i pazienti pediatrici ad Hannover è di circa 3,5 mesi. Le procedure di trapianto variano a seconda del centro. Ad Hannover, si predilige il trapianto bilaterale sequenziale di polmone doppio con una tecnica minimamente invasiva tramite toracotomia anterolaterale, se possibile senza procedure di sostituzione extracorporea del polmone come l’ECMO o la macchina cuore-polmone. I pazienti con PAH rappresentano un’eccezione in questo caso. In questo caso, il ventricolo destro viene sempre alleggerito intraoperatoriamente mediante ECMO veno-arterioso o (ad esempio nei neonati) con una macchina cuore-polmone. Poiché l’ipotrofia muscolare del ventricolo sinistro si sviluppa in tutti i pazienti con PAH grave, lo scompenso del ventricolo sinistro dovuto al carico di volume con la corrispondente contropressione venosa polmonare e il conseguente edema polmonare è molto comune dopo il trapianto. Questo a sua volta è associato a un lungo tempo di ventilazione e a molte complicazioni, come il barotrauma, la sedazione a lungo termine, l’immobilizzazione e le infezioni [7]. Per questo motivo, alcuni centri continuano a preferire il trapianto combinato cuore-polmone per i pazienti con PAH grave. Ad Hannover, su questo gruppo di pazienti vengono eseguiti solo trapianti polmonari isolati. Dopo il trapianto, tuttavia, la va-ECMO viene sempre lasciata in funzione per scaricare il ventricolo sinistro ed evitare il carico di volume. Di solito i pazienti possono essere estubati con questa procedura dopo poco tempo e il ventricolo sinistro può essere ‘addestrato’ nei giorni successivi riducendo progressivamente il flusso ECMO sotto controllo ecocardiografico e misurazione della pressione atriale sinistra, fino a quando l’ECMO può essere espiantato dopo una media di 7 giorni. Nel nostro centro, questa procedura ha portato a una riduzione significativa dei tempi di ventilazione, a una riduzione della disfunzione primaria dell’innesto e a una riduzione significativa della mortalità [1,8]. Anche se un vantaggio in termini di sopravvivenza attraverso la terapia di induzione, ad esempio con la globulina policlonale antitimocita o gli antagonisti monoclonali del recettore dell’IL-2, non è stato ancora dimostrato in studi randomizzati e controllati, questa viene ora effettuata nella maggior parte dei centri [3].
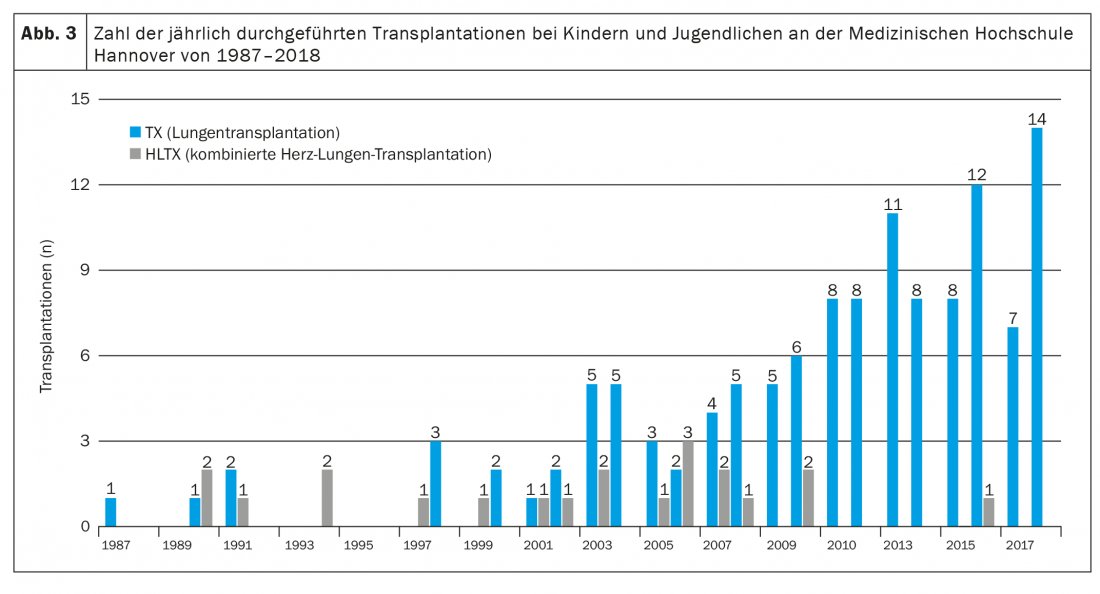
La terapia immunosoppressiva a lungo termine consiste in un inibitore della calcineurina, un inibitore del ciclo cellulare e un glucocorticosteroide, di solito sotto forma di tacrolimus, micofenolato mofetile e prednisolone [3,4,9]. Inoltre, tutti i pazienti (ad Hannover) ricevono ganciclovir o valganciclovir per prevenire l’infezione da CMV, itraconazolo o voriconazolo per prevenire l’infezione fungina e cotrimoxazolo per prevenire l’infezione da Pneumocystis jiroveccii, almeno nei primi mesi dopo il trapianto. Inoltre, gli effetti collaterali dovuti alla terapia immunosoppressiva, come l’ipertensione arteriosa, l’ipercolesterolemia, il diabete mellito (soprattutto nei pazienti con FC) e l’insufficienza renale, spesso si manifestano molto presto e devono essere trattati con farmaci [4]. A causa dell’immunosoppressione intensiva necessaria nei primi 12 mesi dopo il trapianto, le infezioni sono la causa più comune di morte nel primo anno post-operatorio [9]. Le gravi conseguenze a lungo termine (entro i primi 5 anni dopo Lutx) della terapia immunosoppressiva comprendono, in particolare, l’insufficienza renale grave (nel 6% circa), il diabete mellito (nel 30% circa) e i tumori maligni (nel 10% circa) [3,4,9]. Mentre i tumori della pelle sono l’entità maligna più comune negli adulti, i pazienti pediatrici sviluppano prevalentemente linfomi associati all’EBV. La causa più comune di morte oltre il primo anno dopo il trapianto, anche nei bambini, è la disfunzione cronica dell’allotrapianto, di solito sotto forma di sindrome da bronchiolite obliterante (BOS) [10]. 5 anni dopo il trapianto, circa il 50% dei pazienti ne è affetto [4]. Rispetto ad altri trapianti di organi solidi, i pazienti dopo il Lutx continuano ad avere la prognosi più sfavorevole. La sopravvivenza mediana dopo Lutx di tutti i pazienti pediatrici riportati nel registro ISHLT dal 1992 al 2017 è stata di 5,7 anni ed è aumentata a 6,4 anni negli anni più recenti (2002-2009) [4]. Ciò è dovuto principalmente al miglioramento delle opzioni di trattamento perioperatorio, con una riduzione della mortalità precoce. Tuttavia, la prognosi varia notevolmente tra i diversi centri e sembra dipendere in particolare dalle dimensioni e quindi dall’esperienza di un programma di trapianto [11]. Con 8-14 trapianti all’anno, l’Ospedale Pediatrico della Scuola di Medicina di Hannover è uno dei maggiori centri di trapianto polmonare pediatrico al mondo (Fig. 3) . In questo caso, la sopravvivenza a 5 anni è aumentata negli ultimi anni, con un aumento del numero di pazienti annuali, dal 41% (periodo di trapianto 1987-2008) a oltre l’80% (periodo di trapianto 2014-2018) [1,12].
Uno dei motivi principali della prognosi sfavorevole rispetto ad altri trapianti di organi solidi è probabilmente l’esposizione significativamente più elevata del polmone all’ambiente, con una conseguente stimolazione costante del sistema immunitario. Per esempio, le infezioni acute o croniche del tratto respiratorio inferiore sono un fattore di rischio per il rigetto cronico del trapianto dopo il trapianto di polmone.
I fatti di cui sopra chiariscono la complessità, le difficoltà e gli stress straordinari di una lutx per i bambini, gli adolescenti e i loro familiari e suggeriscono l’impatto che ha sulla vita di un bambino in crescita.
Aspetti specifici per i neonati e i bambini piccoli
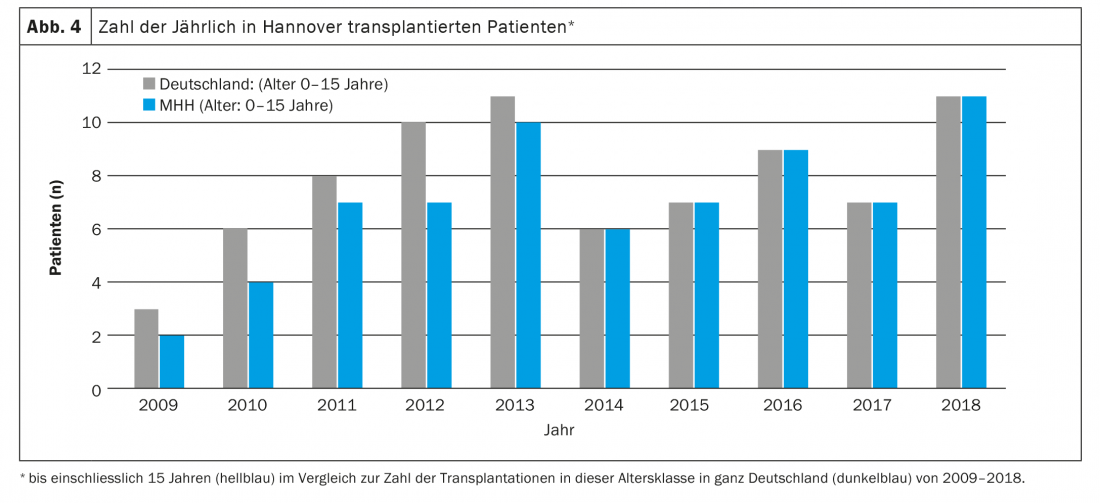
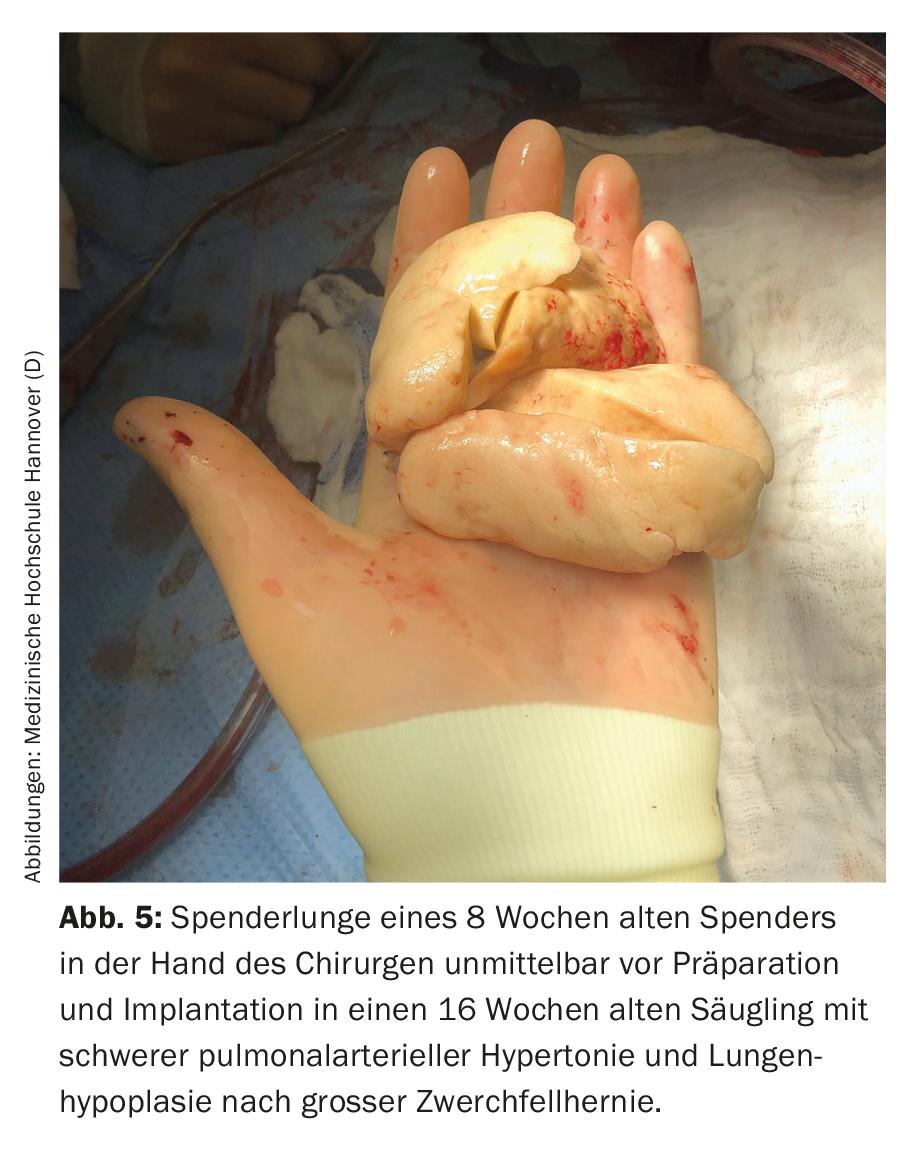
Le principali indicazioni per il trapianto di polmone in questa fascia di età sono la malattia polmonare parenchimale diffusa e la PAH. I genitori e il personale medico devono affrontare sfide importanti già prima del trapianto. Nella maggior parte dei casi, i bambini si trovano in condizioni di pericolo di vita acuto, spesso devono essere ventilati, non di rado sono completamente immobilizzati e devono aspettarsi lunghi tempi di attesa (di degenza) a causa della scarsità di organi disponibili. Oltre alla pressione psicologica sui genitori, i lunghi tempi di attesa sono associati anche a evidenti problemi organizzativi e sono molto stressanti per gli eventuali fratelli sani presenti. Spesso un genitore, nella maggior parte dei casi la madre, non può essere a casa per settimane o mesi, perché una persona deve occuparsi del bambino malato nella clinica, che quasi mai si trova nella città di origine della famiglia. In Germania, ad esempio, quasi tutti i bambini di età inferiore ai 16 anni sono stati trapiantati presso la Scuola di Medicina di Hannover negli ultimi anni e solo pochi di loro vivono in Bassa Sassonia o addirittura ad Hannover (Fig. 4) . Le conseguenze che ne derivano sono probabilmente difficilmente immaginabili per noi come personale medico. A causa delle cattive condizioni prima del trapianto, della mancanza di riserve fisiche, della giovane età e delle difficili procedure chirurgiche (Fig. 5) e di terapia intensiva associate, il rischio di complicazioni pre e post-operatorie è elevato. A causa della loro età, i bambini spesso non sono in grado di esprimere i loro desideri e le loro paure, anche quando sono coscienti. I genitori sono combattuti tra la paura per la vita del loro bambino e la preoccupazione che il trapianto non venga nemmeno realizzato o che il bambino muoia dopo il trapianto e debba sopportare un duro calvario fino ad allora. A causa dell’esiguo numero totale di pazienti trapiantati a questa età, non è possibile ottenere informazioni concrete e affidabili sulla prognosi. Trattare con i bambini e i loro genitori e condurre le conversazioni richiede quindi un alto grado di empatia, onestà, conoscenza della natura umana e soprattutto tempo.
Noi medici non siamo preparati a tali scenari durante gli studi e quindi dipendiamo imperativamente dal supporto di psicologi, psicoterapeuti e personale infermieristico, tra gli altri. Un altro problema è rappresentato dalle risorse di tempo in costante diminuzione a causa della crescente pressione pecuniaria per ottenere risultati, dalla evidente carenza di personale e dal continuo aumento dei compiti burocratici del personale medico. Inoltre, almeno in Germania, vengono tagliati sempre più posti non medici. Allo stesso tempo, le professioni che semplicemente non “pagano” nella società ospedaliera orientata alle prestazioni, come gli arteterapeuti, i musicoterapeuti, gli psicoterapeuti, i fisioterapisti o i clown della clinica, sono per molti versi molto più importanti per i bambini e i loro genitori rispetto ai medici e contribuiscono in modo significativo al benessere dei pazienti e quindi al successo di un trapianto. In questo caso, un ripensamento da parte delle istituzioni sarebbe non solo auspicabile, ma a mio avviso anche imperativo. Purtroppo, l’efficienza del lavoro dei gruppi professionali sopra citati non può essere dimostrata sulla base di studi controllati. Il calcolo del fabbisogno di personale sulla base di dati solidi è quindi un problema importante della “medicina basata sull’evidenza” e non ha senso in aree marginali come la medicina dei trapianti pediatrici. I genitori spesso trovano molto utili le conversazioni con altre famiglie il cui figlio è stato trapiantato a un’età simile, con un’indicazione uguale o simile. Pertanto, offriamo sempre dei riferimenti a queste famiglie nel processo decisionale. Ma anche il periodo successivo al trapianto rappresenta una sfida speciale in questa fascia d’età. Da un lato, a causa del ristretto range terapeutico e dei molteplici effetti collaterali degli immunosoppressori, sono necessari esami del sangue ravvicinati, che sono stressanti per il bambino. Inizialmente tutti i giorni, poi settimanalmente e successivamente a intervalli di 4 settimane. L’esame più importante per la diagnosi precoce della disfunzione dell’organo è la funzione polmonare misurata quotidianamente (a casa). Tuttavia, questo non è ancora possibile con i neonati e i bambini piccoli. Altri test di controllo come la frequenza respiratoria e la saturazione di ossigeno sono le uniche (scarse) alternative in questo caso. A causa dell’elevato rischio di infezione, i bambini non possono frequentare l’asilo. Questo, a sua volta, ha conseguenze psicosociali significative per il bambino e rappresenta un peso per la famiglia, soprattutto se il bambino viene cresciuto da un solo genitore.
Spesso non esiste una protezione vaccinale completa al momento del trapianto e la risposta vaccinale sotto immunosoppressione è notevolmente limitata. Inoltre, i vaccini vivi sono controindicati nei bambini dopo Lutx. Questo a sua volta aumenta il rischio di infezione e richiede speciali misure preventive. Ciò che dobbiamo soffrire dolorosamente in termini di restrizioni nel contesto della pandemia di SARS-CoV-2 è sempre stato e continua ad essere la normalità vissuta, soprattutto per i bambini piccoli, secondo Lutx. Spesso, a causa delle circostanze sopra citate, le famiglie si trovano in difficoltà finanziarie e hanno quindi bisogno di un sostegno supplementare. Fortunatamente, siamo riusciti a dimostrare che la sopravvivenza dei neonati trapiantati nel nostro centro non è comunque peggiore rispetto agli adolescenti, ma tende ad essere addirittura migliore [1]. Oltre a una possibile maggiore plasticità del sistema immunitario, con un tasso inferiore di rigetti acuti e cronici (nonostante l’immunosoppressione più bassa), questo si spiega, a mio avviso, soprattutto con un’aderenza alla terapia significativamente migliore (i genitori somministrano ancora i farmaci da soli a questa età) rispetto agli adolescenti. Tuttavia, la prognosi lusinghiera, con una percentuale di sopravvivenza a 5 anni superiore all’80% [1], porta con sé anche nuove sfide e obblighi, ossia la prevenzione di danni iatrogeni a lungo termine, laddove possibile. Pertanto, la necessità di ogni singolo farmaco, di ogni esame invasivo e di ogni diagnosi di imaging con esposizione alle radiazioni o con sedazione/anestesia necessaria deve essere sempre messa in discussione in modo critico. Inoltre, gli studi controllati sull’efficacia e la sicurezza dei farmaci utilizzati nei bambini trapiantati di polmone sarebbero estremamente importanti, ma purtroppo non sono disponibili a causa del numero ridotto di pazienti, della mancanza di interesse da parte dell’industria farmaceutica e della mancanza di finanziamenti pubblici.
Aspetti specifici per i bambini in età prescolare e scolare
Molto di ciò che è stato detto in precedenza sui neonati e sui bambini si applica anche ai bambini in età prescolare e scolare, pertanto non viene spiegato di nuovo. Tuttavia, la FC è l’indicazione più comune in questo gruppo di età. A differenza dei neonati e dei bambini, i bambini più grandi raramente si trovano in una condizione di pericolo di vita al momento dell’inserimento nell’elenco, il che consente di avere più tempo per la discussione e la valutazione adeguata. Inoltre, i bambini possono quasi sempre aspettare un organo da donatore a casa, se sono in lista. Tuttavia, a questa età è importante coinvolgere attivamente i bambini nelle discussioni educative, rispondere alle loro domande in modo sufficiente e comprensibile e, in particolare, prendere molto sul serio i loro desideri e le loro paure. In base alla mia esperienza personale, so che anche i bambini più piccoli possono affrontare molto meglio le complicazioni e gli esami o i trattamenti spiacevoli dopo il trapianto di polmone, se sono stati adeguatamente preparati ad affrontarli prima del trapianto. Molto spesso ho la sensazione, durante i colloqui educativi, che i bambini non possano o non vogliano verbalizzare le loro paure e preoccupazioni e che, come gli adolescenti, vogliano essere “forti” per i loro genitori. Per questo motivo, l’accompagnamento psicologico e l’arteterapia sono ancora più importanti per questi bambini, oltre ai colloqui educativi. Con colori, forme e immagini, spesso esprimono pensieri, paure, aspettative e speranze molto meglio di quanto potrebbero fare a parole (Fig. 6) . Inoltre, la terapia pittorica ha chiaramente un effetto terapeutico rilevante. Di norma, i bambini possono frequentare la scuola 6 mesi dopo il trapianto e, a parte la somministrazione regolare di farmaci e i controlli di follow-up, non ci sono quasi altre restrizioni nella loro vita quotidiana.

Aspetti specifici con gli adolescenti
I pazienti adolescenti sono già in grado di comprendere l’importanza del trapianto di polmone, con tutti i potenziali vantaggi e svantaggi, e dovrebbero quindi essere gli interlocutori principali nelle discussioni educative. La loro decisione, che sia favorevole o contraria a un trapianto, è innanzitutto autorevole e deve quindi essere accettata. Spesso, gli adolescenti hanno già un lungo percorso di sofferenza alle spalle e non hanno potuto vivere un’infanzia spensierata come i loro coetanei sani. Per questo motivo, le loro aspettative di un trapianto di polmone sono molto alte. Tuttavia, spesso non possono essere soddisfatte nella loro interezza. In questa sede è quindi importante comunicare che, sebbene il trapianto rappresenti un’opportunità concreta per una vita più lunga e migliore, dopo non si è più in salute e che l’assunzione regolare di farmaci, i controlli quotidiani e l’evitare comportamenti potenzialmente dannosi come il consumo eccessivo di alcol o il fumo sono estremamente importanti e quindi un requisito fondamentale per l’inserimento nella lista d’attesa. Le ragazze devono essere informate che non dovrebbero avere figli in seguito, a causa degli effetti collaterali teratogeni potenzialmente gravi degli immunosoppressori, e deve essere assicurata una consulenza ginecologica dettagliata sulla contraccezione.
A mio parere, la cura degli adolescenti dopo il trapianto di polmone è spesso molto più difficile rispetto ai bambini più piccoli. Il problema principale, e a mio avviso la causa più comune di morte in questo gruppo di età, è la mancanza di aderenza al trattamento. A volte gli adolescenti investono più tempo a “coprire” le misure terapeutiche e/o i controlli non eseguiti che a eseguirli in modo coerente. Intuitivamente, questo scatena regolarmente in me rabbia e frustrazione (Fig. 7) . Ma queste reazioni non aiutano le persone interessate e rendono le cose inadeguatamente facili per loro stessi, trasferendo la responsabilità. Tutti noi che abbiamo figli di questa età sappiamo quanto sia difficile, ma anche importante, la fase dell’adolescenza. È caratterizzata da conflitti di identificazione, dal desiderio di autonomia e autodeterminazione e dal rifiuto interiore dei consigli o degli ordini degli adulti. I divieti, le minacce e i comandamenti tendono a incitare le persone a fare il contrario. Almeno questo è stato il caso per me durante questo periodo. Inoltre, c’è anche la pressione sociale del gruppo dei pari e il desiderio di “appartenere”, anche quando si tratta di testare i limiti e le cose proibite. Il modo in cui i giovani affrontano questo, ovviamente, dipende anche in larga misura dal sostegno e dall’integrità dell’ambiente sociale. È quindi nostro compito comunicare bene questi temi nel contesto dell’educazione, costruire un rapporto di fiducia e, con l’aiuto dei genitori, degli psicologi e degli assistenti sociali, identificare i punti di conflitto il più precocemente possibile e trovare soluzioni personalizzate a livello di occhi con i pazienti adolescenti.

Infine, vorrei affrontare l’importante questione della transizione. I giovani devono essere preparati in modo intensivo per il periodo come paziente “adulto”, al più tardi a partire dai 16 anni. A mio avviso, la cura orientativa ben intenzionata e la riduzione dei compiti e delle responsabilità sono errori che noi pediatri commettiamo ancora troppo spesso, soprattutto con i pazienti malati cronici. Dobbiamo essere consapevoli che non stiamo promuovendo l’indipendenza dei pazienti. Per questo motivo, un programma di transizione strutturato è importante per il percorso a lungo termine oltre i 18 anni.
Sommario
Il trapianto di polmone offre ai bambini e ai giovani, indipendentemente dall’età, la possibilità di una vita più lunga e migliore. Tuttavia, è anche associata a complicazioni e impegni a vita che sono molto diversi da una vita normale e richiedono molto ai pazienti e alle loro famiglie. Pertanto, sono sempre indispensabili una valutazione dettagliata, una formazione approfondita, una conseguente identificazione selettiva dei candidati idonei e un’assistenza multidisciplinare prima e dopo il trapianto. L’assistenza personalizzata al paziente necessaria a questo scopo richiede tempo e personale. Questo aspetto non viene preso sufficientemente in considerazione nell’attuale sistema sanitario. Per migliorare la sopravvivenza a lungo termine e la qualità di vita dei bambini che ci vengono affidati, non dobbiamo stancarci di lottare contro questo problema.
Messaggi da portare a casa
- L’età media al momento del trapianto è di 12-15 anni, la fibrosi cistica (FC) è l’indicazione più comune, circa il 60%, seguita dall’ipertensione arteriosa polmonare (PAH).
- Ogni fase della vita prima e dopo il trapianto di polmone porta con sé particolari sfide mediche e psicosociali che possono differire tra gli individui, ma che sono essenziali da considerare.
- Un’assistenza psicosociale attenta e personalizzata per i bambini trapiantati e i loro familiari è estremamente importante.
- La mancanza di aderenza al trattamento negli adolescenti dopo il trapianto di polmone è un importante fattore di rischio per il rigetto cronico dell’organo.
- Le gravi conseguenze a lungo termine della terapia immunosoppressiva includono una grave insufficienza renale (circa il 6%), il diabete mellito (circa il 30%) e i tumori maligni (circa il 10%). I pazienti pediatrici contraggono prevalentemente linfomi associati all’EBV.
- Uno dei motivi principali della prognosi sfavorevole rispetto ad altri trapianti di organi solidi è probabilmente l’esposizione significativamente più elevata del polmone all’ambiente, con una conseguente stimolazione costante del sistema immunitario.
Letteratura:
- Iablonskii P, Carlens J, Mueller C, et al: Indicazioni e risultati dopo il trapianto di polmone nei bambini di età inferiore ai 12 anni: un’esperienza di 16 anni in un unico centro. J Heart Lung Transplant 2021 Oct 28.
- Schmid FA, Inci I, Burgi U, et al: Esito favorevole di bambini e adolescenti sottoposti a trapianto di polmone in un centro europeo per adulti nella nuova era. Pediatr Pulmonol 2016; 5(11): 1222-1228.
- Khush KK, Cherikh WS, Chambers DC, et al: Il Registro Internazionale dei Trapianti di Organi Toracici della Società Internazionale per il Trapianto di Cuore e Polmone: Trentaseiesimo rapporto sul trapianto di cuore nell’adulto – 2019; tema centrale: Corrispondenza tra donatore e ricevente. J Heart Lung Transplant 2019; 38(10): 1056-1066.
- Hayes D Jr AD, The International Society for Heart and Lung Transplantation – International Thoracic Organ Transplant Registry, Dallas, Texas, Harhay MO, et al: The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Twenty-fourth pediatric lung transplantation report – 2021; Focus on recipient characteristics. J Heart Lung Transplant 2021; 40(10): 1023-1034.
- Leard LE, Holm AM, Valapour M, et al: Documento di consenso per la selezione dei candidati al trapianto di polmone: un aggiornamento della Società Internazionale per il Trapianto di Cuore e Polmone. J Heart Lung Transplant 2021; 40(11): 1349-1379.
- Solomon M, Mallory GB: Riferimenti per il trapianto di polmone per le persone con fibrosi cistica: una prospettiva pediatrica sulle linee guida di consenso della Cystic Fibrosis Foundation. Pediatr Pulmonol 2021; 56(2): 465-471.
- Huddleston CB: Trapianto di polmone per l’ipertensione polmonare nei bambini. Pediatr Crit Care Med 2010; 11(2 Suppl): S53-S56.
- Tudorache I, Sommer W, Kuhn C, et al: Trapianto di polmone per ipertensione polmonare grave – ossigenazione extracorporea a membrana da svegli per il rimodellamento ventricolare sinistro post-operatorio. Trapianto 2015; 99(2): 451-458.
- Goldfarb SB, Hayes DJ, Levvey BJ, et al: Il Registro Internazionale dei Trapianti di Organi Toracici della Società Internazionale per il Trapianto di Cuore e Polmone: Ventunesimo Rapporto sul Trapianto Pediatrico di Polmone e Cuore-Polmone-2018; Tema principale: Trapianto Multiorgano. J Heart Lung Transplant 2018; 37(10): 1196-1206.
- Verleden GM, Raghu G, Meyer KC, et al: Un nuovo sistema di classificazione per la disfunzione cronica dell’allotrapianto polmonare. J Heart Lung Transplant 2014; 33(2): 127-133.
- Khan MS, Zhang W, Taylor RA, et al: Sopravvivenza nel trapianto polmonare pediatrico: l’effetto del volume e dell’esperienza del centro. J Heart Lung Transplant 2015; 34(8): 1073-1081.
- Gorler H, Struber M, Ballmann M, et al: Trapianto di polmone e cuore-polmone in bambini e adolescenti: un’esperienza a lungo termine in un unico centro. J Heart Lung Transplant 2009; 28(3): 243-248.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2022; 4(1): 12-18