Il disturbo più comune dell’equilibrio idrico è l’iponatremia; quindi è anche il disturbo elettrolitico più comune. I disturbi variano da lievi a pericolosi per la vita. La gravità dei sintomi dipende dalla velocità di sviluppo, dalla durata e dalla gravità dell’iponatriemia. La chiarificazione, ma anche la terapia di questo disturbo elettrolitico non è sempre facile.
L’iponatriemia di solito non è causata da una carenza di sodio, ma principalmente da un’alterazione del bilancio dei liquidi dell’organismo. Dal punto di vista dell’equilibrio, la patogenesi dell’iponatriemia ipotensiva è notevolmente semplice: o si assume troppo liquido ipotensivo o se ne elimina troppo poco nelle urine, spiega il dottor Cédric Jäger, medico senior di Nefrologia, Centro Universitario di Medicina Interna dell’Ospedale Cantonale di Basilea, sede di Bruderholz [1]. Per espellere quantità rilevanti di urina ipotonica, i reni devono diluire l’urina riassorbendo più sodio e potassio che acqua, mantenere questa diluizione ed espellere quantità sufficientemente grandi di soluti non elettrolitici, generalmente urea. Di conseguenza, ai fini clinici, si possono distinguere quattro meccanismi di base dell’iponatriemia, continua Jäger: elevata assunzione di acqua libera, elevato ormone antidiuretico (ADH), difetto di diluizione e bassa escrezione di non elettroliti disciolti.
Due parametri centrali decisivi
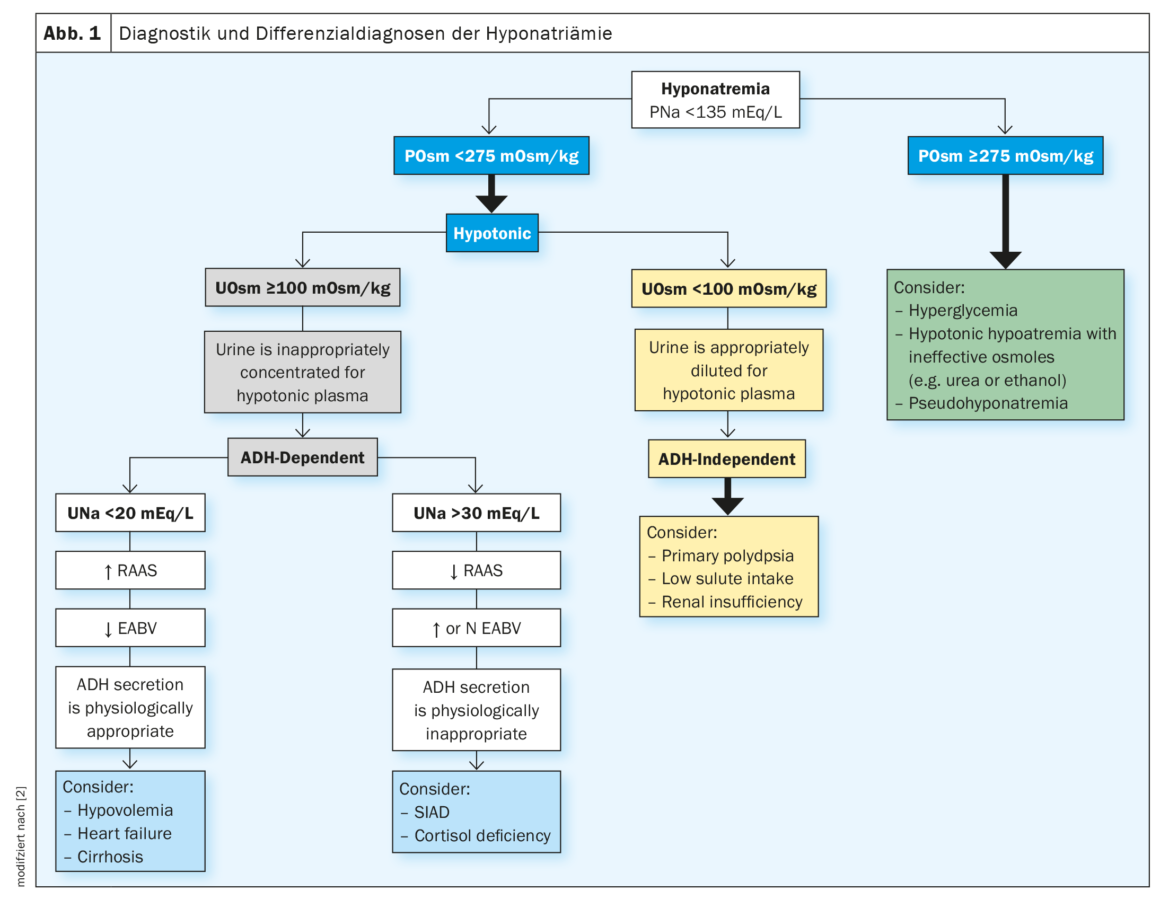
L’iponatremia è definita come un livello di sodio nel siero <135 mmol/l. Se si verifica un’iponatriemia, si determina prima l’osmolalità plasmatica. Un’osmolalità plasmatica di <275 mOsm/kg indica iponatremia ipoosmolare. In questo caso, è necessario determinare l’osmolalità dell’urina. Con un’osmolalità dell’urina <100 mOsm/kg, l’ADH non è attivo, l’urina è adeguatamente diluita per il plasma ipotonico, si può prendere in considerazione la polidipsia primaria, la scarsa assunzione di soluti o l’insufficienza renale. Un’osmolalità dell’urina ≥100 mOsm/kg indica un ADH attivo, l’urina diventa inappropriatamente concentrata per il plasma ipotonico. In questo caso, è necessario determinare il sodio urinario (UNa). Con una UNa <20 mEq/l, il sistema renina-angiotensina-aldosterone (RAAS) è attivo e il volume ematico arterioso effettivo (EABV) è basso. La secrezione di ADH è fisiologicamente adeguata, si può prendere in considerazione l’ipovolemia, l’insufficienza cardiaca o la cirrosi. Con un UNa >30 mEq/l, il RAAS non è attivo e il volume sanguigno arterioso effettivo (EABV) aumenta. La secrezione di ADH è fisiologicamente inappropriata. Si sviluppa la sindrome da antidiuresi inadeguata (SIADH), per cui il corpo trattiene i liquidi e abbassa i livelli di sodio per diluizione (Fig. 1) [2].
La scarsa assunzione di soluti è una causa sottovalutata di iponatremia.
La maggior parte dei pazienti con iponatriemia espelle urina ipotonica, ad eccezione della SIADH. In questo caso, il tasso di escrezione dell’acqua libera dipende dal volume dell’urina, che a sua volta dipende dal tasso di escrezione dei soluti. La quantità giornaliera di soluti da espellere negli adulti con una dieta normale è di 500-1000 mOsm e consiste nell’urea, prodotta dal metabolismo delle proteine alimentari, e negli elettroliti. Se un paziente ha un carico dissolto giornaliero di 600 mOsm, espellerà 3 litri di urina al giorno (600 mOsm/200 mOsm/kg) e quindi 1,5 litri di acqua senza elettroliti al giorno. La probabilità che questo paziente diventi iponatriemico con una normale assunzione giornaliera di acqua di 1,5 litri è molto bassa. Se, invece, il carico disciolto giornaliero scende a 300 mOsm, ad esempio a causa di un’assunzione insufficiente di proteine, l’escrezione giornaliera di acqua priva di elettroliti sarà di soli 750 ml. In questa situazione, sarebbe necessario limitare l’assunzione di acqua a circa 750 ml al giorno per evitare un’iponatriemia progressiva. Infine, un paziente con un carico disciolto giornaliero di 150 mOsm avrebbe un’escrezione giornaliera di acqua priva di elettroliti di 375 ml e probabilmente diventerebbe progressivamente iponatriemico nonostante una forte restrizione dell’assunzione di acqua.
I molti volti di un quadro clinico comune
La manifestazione estrema di questo fenomeno si chiama “potomania da birra”. Si verifica raramente e soprattutto negli alcolisti che bevono grandi quantità di liquidi a basso contenuto di elettroliti e consumano poche proteine e sviluppano l’iponatriemia nonostante la normale capacità di diluizione dell’urina. Questo fenomeno è stato descritto anche in pazienti che seguono diete estreme per la perdita di peso con un apporto di proteine molto basso e di acqua elevato (ad esempio, una dieta “tè e toast”), chiamata “potomania da non birra” o “potomania da fame”.
Inoltre, è sottovalutato il fatto che la scarsa assunzione di soluti è un fattore comune che contribuisce all’iponatriemia nei pazienti con altre condizioni che causano iponatriemia. In particolare, i pazienti con insufficienza cardiaca cronica e insufficienza epatica cronica di solito hanno una forte restrizione di sale e possono avere un appetito limitato. Inoltre, molti di questi pazienti sono anziani, vivono da soli e sono gravemente compromessi dal punto di vista funzionale, limitando ulteriormente la loro capacità e motivazione a preparare pasti nutrienti. Questi pazienti presentano un difetto di diluizione urinaria perché il volume circolante è esaurito e la secrezione di ADH è stimolata. In molti di questi pazienti è stato riscontrato un difetto di diluizione urinaria relativamente lieve, ma un’iponatriemia sproporzionatamente grave, inaspettatamente resistente al trattamento primario di restrizione dei liquidi. “Potomania” è un termine improprio in questo contesto, in quanto le persone colpite spesso consumano pochissimi liquidi, sia volontariamente che a causa di una restrizione di liquidi prescritta.
Prestare attenzione all’apporto di proteine nella dieta
Ciò rappresenta un problema di gestione difficile, in quanto ci sono poche altre opzioni terapeutiche in questi pazienti: Le compresse di sale sono solitamente controindicate a causa dell’edema, il tolvaptan è approvato solo per il trattamento acuto fino a un mese ed è controindicato nella malattia epatica. I diuretici dell’ansa sono efficaci per abbassare l’osmolalità dell’urina molto alta, ma generalmente solo fino a 200-300 mOsm/kg e non al di sotto. In questi pazienti, è stato ottenuto un successo aneddotico nel trattamento con un aumento dell’assunzione di proteine nella dieta. In questo modo, la formazione di urea, il carico osmolare giornaliero e quindi l’escrezione giornaliera di acqua libera possono aumentare. È interessante notare che questo è fisiologicamente equivalente al trattamento dei pazienti con urea, che è stato utilizzato con successo per trattare la SIADH.
Si raccomanda di determinare il tasso di escrezione giornaliera di soluti in tutti i pazienti con iponatriemia. Questo può essere determinato da una raccolta di urine di 24 ore: Tasso di escrezione osmolare (mOsm/giorno) = osmolalità dell’urina (mOsm/kg) × volume dell’urina (l/giorno). In alternativa, l’osmolalità può essere stimata da un’urina prelevata normalizzando l’osmolalità dell’urina alla concentrazione di creatinina: Tasso di escrezione osmolare (mOsm/giorno) = osmolalità dell’urina (mOsm/kg)/concentrazione CR dell’urina (mg/dl) × 100. Se il tasso di escrezione osmolare è <500 mOsm/kg, è necessario stimare l’apporto proteico del paziente. Questo può essere fatto direttamente valutando l’assunzione di cibo auto-riferita o indirettamente dal contenuto di urea urinaria misurato, utilizzando un’equazione di stima per la presenza di azoto proteico. Se l’apporto proteico del paziente è basso, si devono avviare misure per aumentare l’apporto proteico per aumentare l’escrezione di acqua libera e migliorare l’iponatriemia.
Congresso: Aggiornamento FomF Aggiornamento 2023
Letteratura:
- Dr. med. Cédric Jäger: Elektrolytstörungen – Richtig diagnostizieren und therapieren. Forum Medizin Fortbildung (FomF), Update Refresher 2023, Nephrologie, 26.01.2023.
- Workeneh BT, et al.: Hyponatremia Demystified: Integrating Physiology to Shape Clinical Practice. Advances in Kidney Disease and Health, 2022;
doi: https://doi.org/10.1053/j.akdh.2022.11.004.
HAUSARZT PRAXIS 2023; 18(2): 32–33 (pubblicato il 22.2.23, prima della stampa).











