L’ipertensione polmonare tromboembolica cronica (CTEPH) è un sottotipo di ipertensione polmonare (PH). La diagnosi è complessivamente molto rara, anche se spesso la CTEPH non viene riconosciuta e quindi sottodiagnosticata, motivo per cui il numero di casi non segnalati è probabilmente più alto.
L’ipertensione polmonare tromboembolica cronica (CTEPH) è un sottotipo di ipertensione polmonare (PH), classe 4 secondo la classificazione ESC/ERC [1]. La diagnosi di CTEPH può essere fatta quando è presente una PH sintomatica precapillare (mPAP minima 20-25 mmHg e pressione di occlusione capillare polmonare ≤15 mmHg) combinata con disturbi della perfusione polmonare, dopo un minimo di 3 mesi di anticoagulazione affidabile [2] per la differenziazione dall’embolia polmonare acuta (LE). La diagnosi è complessivamente molto rara, anche se spesso la CTEPH non viene riconosciuta e quindi sottodiagnosticata, e il numero di casi non segnalati è probabilmente più alto.
Questo articolo presenta la diagnosi e la terapia della CTEPH, con l’obiettivo di sensibilizzare i medici di base e anche i colleghi specializzati su questa patologia, perché per questi pazienti esiste una terapia curativa – al contrario di tutte le altre forme di PH.
Incidenza, fattori di rischio e patogenesi
L’incidenza annuale della CTEPH negli Stati Uniti, in Europa e in Giappone è di circa 3-5 casi per 100.000 abitanti [2]. L’incidenza cumulativa di CTEPH nei primi 2 anni dopo una LE acuta varia dallo 0,1 al 9,1% [2–10], un ampio intervallo; per la Svizzera, persino uno studio ha riportato solo lo 0,79% [11]. Come se non bastasse, più del 25% dei casi di nuova diagnosi non ha una storia di LE acuta [12]. Esistono altri fattori di rischio noti oltre agli eventi tromboembolici, come i disturbi autoimmuni ed ematologici [13], la presenza di shunt ventricolo-atriale o elettrodi di stimolazione infetti, una storia di splenectomia, un gruppo sanguigno non 0, la presenza di anticorpi lupus anticoagulante/antifosfolipidi, la terapia sostitutiva con ormone tiroideo e una storia di tumori [14], che sono anche prognosticamente sfavorevoli.
L’esatta fisiopatologia della CTEPH è complessa, rimane poco chiara ed è probabile che siano presenti molteplici meccanismi causali, come i trombi persistenti organizzati e la cicatrizzazione nelle arterie polmonari prossimali (principali, dei lobi e segmentali) e/o la microangiopatia [15]. Vari processi sono stati associati alla risoluzione incompleta del trombo [16]: fattori infiammatori [17–19], genetici [20–22], anomalie della fibrinolisi [23–27] e molti altri [28].
Quadro clinico e descrizione del caso
Il quadro clinico comprende sempre la dispnea da sforzo, il sintomo principale [29,30]. Altri sintomi includono affaticamento in circa il 30% dei casi, dolore toracico nel 15%, un episodio di sincope in circa il 14% ed emottisi nel 5% [12,31,32]. Tutti questi sintomi non sono rari, soprattutto nei pazienti anziani con ulteriori comorbilità come la broncopneumopatia cronica ostruttiva, il decondizionamento e l’obesità spesso associata [33,34]. A peggiorare le cose, circa la metà di tutti i pazienti con LE acuta riferisce una dispnea persistente, anche anni dopo l’evento, che si chiama “sindrome post-PE”. Tuttavia, questi pazienti devono essere sottoposti a un ulteriore approfondimento diagnostico per escludere la CTEPH.
L’esame clinico rivela un edema progressivo delle estremità inferiori e altri segni di congestione (vene del collo, ingrossamento del fegato) [33]. Inoltre, all’auscultazione si può rilevare un’accentuazione della componente polmonare del secondo suono cardiaco.
Diagnosi
Purtroppo, ad oggi non esiste un biomarcatore che differenzi chiaramente la CTEPH da altre forme di PH; alcuni marcatori infiammatori circolanti (ad esempio CRP, interleuchine -6, -8 e -10) sono stati studiati [17,18,35], ma nessuno di questi test ha un utilizzo di routine. L’ECG mostra segni di tensione del ventricolo destro, come un blocco di branca destro di tipo (in)completo o negatività delle onde T nelle derivazioni anteriori V1-V4 (“modello di tensione del ventricolo destro”). Alla radiografia del torace ci sono solo segni non specifici di affaticamento del cuore destro, ad esempio un ventricolo e un atrio destro ingrossati.
Nella diagnostica successiva, di solito si usa prima l’ecocardiografia transtoracica (TTE), che è anche elencata nella conferenza di consenso del 2016 come prima misura diagnostica nell’algoritmo diagnostico (Fig. 1). È anche un buon primo test di screening quando si distingue dalla sindrome post-PE. L’ipertensione polmonare è definita nel TTE dall’espressione della velocità di rigurgito tricuspidale [36], da cui si può misurare la sPAP. In base alla misurazione Doppler della velocità di rigurgito (Vmax) attraverso la valvola tricuspide, il gradiente di pressione tra il ventricolo destro e l’atrio destro viene stimato utilizzando l’equazione di Bernoulli semplificata (∆P=4×Vmax2). La pressione atriale destra è solitamente approssimata dalla larghezza e dalla variabilità respiratoria della vena cava inferiore. Altri segni sono le dimensioni e la dilatazione del ventricolo destro e degli atri, la forma a “D” del setto e il movimento del piano tricuspidale (“escursione sistolica del piano annulatorio tricupsideo”, TAPSE). Tuttavia, un’eco normale non esclude la CTEPH.
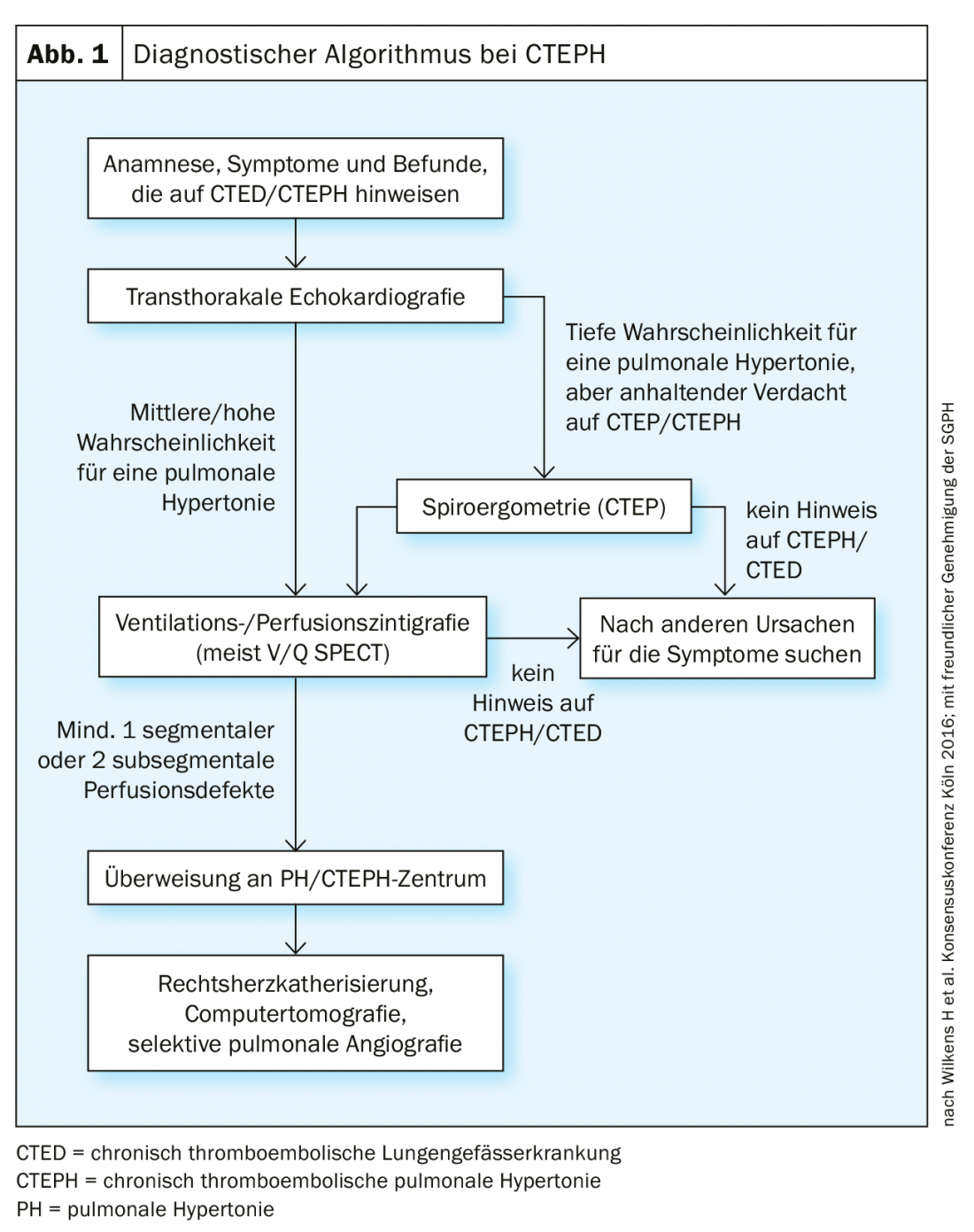
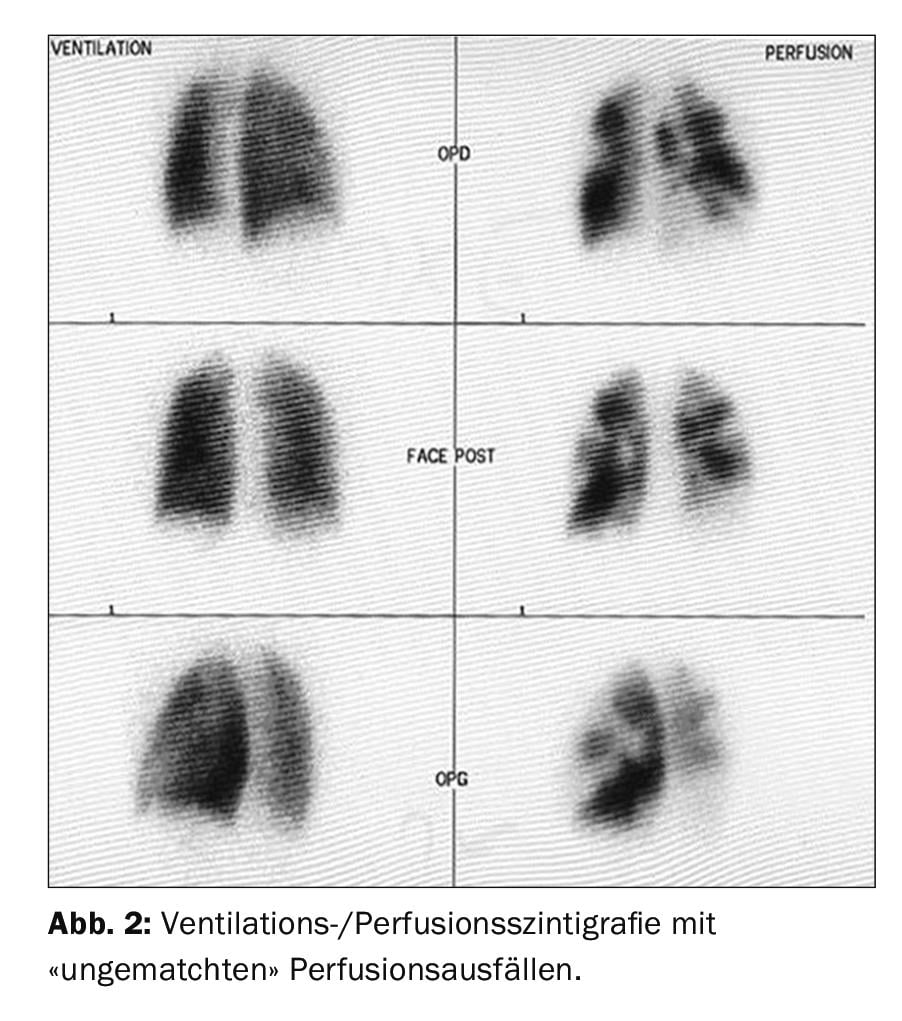
Il primo metodo di screening di imaging è la scintigrafia di ventilazione/perfusione (Fig. 2) che, se normale (cioè senza deficit di perfusione “non corrispondenti”), può essere utilizzata per escludere la CTEPH con una sensibilità del 90-100% e una specificità del 94-100% [37,38]. Le nuove tecniche “a doppia energia”, con una combinazione ibrida di SPECT e TC, hanno il vantaggio di imitare simultaneamente il parenchima polmonare oltre ai deficit di perfusione [39,40], ma non sono disponibili in tutti gli ospedali.
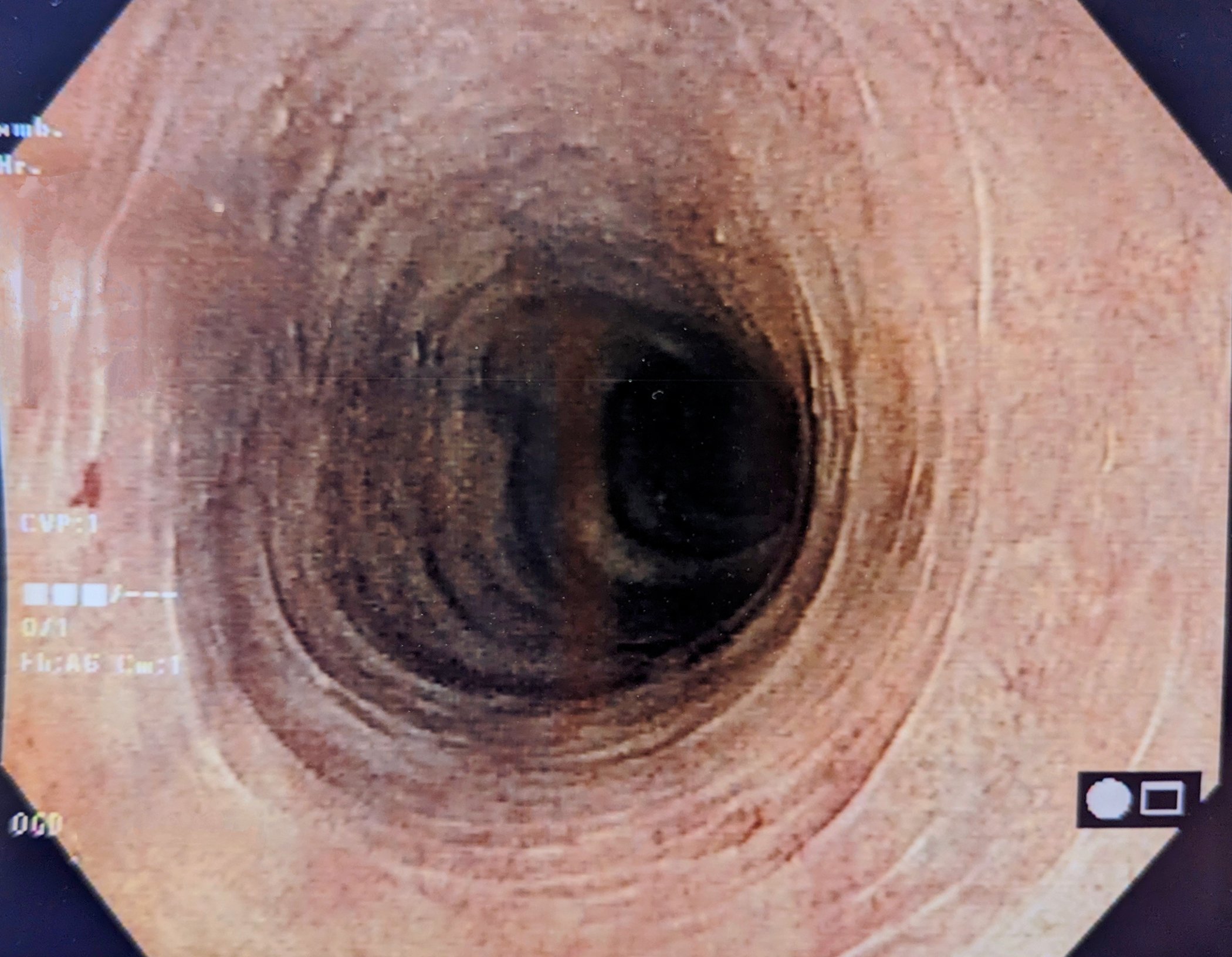
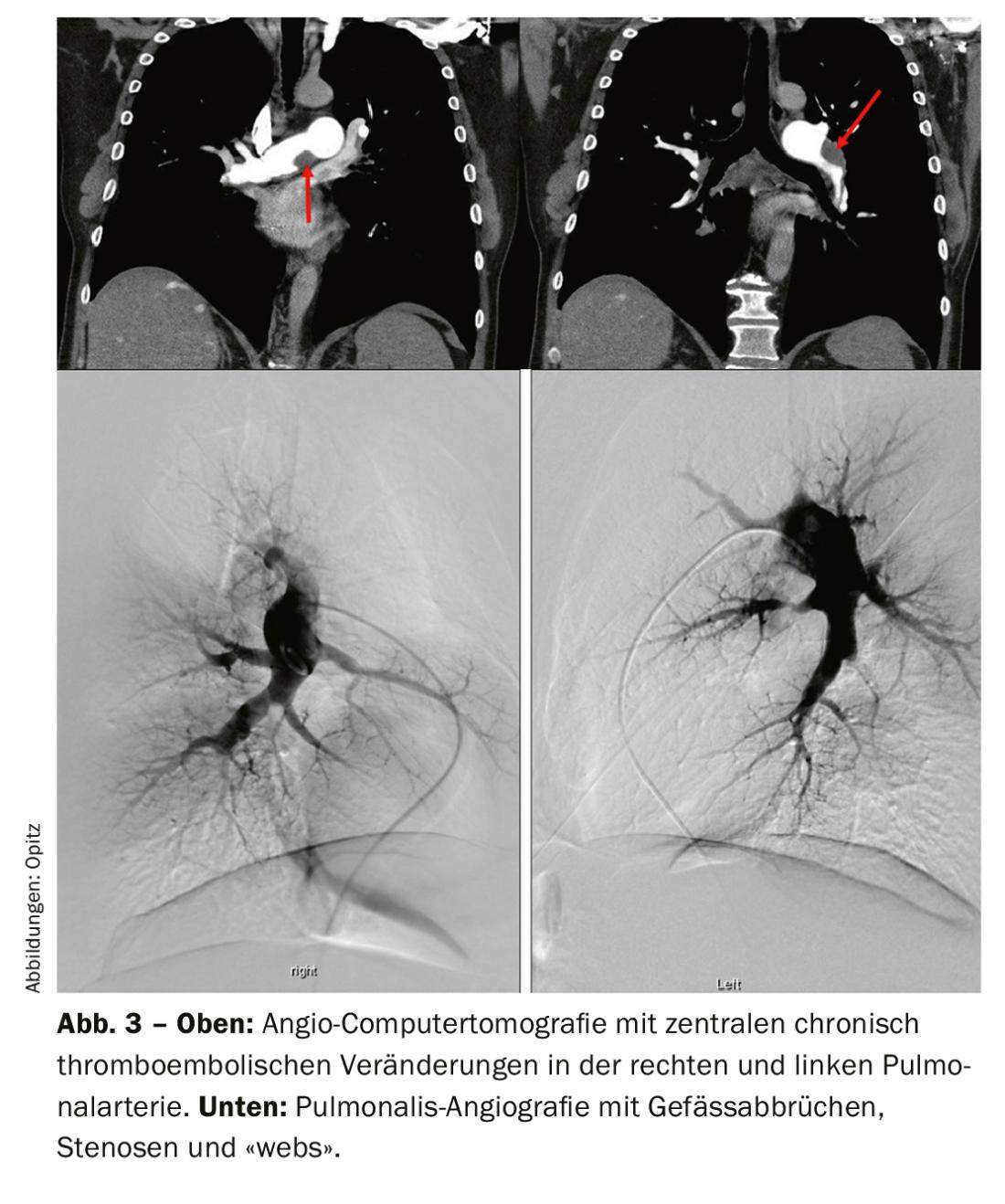
L’angiografia polmonare tomografica computerizzata (CTPA) presenta molti vantaggi nella diagnosi e nella valutazione dell’operabilità della CTEPH. In particolare, ha sensibilità e specificità per rilevare le alterazioni tromboemboliche a livello lobare (97-100% e 95-100%, rispettivamente), e un po’ più bassa a livello segmentale più periferico (86-100 e 93-99%, rispettivamente) [33,41–43]. I segni classici sono i trombi eccentrici (Fig. 3), le cosiddette “ragnatele” e le “lesioni a sacca” occludenti, nonché le collateralità pronunciate dalle arterie intercostali, per esempio. Tutti questi segni sono visibili anche all’angiografia polmonare (Fig. 3 sotto), che ha anche il vantaggio di misurare la pressione PA in modo invasivo. Tuttavia, alla TAC possono essere rilevate altre diagnosi differenziali (DD) e nel parenchima polmonare possono essere rilevati anche segni di “perfusione a mosaico” ed eventualmente infarti. Un altro vantaggio è la rappresentazione dell’accessibilità delle alterazioni tromboemboliche croniche, per identificare quanto prossimale si presenta uno strato di dissezione e se è accessibile per l’endarterectomia polmonare. Per poterli interpretare, oltre alla fetta assiale sono necessarie ricostruzioni sul piano sagittale e coronarico e la TAC deve essere stata eseguita con uno spessore di fetta di 1 mm. La risonanza magnetica (RM) non ha ancora svolto un ruolo nella diagnostica della CTEPH in un’applicazione standardizzata; tuttavia, la registrazione simultanea della funzione ventricolare destra rappresenta un vantaggio e in futuro si prevede che la RM svolgerà un ruolo crescente per lo screening, ma anche, se necessario, per il follow-up dei pazienti con CTEPH dopo l’intervento chirurgico o altre terapie.
La conferma emodinamica della CTEPH si ottiene con il cateterismo cardiaco destro: La pressione arteriosa polmonare media (mPAP) deve essere ≥20-25 mmgHg [1] e la pressione precapillare (“wedge pressure”/pressione di occlusione capillare polmonare ≤15 mmHg). L’acquisizione della gittata cardiaca mediante termodiluizione o metodo diretto di Fick è un prerequisito per un calcolo corretto della resistenza vascolare polmonare (PVR), un fattore importante per la prognosi e il rischio chirurgico [44].
La spiroergometria rappresenta un ulteriore esame funzionale nella delimitazione della CTEPH: Qui vengono mostrati i segni tipici del mismatch ventilazione-perfusione con un aumento degli equivalenti respiratori alla soglia anaerobica, un aumento del gradiente di pO2 alveo-arterioso, un gradiente positivo di CO2 capillare-end-tidal, un’ipossiemia indotta dall’esercizio e una capacità di esercizio chiaramente ridotta [45–48].
È particolarmente importante che se si sospetta una CTEPH, il paziente venga indirizzato a un centro specializzato per un’ulteriore diagnosi interdisciplinare e l’assegnazione della terapia.
Di seguito, viene descritto un caso classico con l’intera storia del paziente:
Un paziente di 50 anni con una storia di emboli polmonari multipli ed eventi tromboembolici si presenta con una mancanza di respiro NYHA III-IV. Nel test del cammino di 6 minuti, il paziente ha raggiunto 270 metri a Borg 2 (tab. 1).
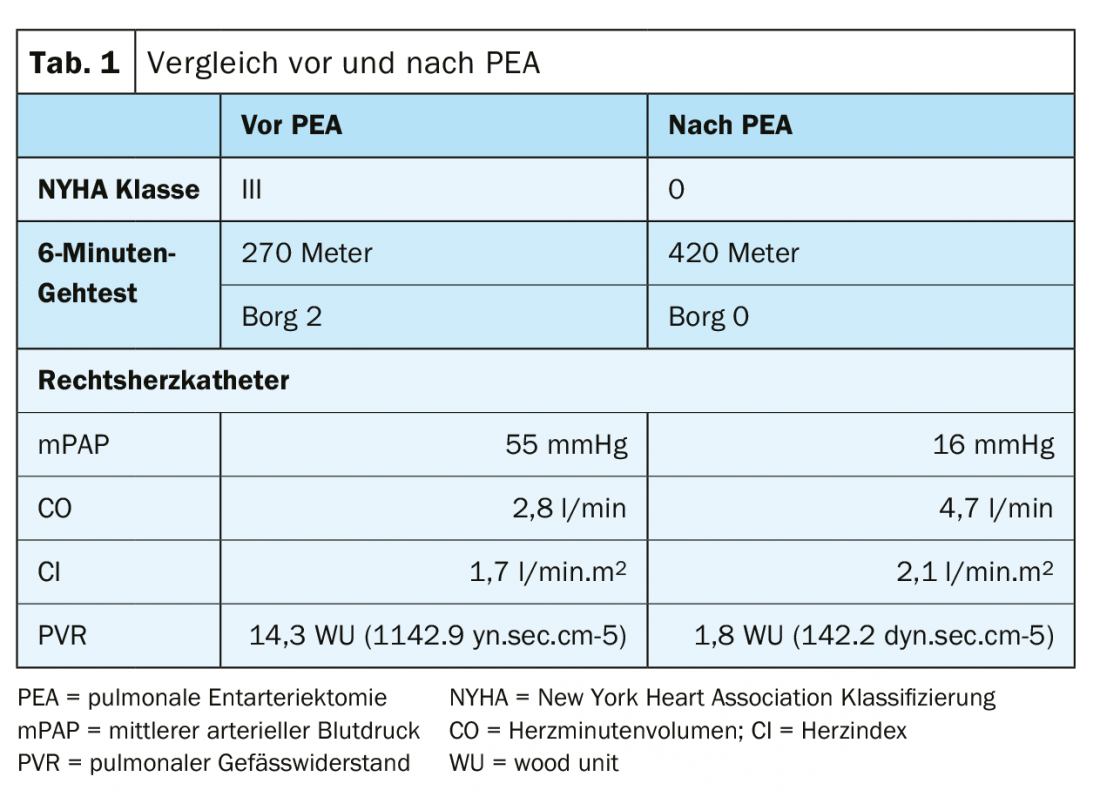
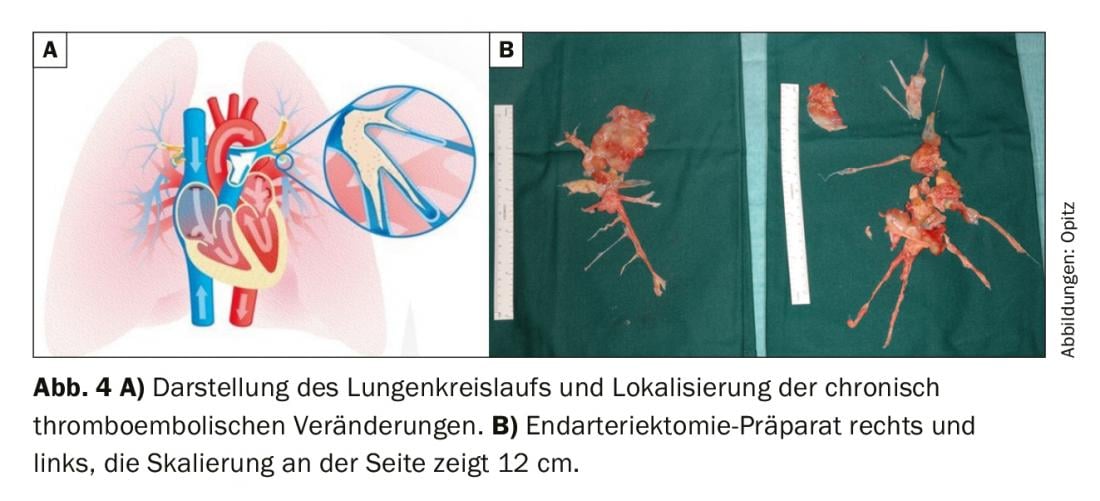
La scintigrafia ventilazione/perfusione ha mostrato difetti di perfusione bilaterali “non appaiati” ( fig. 2) . L’ecocardiografia transtoracica mostra un’elevata pressione sistolica dell’arteria polmonare (sPAP) e un ventricolo destro dilatato. La TAC mostra lesioni centrali (Fig. 3 in alto), che sono state rimosse alla periferia nell’entarterectomia polmonare (Fig. 4B) . Dopo l’intervento, il paziente si è ripreso rapidamente e ha avuto un’emodinamica normale e NYHA 0 nel follow-up di 1 anno (tab. 1).
Previsioni
Una volta diagnosticata, il trattamento deve essere discusso immediatamente, poiché non trattata, una mPAP di >50 mmgHg ha una mortalità a 2 anni dell’>80% e una mPAP di >30 mmgHg è associata a una mortalità a 3 anni del 90% [49].
Dal 2015, presso l’Ospedale Universitario di Zurigo (USZ) viene offerto un programma interdisciplinare di CTEPH, che offre l’intera gamma di trattamenti, dalla chirurgia all’angioplastica e alla terapia farmacologica. Una o due volte al mese, la Società Svizzera per l’Ipertensione Polmonare offre un consiglio nazionale sulla CTEPH, al quale i medici di riferimento possono rivolgersi per la presentazione di casi e la discussione (CTEPH@usz.ch, CTEPH@sgph.ch).
Terapia
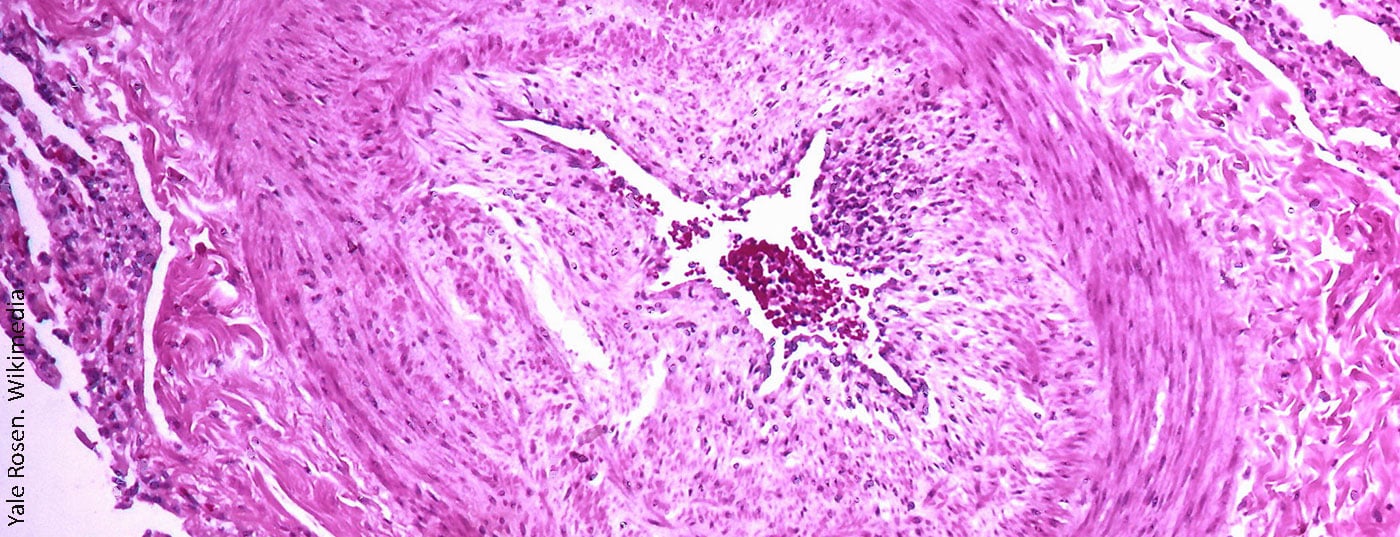
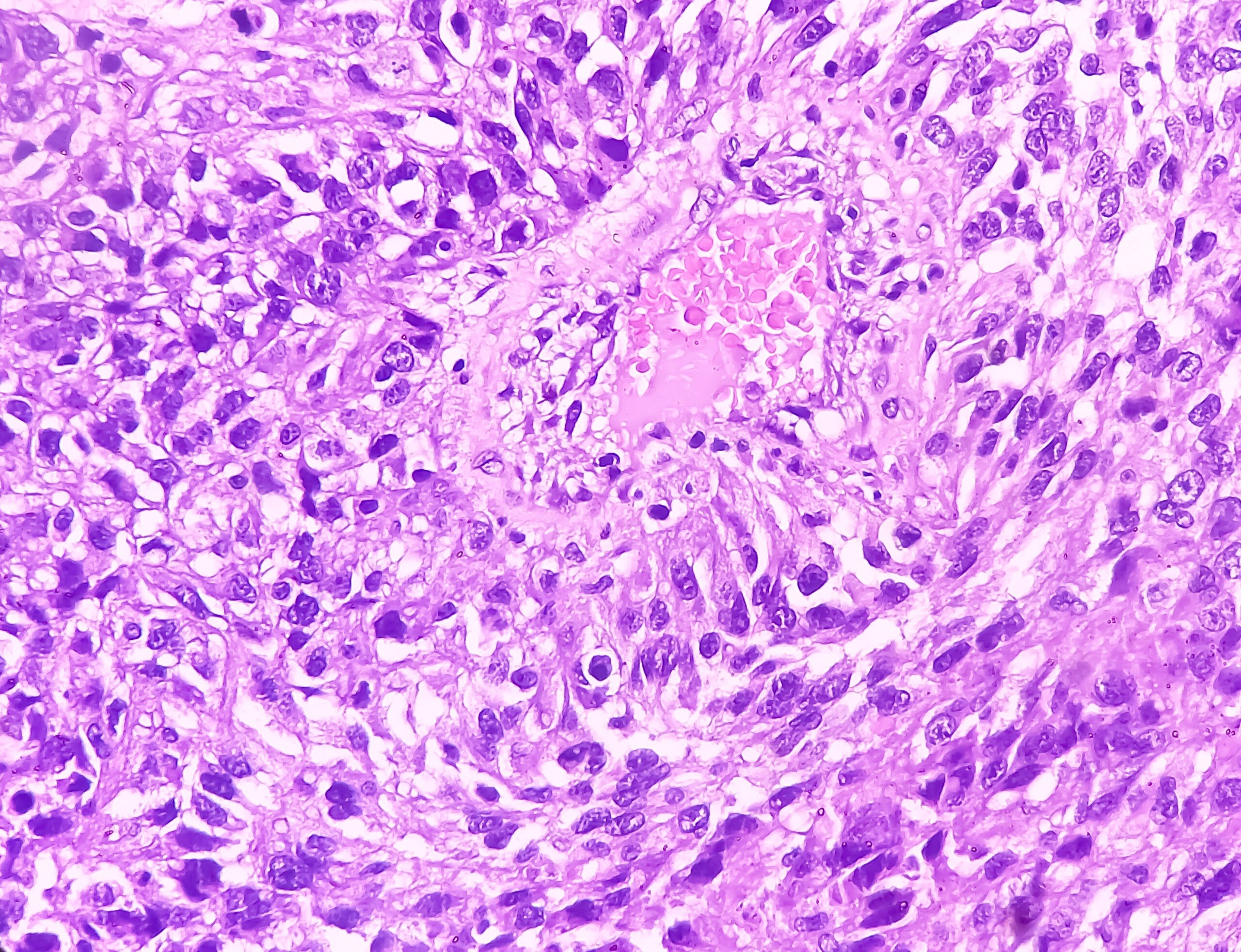
Terapia chirurgica: secondo le attuali linee guida ERS/ESC, l’endarterectomia polmonare (PEA) è raccomandata come terapia di prima linea nei pazienti con CTEPH accessibile chirurgicamente [1]. (Fig. 4A). Nella PEA, le arterie polmonari vengono aperte in sequenza (sempre da entrambi i lati) sulla macchina cuore-polmone e in ipotermia profonda (20°C) e il materiale tromboembolico cronico viene rimosso in arresti circolatori di 20 minuti; questo è tecnicamente possibile fino alla periferia. (Fig. 4B). La decisione per l’intervento chirurgico e la selezione dei pazienti deve sempre essere presa da un team interdisciplinare di specialisti, composto da specialisti di PH, radiologi e chirurghi PEA. [50]. I fattori determinanti per la PEA sono: la gravità dei sintomi, l’estensione della PH, la funzione del ventricolo destro, il profilo di comorbidità del paziente e il materiale accessibile chirurgicamente. Quest’ultimo punto in particolare è una valutazione impegnativa, in quanto è noto che la diagnostica per immagini quasi sempre sottostima l’estensione del materiale tromboembolico cronico. Anche i pazienti con malattia segmentale e sub-segmentale possono trarre beneficio dalla PEA, con ottimi risultati a breve e a lungo termine nei centri esperti [51,52]. Le raccomandazioni formulate durante il Simposio mondiale sulla PH affermano che si dovrebbe ottenere un “secondo parere” da un centro chirurgico esperto in CTEPH se un paziente è stato ritenuto inoperabile in un centro non CTEPH [50]. Inoltre, la gravità della PH e la limitazione della disfunzione del cuore destro non sono di per sé controindicazioni alla PEA e ai pazienti sintomatici dovrebbe essere offerta la terapia chirurgica [53]. Anche l’età non è una controindicazione assoluta, poiché i dati dimostrano che i pazienti >70 anni traggono lo stesso beneficio dei pazienti più giovani [54]. Tuttavia, la mortalità della procedura non è del tutto insignificante e in letteratura è riportata dal 2,4 al 13,2%, con l’ultimo dato relativo ai periodi precedenti [55].
Un intervento chirurgico di successo può migliorare significativamente la qualità di vita e l’aspettativa dei pazienti (tassi di sopravvivenza del >90% dopo 1 anno >70%, dopo 6-10 anni [31,55,56]): È stato possibile dimostrare la dispnea, il test del cammino di 6 minuti, nonché un aumento dell’assorbimento di ossigeno, un miglioramento dell’equivalente respiratorio per laCO2 e una riduzione del fabbisogno di ossigeno [57,58]. L’aumento dell’aspettativa di vita è stato segnalato nel medio-lungo termine.
Angioplastica polmonare con palloncino (BPA)
Se l’intervento chirurgico non è un’opzione, la BPA interventistica può trattare le alterazioni croniche periferiche segmentali o subsegmentali in diverse sedute. Si possono ottenere miglioramenti convincenti nell’emodinamica, nel test del cammino di 6 minuti e nella classe NYHA/WHO. Mancano ancora dati a lungo termine [59].
Terapia farmacologica: i pazienti con CTEPH distale, non accessibile chirurgicamente, e ipertensione polmonare residua dopo la PEA possono essere trattati con farmaci [50,60]. I farmaci simili a quelli utilizzati per la PAH sono utilizzati [61–64]. Indipendentemente dalla terapia di abbassamento della pressione, che agisce in particolare sulla componente distale della CTEPH, ogni paziente con CTEPH deve essere anticoagulato a vita, indipendentemente da altre terapie. La decisione terapeutica deve essere presa solo dopo almeno 3 mesi di OAC [1,65]. Attualmente, i pazienti vengono ancora trattati con antagonisti della vitamina K. Grazie alla loro efficacia comparabile e al buon profilo di sicurezza, anche i NOAK (nuovi anticoagulanti orali) vengono utilizzati sempre di più, soprattutto in caso di problemi di determinazione della dose e nei casi in cui l’INR (International Normalized Ratio) è spesso al di fuori dell’intervallo target di 2,5-3,5 [65,66].
Messaggi da portare a casa
- L’ipertensione polmonare tromboembolica cronica (CTEPH) è definita come ipertensione polmonare sintomatica con difetti di perfusione polmonare persistenti nonostante un’adeguata anticoagulazione per almeno 3 mesi.
- I pazienti con CTEPH devono essere indirizzati a un centro specializzato per la conferma della diagnosi mediante cateterismo cardiaco destro e la successiva terapia.
- La Società Svizzera per l’Ipertensione Polmonare offre un comitato nazionale CTEPH a cui i medici di riferimento possono rivolgersi per la presentazione di casi e la discussione (CTEPH@usz.ch, CTEPH@sgph.ch).
- La capacità funzionale, la resistenza fisica e anche l’aspettativa di vita dei pazienti possono essere aumentate con l’endarterectomia polmonare. Per questo motivo, una PEA dovrebbe essere valutata in ogni caso.
- La terapia farmacologica e/o l’angioplastica con palloncino possono aiutare i pazienti con CTEPH non operabile o con ipertensione polmonare residua post-operatoria.
- La CTEPH richiede un’anticoagulazione orale obbligatoria per tutta la vita.
|
Il team CTEPH dell’Ospedale Universitario di Zurigo: |
Letteratura:
- Galie N, Humbert M, Vachiery JL, et al: Linee guida ESC/ERS 2015 per la diagnosi e il trattamento dell’ipertensione polmonare: La Task Force congiunta per la diagnosi e il trattamento dell’ipertensione polmonare della Società Europea di Cardiologia (ESC) e della Società Respiratoria Europea (ERS): Approvate da: Associazione Europea di Cardiologia Pediatrica e Congenita (AEPC), Società Internazionale per il Trapianto di Cuore e Polmone (ISHLT). La rivista europea di respirazione. 2015;46(4): 903-975.
- Gall H, Hoeper MM, Richter MJ, et al: Un’analisi epidemiologica del peso dell’ipertensione polmonare cronica tromboembolica negli Stati Uniti, in Europa e in Giappone. European respiratory review : rivista ufficiale della European Respiratory Society. 2017;26(143).
- Korkmaz A, Ozlu T, Ozsu S, et al: Esiti a lungo termine nel tromboembolismo polmonare acuto: incidenza dell’ipertensione polmonare cronica tromboembolica e fattori di rischio associati. Clin Appl Thromb Hemost. 2012;18(3): 281-288.
- Otero R, Oribe M, Ballaz A, et al: Valutazione ecocardiografica della pressione arteriosa polmonare nel follow-up dei pazienti con embolia polmonare. Ricerca sulla trombosi. 2011;127(4): 303-308.
- Poli D, Grifoni E, Antonucci E, et al: Incidenza di tromboembolismo venoso ricorrente e di ipertensione polmonare tromboembolica cronica nei pazienti dopo un primo episodio di embolia polmonare. J Thromb Thrombolysis. 2010;30(3): 294-299.
- Surie S, Gibson NS, Gerdes VE, et al.: La ricerca attiva dell’ipertensione polmonare tromboembolica cronica non sembra essere indicata dopo un’embolia polmonare acuta. Ricerca sulla trombosi. 2010;125(5): e202-205.
- Dentali F, Donadini M, Gianni M, et al: Incidenza dell’ipertensione polmonare cronica nei pazienti con precedente embolia polmonare. Ricerca sulla trombosi. 2009;124(3): 256-258.
- Marti D, Gomez V, Escobar C, et al: Incidenza dell’ipertensione polmonare tromboembolica cronica sintomatica e asintomatica. Arch Bronconeumol. 2010;46(12): 628-633.
- Klok FA, van Kralingen KW, van Dijk AP, et al: Programma di screening cardiopolmonare prospettico per rilevare l’ipertensione polmonare cronica tromboembolica nei pazienti dopo embolia polmonare acuta. Ematologica. 2010;95(6): 970-975.
- Noble S, Pasi J: Epidemiologia e fisiopatologia della trombosi associata al cancro. Br J Cancer. 2010; 102 Suppl 1: S2-9.
- Coquoz N, Weilenmann D, Stolz D, et al: Indagine di screening osservazionale multicentrica per il rilevamento della CTEPH in seguito a embolia polmonare. La rivista europea di respirazione. 2018;51(4).
- Pepke-Zaba J, Delcroix M, Lang I, et al: Ipertensione polmonare cronica tromboembolica (CTEPH): risultati di un registro prospettico internazionale. Circolazione. 2011;124(18): 1973-1981.
- Blauwet LA, Edwards WD, Tazelaar HD, McGregor CG: Patologia chirurgica della tromboendarterectomia polmonare: uno studio di 54 casi dal 1990 al 2001. Hum Pathol. 2003;34(12): 1290-1298.
- Bonderman D, Wilkens H, Wakounig S, et al: Fattori di rischio per l’ipertensione polmonare cronica tromboembolica. La rivista europea di respirazione. 2009;33(2): 325-331.
- Kim NH: Gruppo 4 Ipertensione polmonare: Ipertensione polmonare cronica tromboembolica: epidemiologia, fisiopatologia e trattamento. Cardiol Clin. 2016;34(3): 435-441.
- Simonneau G, Torbicki A, Dorfmuller P, Kim N: La fisiopatologia dell’ipertensione polmonare cronica tromboembolica. European respiratory review: rivista ufficiale della European Respiratory Society. 2017; 26 (143).
- Quarck R, Nawrot T, Meyns B, Delcroix M: Proteina C-reattiva: un nuovo predittore di esito avverso nell’ipertensione arteriosa polmonare. Giornale del Collegio Americano di Cardiologia. 2009;53(14): 1211-1218.
- Zabini D, Heinemann A, Foris V, et al: Analisi completa dei marcatori infiammatori nei pazienti con ipertensione polmonare cronica tromboembolica. La rivista europea di respirazione. 2014;44(4): 951-962.
- Reesink HJ, Meijer RC, Lutter R, et al: Correlati emodinamici e clinici dell’endotelina-1 nell’ipertensione polmonare cronica tromboembolica. Circ J. 2006;70(8): 1058-1063.
- Wolf M, Boyer-Neumann C, Parent F, et al: Fattori di rischio trombotico nell’ipertensione polmonare. La rivista europea di respirazione. 2000;15(2): 395-399.
- Bonderman D, Turecek PL, Jakowitsch J, et al: Alta prevalenza di fattore VIII di coagulazione elevato nell’ipertensione polmonare cronica tromboembolica. Tromb Haemost. 2003;90(3): 372-376.
- Gu S, Su P, Yan J, et al.: Confronto dei profili di espressione genica e dei percorsi correlati nell’ipertensione polmonare cronica tromboembolica. Int J Mol Med. 2014;33(2): 277-300.
- Lang IM, Dorfmuller P, Vonk Noordegraaf A: La patobiologia dell’ipertensione polmonare tromboembolica cronica. Ann Am Thorac Soc. 2016;13 Suppl 3: S215-221.
- Le Gal G, Delahousse B, Lacut K, et al: Polimorfismi del fibrinogeno Aalpha-Thr312Ala e del fattore XIII-A Val34Leu nel tromboembolismo venoso idiopatico. Ricerca sulla trombosi. 2007;121(3): 333-338.
- Suntharalingam J, Goldsmith K, van Marion V, et al: Il polimorfismo del fibrinogeno Aalpha Thr312Ala è associato all’ipertensione polmonare cronica tromboembolica. La rivista europea di respirazione. 2008;31(4): 736-741.
- Marsh JJ, Chiles PG, Liang NC, Morris TA: Le disfibrinogenemie croniche associate all’ipertensione polmonare tromboembolica presentano una struttura di fibrina disorganizzata. Ricerca sulla trombosi. 2013;132(6): 729-734.
- Morris TA, Marsh JJ, Chiles PG, et al: Alta prevalenza di disfibrinogenemia tra i pazienti con ipertensione polmonare cronica tromboembolica. Sangue. 2009;114(9): 1929-1936.
- Opitz I, Kirschner MB: Ricerca molecolare nell’ipertensione polmonare tromboembolica cronica. Int J Mol Sci. 2019;20(3).
- Mayer E, Jenkins D, Lindner J, et al: Gestione chirurgica ed esito dei pazienti con ipertensione polmonare cronica tromboembolica: risultati di un registro prospettico internazionale. J Thorac Cardiovasc Surg. 2011; 141(3): 702-710.
- Held M, Grun M, Holl R, et al.: Ipertensione polmonare cronica tromboembolica: ritardo dall’insorgenza dei sintomi alla diagnosi e condizioni cliniche al momento della diagnosi. Dtsch Med Wochenschr. 2014;139(33): 1647-1652.
- Hoeper MM, Madani MM, Nakanishi N, et al: Ipertensione polmonare cronica tromboembolica. Lancet Respir Med. 2014;2(7): 573-582.
- Lang IM, Simonneau G, Pepke-Zaba JW, et al: Fattori associati alla diagnosi e all’operabilità dell’ipertensione polmonare cronica tromboembolica. Uno studio caso-controllo. Tromb Haemost. 2013;110(1): 83-91.
- Gopalan D, Delcroix M, Held M. Diagnosi dell’ipertensione polmonare cronica tromboembolica. European respiratory review: rivista ufficiale della European Respiratory Society. 2017; 26 (143).
- Fedullo P, Kerr KM, Kim NH, Auger WR: Ipertensione polmonare cronica tromboembolica. Rivista americana di medicina respiratoria e di assistenza critica. 2011;183(12):1605–1613.
- Quarck R, Wynants M, Verbeken E, et al.: Contributo dell’infiammazione e dell’angiogenesi compromessa alla patobiologia dell’ipertensione polmonare cronica tromboembolica. La rivista europea di respirazione. 2015;46(2): 431-443.
- Rehman MB, Garcia R, Christiaens L, et al: Potere delle misurazioni ecocardiografiche a riposo per classificare i pazienti con ipertensione polmonare in base ai cut-off di stratificazione del rischio del test da sforzo della European society of cardiology. Rivista internazionale di cardiologia. 2018;257: 291-297.
- Leblanc M, Leveillee F, Turcotte E: Valutazione prospettica del valore predittivo negativo della V/Q SPECT con 99mTc-tecnegas. Nucl Med Commun. 2007;28(8): 667-672.
- Gruning T, Drake BE, Farrell SL, Nokes T. Esperienza clinica di tre anni con la VQ SPECT per la diagnosi di embolia polmonare: prestazioni diagnostiche. Imaging clinico. 2014;38(6): 831-835.
- Gutte H, Mortensen J, Jensen CV, et al: Rilevamento dell’embolia polmonare con la SPECT combinata ventilazione-perfusione e la TAC a basso dosaggio: confronto testa a testa con l’angiografia TAC multidetettore. J Nucl Med. 2009;50(12): 1987-1992.
- Simanek M, Koranda P: Il vantaggio dell’imaging polmonare ibrido SPECT/CT personalizzato. Am J Nucl Med Mol Imaging. 2016;6(4): 215-222.
- Ley S, Ley-Zaporozhan J, Pitton MB, et al: Prestazioni diagnostiche delle tecniche di imaging all’avanguardia per la valutazione morfologica delle anomalie vascolari nei pazienti con ipertensione polmonare cronica tromboembolica (CTEPH). Eur Radiol. 2012; 22(3): 607-616.
- Reichelt A, Hoeper MM, Galanski M, Keberle M: Ipertensione polmonare cronica tromboembolica: valutazione con la TAC a 64 detector row rispetto all’angiografia digitale di sottrazione. Eur J Radiol. 2009;71(1): 49-54.
- Sugiura T, Tanabe N, Matsuura Y, et al: Ruolo della tomografia computerizzata 320-slice nel workup diagnostico dei pazienti con ipertensione polmonare cronica tromboembolica. Petto. 2013;143(4): 1070-1077.
- Jenkins D, Mayer E, Screaton N, Madani M: Stato dell’arte della diagnosi e della gestione dell’ipertensione polmonare cronica tromboembolica. European respiratory review: rivista ufficiale della European Respiratory Society. 2012;21(123): 32-39.
- Scheidl SJ, Englisch C, Kovacs G, et al: Diagnosi di CTEPH rispetto a IPAH utilizzando i gradienti capillari di anidride carbonica end-tidale. La rivista europea di respirazione. 2012;39(1): 119-124.
- Held M, Meintz S, Baron S, et al: Cura chirurgica dell’apnea centrale del sonno? American Journal of Respiratory and Critical Care Medicine (Rivista americana di medicina respiratoria e di assistenza critica) 2013; 188(3): 395-396.
- Held M, Grun M, Holl R, et al: Test da sforzo cardiopolmonare per rilevare l’ipertensione polmonare cronica tromboembolica nei pazienti con ecocardiografia normale. Respirazione. 2014;87(5): 379-387.
- Held M, Linke M, Jany B: Ecocardiografia e cateterismo cardiaco destro nell’ipertensione polmonare. Dtsch Med Wochenschr. 2014;139(30): 1511-1517.
- Lewczuk J, Piszko P, Jagas J, et al: Fattori prognostici nei pazienti trattati medicalmente con embolia polmonare cronica. Petto. 2001;119(3): 818-823.
- Kim NH, Delcroix M, Jenkins DP, et al: Ipertensione polmonare cronica tromboembolica. Giornale del Collegio Americano di Cardiologia. 2013;62(25 Suppl): D92-99.
- Madani MM, Auger WR, Pretorius V, et al: Endarterectomia polmonare: cambiamenti recenti nell’esperienza di una singola istituzione con oltre 2.700 pazienti. Gli Annali di Chirurgia Toracica. 2012;94(1): 97-103; discussione
- D’Armini AM, Morsolini M, Mattiucci G, et al: Endarterectomia polmonare per ipertensione polmonare cronica tromboembolica distale. J Thorac Cardiovasc Surg. 2014;148(3): 1005-1011; 12 e1-2; discussione 11-2.
- Madani MM: Trattamento chirurgico dell’ipertensione polmonare cronica tromboembolica: tromboendarterectomia polmonare. Methodist Debakey Cardiovasc J. 2016;12(4): 213-218.
- Berman M, Hardman G, Sharples L, et al: Endarterectomia polmonare: esiti nei pazienti di età >70. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 2012;41(6): e154-160.
- Cannon JE, Su L, Kiely DG, et al: Stratificazione dinamica del rischio di esito a lungo termine dei pazienti dopo l’endarterectomia polmonare: risultati della coorte nazionale del Regno Unito. Circolazione. 2016;133(18): 1761-1771.
- Archibald CJ, Auger WR, Fedullo PF, et al: Esito a lungo termine dopo la tromboendarterectomia polmonare. American journal of respiratory and critical care medicine (rivista americana di medicina respiratoria e di assistenza critica), 1999; 160(2): 523-528.
- Rahnavardi M, Yan TD, Cao C, et al: Tromboendarterectomia polmonare per l’ipertensione polmonare cronica tromboembolica: una revisione sistematica. Annali di chirurgia toracica e cardiovascolare: rivista ufficiale dell’Associazione dei chirurghi toracici e cardiovascolari dell’Asia. 2011;17(5): 435-445.
- Condliffe R, Kiely DG, Gibbs JS, et al.: Migliori risultati nell’ipertensione polmonare cronica tromboembolica trattata medicalmente e chirurgicamente. American journal of respiratory and critical care medicine (Rivista americana di medicina respiratoria e di assistenza critica) 2008; 177(10): 1122-1127.
- Mahmud E, Behnamfar O, Ang L, et al: Angioplastica polmonare con palloncino per l’ipertensione polmonare cronica tromboembolica. Interv Cardiol Clin. 2018;7(1): 103-117.
- Mayer E: Trattamento chirurgico e post-operatorio dell’ipertensione polmonare cronica tromboembolica. European respiratory review: rivista ufficiale della European Respiratory Society. 2010;19(115): 64-67.
- Moser KM, Bloor CM: Lesioni vascolari polmonari che si verificano nei pazienti con ipertensione polmonare cronica tromboembolica dei vasi maggiori. Petto. 1993;103(3): 685-692.
- Ghofrani HA, D’Armini AM, Grimminger F, et al: Riociguat per il trattamento dell’ipertensione polmonare cronica tromboembolica. The New England journal of medicine 2013; 369(4): 319-329.
- Simonneau G, D’Armini AM, Ghofrani HA, et al: Predittori degli esiti a lungo termine nei pazienti trattati con riociguat per l’ipertensione polmonare cronica tromboembolica: dati dello studio CHEST-2 open-label, randomizzato, con estensione a lungo termine. Lancet Respir Med. 2016;4(5): 372-380.
- Ghofrani HA, Simonneau G, D’Armini AM, et al: Macitentan per il trattamento dell’ipertensione polmonare tromboembolica cronica non operabile (MERIT-1): risultati dello studio multicentrico, di fase 2, randomizzato, in doppio cieco, controllato con placebo. Lancet Respir Med. 2017;5(10): 785-794.
- Konstantinides SV, Torbicki A, Agnelli G, et al: Linee guida ESC 2014 sulla diagnosi e la gestione dell’embolia polmonare acuta. Eur Heart J. 2014;35(43): 3033-3069, 69a-69k.
- Konstantinides SV, Torbicki A, Agnelli G, et al: Rettifica a: Linee guida ESC 2014 sulla diagnosi e la gestione dell’embolia polmonare acuta. Eur Heart J. 2015;36(39): 2642.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2020; 2(2): 12-15.