La perdita della funzione renale può portare all’accumulo di tossine uremiche o a cambiamenti pericolosi per la vita nel bilancio elettrolitico e di volume. Questo sviluppo negativo può essere contrastato con diverse procedure di dialisi.
L’insufficienza renale acuta o cronica può essere causata da diversi fattori. Se la perdita della funzione renale porta ad un accumulo di tossine uremiche o a spostamenti elettrolitici e di volume pericolosi per la vita, la dialisi viene utilizzata come procedura di sostituzione del rene. L’emodialisi (HD) si basa sul principio fisico della diffusione, che rimuove le molecole di piccole dimensioni dal sangue lungo il loro gradiente di concentrazione attraverso una membrana semipermeabile. L’emofiltrazione (HF), invece, si basa sulla convezione, che elimina l’acqua plasmatica attraverso la differenza di pressione transmembrana (ultrafiltrato) e rimuove le molecole disciolte in essa (“solvent drag”). L’emodiafiltrazione (HDF) combina i principi di diffusione e convezione.
Dialisi per insufficienza renale acuta
L’insufficienza renale acuta (ANV) è una delle complicanze più comuni nei pazienti ricoverati, che si verifica fino al 20% di tutti i casi. Particolarmente a rischio sono i pazienti critici in terapia intensiva con sepsi o interventi chirurgici importanti, i pazienti con insufficienza renale preesistente e quelli con malattie croniche di altri organi (ad esempio, insufficienza cardiaca o diabete mellito) [1]. La comparsa di ANV è un fattore prognostico indipendente; un aumento della creatinina di 26,5 µmol/l è già associato a un raddoppio della mortalità.
Le indicazioni per la dialisi d’emergenza sono gli sbalzi elettrolitici pericolosi per la vita, in particolare l’iperkaliemia (potassio >6,5 mmol/l e/o alterazioni dell’ECG), il sovraccarico di volume (edema polmonare), la grave acidosi metabolica (pH <7,1), complicazioni dell’uremia (pericardite) o intossicazioni con sostanze dializzabili (ad esempio salicilati, alcoli). Le indicazioni relative per la dialisi sono gli sbalzi elettrolitici refrattari e il sovraccarico di volume o l’iperuricemia grave, come avviene nella sindrome da lisi tumorale (tab. 1).

Molti studi sostengono che nei pazienti con ANV senza indicazioni di emergenza, l’inizio precoce della dialisi subito dopo la diagnosi non fornisce un beneficio significativo in termini di sopravvivenza [2,3]. Pochi dati suggeriscono un beneficio dell’uso precoce della dialisi [4]. Tuttavia, l’insorgenza ritardata può offrire la possibilità di un recupero renale spontaneo senza ricorrere a procedure di sostituzione renale [2,3]. A causa dei dati controversi, le linee guida KDIGO (“Kidney Disease: Improving Global Outcomes”) non raccomandano un tempo specifico o una soglia specifica di creatinina o urea per l’inizio della dialisi [5].
La durata media di una procedura di dialisi nel contesto di un’ANV è di 12-13 giorni [6]. Per questo motivo, come accesso temporaneo si raccomanda un catetere centrale a doppio lume, non stunnellato, preferibilmente nella vena giugulare destra [5]. A differenza della dialisi ambulatoriale per i pazienti cronici, per l’ANV sono disponibili anche procedure di dialisi continua (oltre le 24 ore), oltre al trattamento intermittente (da due a quattro ore ogni 1-2 giorni). I vantaggi della dialisi continua sono il prelievo di fluidi e di molecole dializzabili più lento e, quindi, più facile da far circolare. I vantaggi della dialisi intermittente sono la rapida rimozione delle tossine nei casi di intossicazione e il tempo di trattamento limitato, che consente un migliore coordinamento con la diagnostica o le terapie interventistiche. È importante notare che i dosaggi dei farmaci sono adattati alla rispettiva modalità. Questo è fondamentale per gli antibiotici, ad esempio.
Diversi studi e meta-analisi non mostrano differenze significative nella mortalità o nella durata della degenza ospedaliera dei pazienti in dialisi continua rispetto a quelli in dialisi intermittente. È interessante notare, tuttavia, che viene ripetutamente postulato un recupero renale più rapido dopo l’uso della dialisi continua, sebbene studi recenti non lo confermino [7]. Pertanto, le raccomandazioni KDIGO indicano i metodi intermittenti e continui come equivalenti. La dialisi continua è raccomandata solo nei pazienti emodinamicamente instabili e in quelli che presentano un aumento della pressione intracranica o un edema cerebrale [5].
La stima della dose dialitica adeguata nel contesto di un’ANV è complessa perché le condizioni metaboliche dei pazienti cambiano ogni giorno. La dose dialitica ottimale dell’emodialisi intermittente è data dalla clearance dell’urea (Kt/V = clearance dell’urea × tempo per volume di distribuzione dell’urea); la KDIGO raccomanda un Kt/V di 3,9 a settimana per l’ANV [5]. L’intensità di trattamento della dialisi continua, invece, è indicata dal tasso di efflusso totale (tasso di ultrafiltrato e volume di efflusso del dialisato). In base a diversi studi, si raccomanda un tasso di scarico totale di 20-25 ml/kg/h [5,6]. Una terapia più intensiva non porta a nessun vantaggio in termini di sopravvivenza o di recupero renale più rapido, né nella dialisi intermittente né in quella continua [6], ed è addirittura dannosa nei pazienti settici. È importante prescrivere una dose più elevata, poiché la dose effettiva somministrata può discostarsi fino al 20% dalla dose target a causa di interruzioni della terapia causate, ad esempio, da problemi di accesso o instabilità emodinamica.
Pertanto, nell’ambito di un’ANV, il contesto clinico, la malattia di base e la presenza di altre disfunzioni d’organo sono fondamentali per prescrivere la dialisi giusta per ogni paziente in base alle circostanze individuali.
Dialisi per l’insufficienza renale cronica
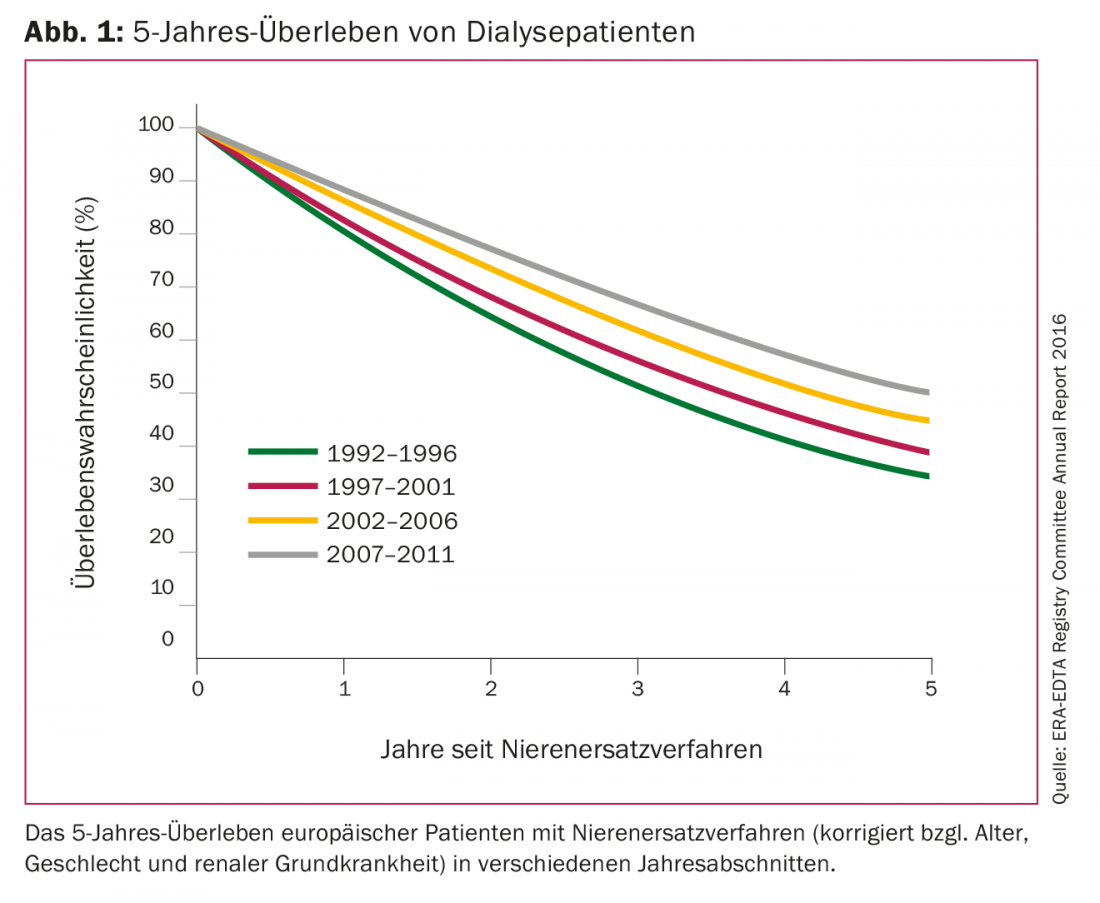
La mortalità dei pazienti in dialisi cronica è da dieci a venti volte superiore a quella della popolazione generale corrispondente all’età. Le malattie cardiovascolari sono considerate la causa principale di morte. Secondo lo United States Renal Data System, la mortalità a 1 anno dei pazienti in dialisi negli Stati Uniti nel 2016 era di poco inferiore al 20%, paragonabile alle cifre dei tumori maligni. Tra i pazienti europei in dialisi, la sopravvivenza a 5 anni era solo del 35% 25 anni fa; nel 2011 era salita a poco meno del 50%. (Fig. 1). Diverse nuove scoperte nel campo della dose ottimale, della frequenza e delle procedure di dialisi, nonché della biocompatibilità delle membrane filtranti e dello sviluppo dell’eritropoietina ricombinante hanno contribuito a questo significativo miglioramento della sopravvivenza dei pazienti.
Nel primo studio controllato e randomizzato in nefrologia, nel 1980 è stata studiata per la prima volta la dose ottimale di dialisi ed è stato introdotto un Kt/V >1,0 per trattamento come dose minima target [8]. Dati recenti confermano un aumento significativo della mortalità con un Kt/V <1,2 per dialisi [9] e rafforzano l’associazione di una migliore sopravvivenza del paziente con una dose di dialisi più elevata. Tuttavia, lo studio di riferimento HEMO non mostra alcun ulteriore beneficio in termini di sopravvivenza con un Kt/V >1,3 per trattamento, sebbene siano state evidenziate alcune carenze relative alla metodologia utilizzata nello studio (popolazione giovane, effetto carry-over) [10]. In sintesi, un Kt/V >1,2 per dialisi è ora raccomandato come dose di dialisi a cui mirare [11].
La terapia di dialisi standard in tutto il mondo comprende tre trattamenti alla settimana, ciascuno dei quali dura dalle tre alle cinque ore. La terapia più intensiva è definita come ≥5 dialisi alla settimana, di durata breve (<3 ore), regolare (3-5 ore) o lunga (>5 ore) [11]. Il Frequent Hemodialysis Network (FHN) ha pubblicato tre studi randomizzati, ciascuno dei quali ha confrontato i trattamenti intensivi (6×/settimana di 1,5-3 ore; 6×/settimana di >6 ore/notte; e 5-6×/settimana di >6 ore/notte) con la frequenza standard. Tutti hanno mostrato un miglioramento significativo della qualità della vita, una riduzione dell’ipertrofia ventricolare sinistra e un migliore controllo dell’ipertensione arteriosa e dell’iperfosfatemia nelle coorti con trattamento più intensivo. Questi pazienti, invece, hanno avuto interventi più frequenti dell’accesso vascolare. È interessante notare che le osservazioni a lungo termine mostrano un vantaggio di sopravvivenza solo nelle coorti con dialisi giornaliera di durata regolare. Tuttavia, i fattori metodologici che influenzano gli studi sono criticabili (numero ridotto di pazienti, bassa potenza statistica). La dialisi notturna più intensa accelera la perdita della funzione renale residua. Ciò è di notevole importanza nei pazienti in dialisi, non solo per l’eliminazione di molecole di piccole e medie dimensioni, ma anche in termini di prognosi [12]. Pertanto, la diuresi residua è un parametro cruciale per una terapia dialitica ottimale. Sulla base di ciò, negli ultimi anni si è sviluppato il concetto di dialisi incrementale. Se la funzione residua è ancora conservata, si iniziano prima uno o due trattamenti alla settimana e si introduce la dose standard di tre volte alla settimana solo quando si raggiunge la clearance dell’urea <3 ml/min/1,73 m2 o la diuresi residua <600 ml/giorno [12]. I pazienti con poche comorbidità, lievi disturbi elettrolitici e equilibrio volumetrico compensato hanno maggiori probabilità di beneficiare di questa prescrizione dialitica personalizzata.
In passato, il momento ottimale per iniziare una procedura di sostituzione renale era quando si verificava un calo della velocità di filtrazione glomerulare (GFR) <15 ml/min/1.73 m2 e/o segni di uremia. Tuttavia, lo studio IDEAL non mostra alcun beneficio in termini di sopravvivenza dall’inizio precoce della dialisi (GFR 10-14 ml/min/1.73m2 contro 5-7 ml/min/1.73 m2) [13], quindi si può prendere in considerazione l’attesa fino a un GFR di 7 ml/min/1.73 m2 e/o sintomi di uremia. Occorre prestare particolare attenzione ai pazienti anziani, che costituiscono una percentuale crescente della popolazione in dialisi. La qualità della vita non differisce tra l’inizio precoce e tardivo della dialisi [13], ma l’inizio della dialisi negli anziani porta a un marcato aumento della mortalità e a un rapido declino dell’indipendenza [14].
Inoltre, l’emodiafiltrazione (online-HDF) è stata sempre più studiata negli ultimi anni, nella speranza di migliorare la sopravvivenza dei pazienti in dialisi con un’eliminazione più efficace delle molecole di medie dimensioni. Un’analisi congiunta di quattro studi prospettici randomizzati mostra una riduzione significativa della mortalità per tutte le cause e della mortalità cardiovascolare nei pazienti in dialisi con HDF rispetto all’HD ad alto flusso, secondo il sito [15]. Tuttavia, questo effetto si nota solo a partire da un volume di convezione di almeno 23 litri per trattamento ed è significativamente evidente dopo la standardizzazione all’intera superficie corporea. Tuttavia, per ottenere i volumi di convezione elevati, sono necessari un flusso sanguigno corrispondente (>300 ml/min) e un tempo di dialisi più lungo, che presuppone un buon accesso vascolare.
Inoltre, lo sviluppo dell’eritropoietina ricombinante alla fine degli anni ’80 rappresenta un progresso rivoluzionario nel trattamento dei pazienti in dialisi. In precedenza, i pazienti in dialisi presentavano regolarmente livelli di emoglobina bassi, pari a 60-80 g/l, che richiedevano ripetute trasfusioni di sangue ed erano associati a rischi di morbilità corrispondenti. Con l’uso dell’eritropoietina ricombinante, è stato riscontrato in breve tempo un miglioramento dei sintomi associati all’anemia e della qualità di vita, nonché una riduzione evidente della necessità di trasfusioni. Quattro studi di riferimento hanno analizzato il livello di emoglobina target e il suo impatto sulla mortalità nei pazienti con insufficienza renale cronica. In sintesi, si osserva un aumento degli eventi tromboembolici e dei decessi cardiovascolari quando l’emoglobina si normalizza a ≥130 g/l. Pertanto, le linee guida più recenti raccomandano un livello di emoglobina di 110-115 g/l come obiettivo per i pazienti in dialisi [16].
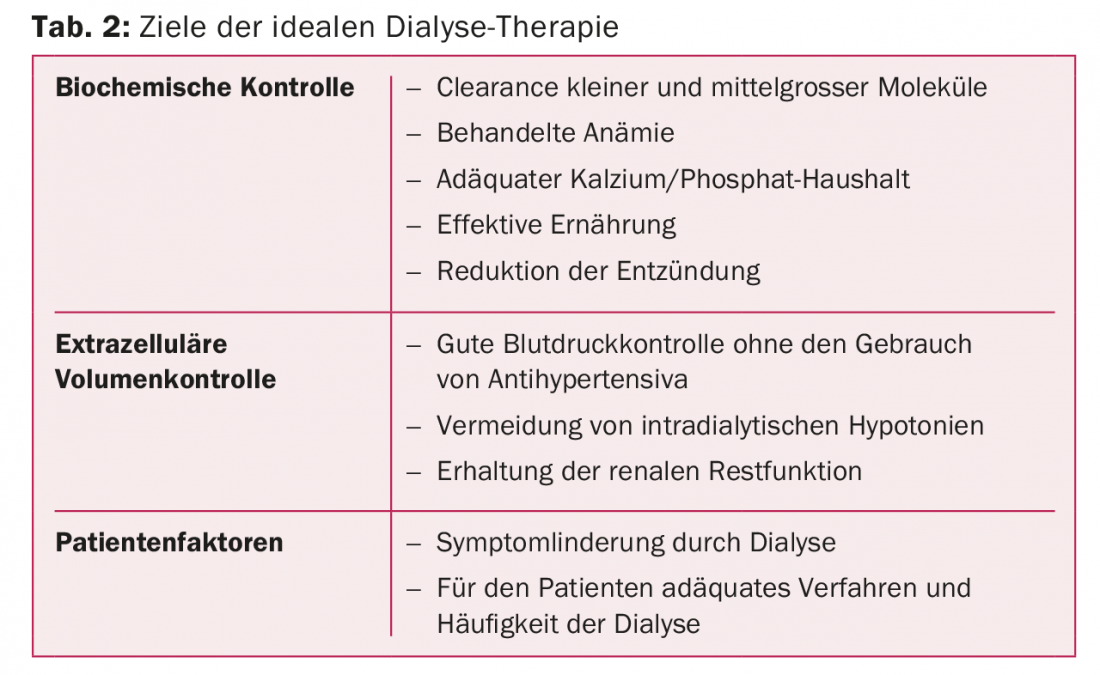
È quindi fondamentale che la dialisi giusta sia pianificata e programmata individualmente per ogni paziente, al fine di migliorare la sopravvivenza del paziente senza compromettere la qualità della vita. Le caratteristiche della dialisi ideale sono elencate nella tabella 2.
Messaggi da portare a casa
- Nel contesto della dialisi acuta, non c’è alcun vantaggio di sopravvivenza per la dialisi intermittente rispetto a quella continua. Una procedura continua è raccomandata nei pazienti emodinamicamente instabili e in quelli con un aumento della pressione intracranica.
- L’inizio precoce della dialisi non è associato a una migliore sopravvivenza né nella terapia dialitica acuta né in quella cronica.
- La funzione renale residua è prognosticamente rilevante e consente una prescrizione dialitica personalizzata.
- Il vantaggio in termini di sopravvivenza dell’emodiafiltrazione è visibile solo nei pazienti in dialisi cronica da un volume di convezione di >23 litri per sessione.
Letteratura:
- Rewa O, Bagshaw SM: Lesioni renali acute: epidemiologia, esiti ed economia. Nat Rev Nephrol 2014; 10: 193-207.
- Gaudry S, et al: Strategie di avvio della terapia renale sostitutiva nell’unità di terapia intensiva. N Engl J Med 2016; 375: 122-133.
- Barbar SD, et al: Tempistica della terapia renale sostitutiva nei pazienti con lesione renale acuta e sepsi. N Engl J Med 2018; 379: 1431-1442.
- Zarbock A, et al.: Effetto dell’inizio precoce o ritardato della terapia renale sostitutiva sulla mortalità nei pazienti critici con lesioni renali acute: lo studio clinico randomizzato ELAIN. JAMA 2016; 315(20): 2190-2199.
- Khwaja A: Linee guida di pratica clinica KDIGO per il danno renale acuto. Nephron Clin Pract 2012; 120(4): c179-184.
- Palevsky PM, et al: Intensità del supporto renale nei pazienti critici con danno renale acuto. N Engl J Med 2008; 359: 7-20.
- Liang KV, et al: Modalità di RRT e recupero della funzione renale dopo AKI nei pazienti che sopravvivono alla dimissione ospedaliera. Clin J Am Soc Nephrol 2016; 11(1): 30-38.
- Lowrie EG, et al: Effetto della prescrizione emodialitica sulla morbilità dei pazienti: rapporto del National Cooperative Dialysis Study. N Engl J Med 1981; 305(20): 1176-1181.
- Port FK, et al: Stime DOPPS degli anni di vita dei pazienti attribuibili alle pratiche di emodialisi modificabili negli Stati Uniti. Blood Purif 2004; 22(1): 175-180.
- Eknoyan G, et al.: Effetto della dose di dialisi e del flusso di membrana nell’emodialisi di mantenimento. N Engl J Med 2002; 347: 2010-2019.
- National Kidney Foundation: KDOQI Clinical Practice Guideline for Hemodialysis Adequacy: aggiornamento 2015. Am J Kidney Dis 2015; 66(5): 884-930.
- Obi Y, et al: Emodialisi incrementale, funzione renale residua e rischio di mortalità nei pazienti in dialisi incidentale: uno studio di coorte. Am J Kidney Dis 2016; 68(2): 256-265.
- Cooper BA, et al: Uno studio randomizzato e controllato sull’inizio precoce o tardivo della dialisi. N Engl J Med 2010; 363: 609-619.
- Kurella Tamura M, et al: Stato funzionale degli adulti anziani prima e dopo l’inizio della dialisi. N Engl J Med 2009; 361(16): 1539-1547.
- Peters SA, et al: Emodiafiltrazione e mortalità nei pazienti con malattia renale in fase terminale: un’analisi dei dati individuali dei partecipanti di quattro studi randomizzati e controllati. Nephrol Dial Transplant 2016; 31(6): 978-984.
- Malattia renale che migliora i risultati globali (KDIGO): Linee guida di pratica clinica KDIGO per l’anemia nella malattia renale cronica. Kidney International Supplements 2012; 2(4).
Un elenco completo di tutte le fonti utilizzate è disponibile su richiesta.
CARDIOVASC 2018; 17(6): 8-12