In Svizzera, l’approvazione del biologico altamente efficace Dupilumab nell’area di indicazione della dermatite atopica è stata finora limitata ai pazienti adulti e adolescenti di età pari o superiore ai 12 anni. L’anticorpo monoclonale convince con un sollievo rapido e duraturo dei sintomi e aumenta in modo dimostrabile la qualità di vita delle persone affette da neurodermite. Nell’UE, alcuni mesi fa è stata concessa un’estensione dell’indicazione per il gruppo di età 6-11 anni, sulla base di studi di fase III corrispondenti. Che dupilumab sia efficace e sicuro anche nei bambini in età prescolare è dimostrato dai dati pubblicati di recente dallo studio LIBERTY AD-PRESCHOOL.
I pazienti con dermatite atopica soffrono di una qualità di vita notevolmente ridotta, soprattutto quando la malattia è grave. Il prurito lancinante è molto sgradevole, può portare a disturbi del sonno e, soprattutto nei bambini e negli adolescenti, può contribuire a difficoltà di concentrazione e di apprendimento. Inoltre, i pazienti si sentono molto stigmatizzati dai cambiamenti visibili della pelle. L’obiettivo principale della terapia è alleviare il prurito e trattare le alterazioni infiammatorie della pelle. La terapia orientata alle linee guida viene eseguita in modo graduale. La terapia sistemica è consigliata per l’eczema persistente e grave che non risponde adeguatamente agli agenti topici.
Per i ragazzi dai 12 ai 17 anni, regime di dosaggio adattato al peso
L’anticorpo monoclonale dupilumab blocca la trasduzione del segnale delle interleuchine 4 e 13, la cui espressione è correlata all’attività della malattia nelle persone con dermatite atopica. Dupilumab (Dupixent®) è disponibile nel dosaggio prescritto come siringa pre-riempita e può essere somministrato per via sottocutanea dai pazienti stessi, previa istruzione medica [1]. Per gli adulti con dermatite atopica da moderata a grave, Dupixent® è stato approvato in Svizzera dal 2019. Nel novembre 2020, Swissmedic ha concesso un’estensione dell’indicazione per gli adolescenti a partire dai 12 anni. Dupixent® è indicato quando la terapia con farmaci topici da prescrizione non fornisce un controllo adeguato della malattia o non è raccomandata [1]. La condizione per la copertura dei costi da parte dell’assicurazione sanitaria è la limitazione che il trattamento con almeno un immunosoppressore convenzionale non abbia ottenuto un effetto sufficiente. Negli adulti, dupilumab viene somministrato alla dose iniziale di 600 mg (2× 300 mg) e poi 300 mg a intervalli di due settimane. Nei pazienti di età compresa tra 12 e 17 anni, l’intervallo di somministrazione è anch’esso di due settimane e il regime di dosaggio è adattato al peso: negli adolescenti con un peso corporeo <60 kg, la dose iniziale è di 400 mg (2× 200 mg), poi 200 mg a intervalli di 2 settimane. Negli adolescenti con un peso corporeo ≥60 kg, si raccomanda una dose iniziale di 600 mg (2× 300 mg), seguita da 300 mg a intervalli di due settimane [1].
Già approvato nell’UE per i bambini dai 6 agli 11 anni e
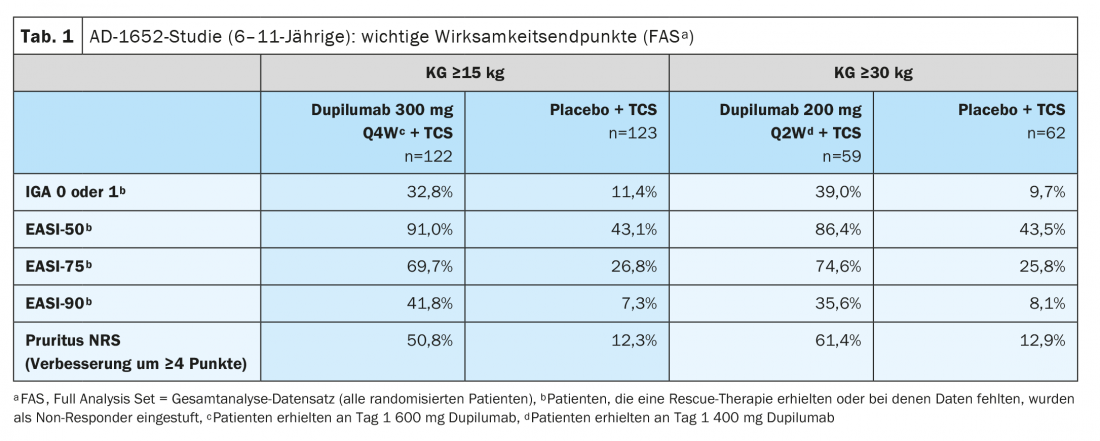
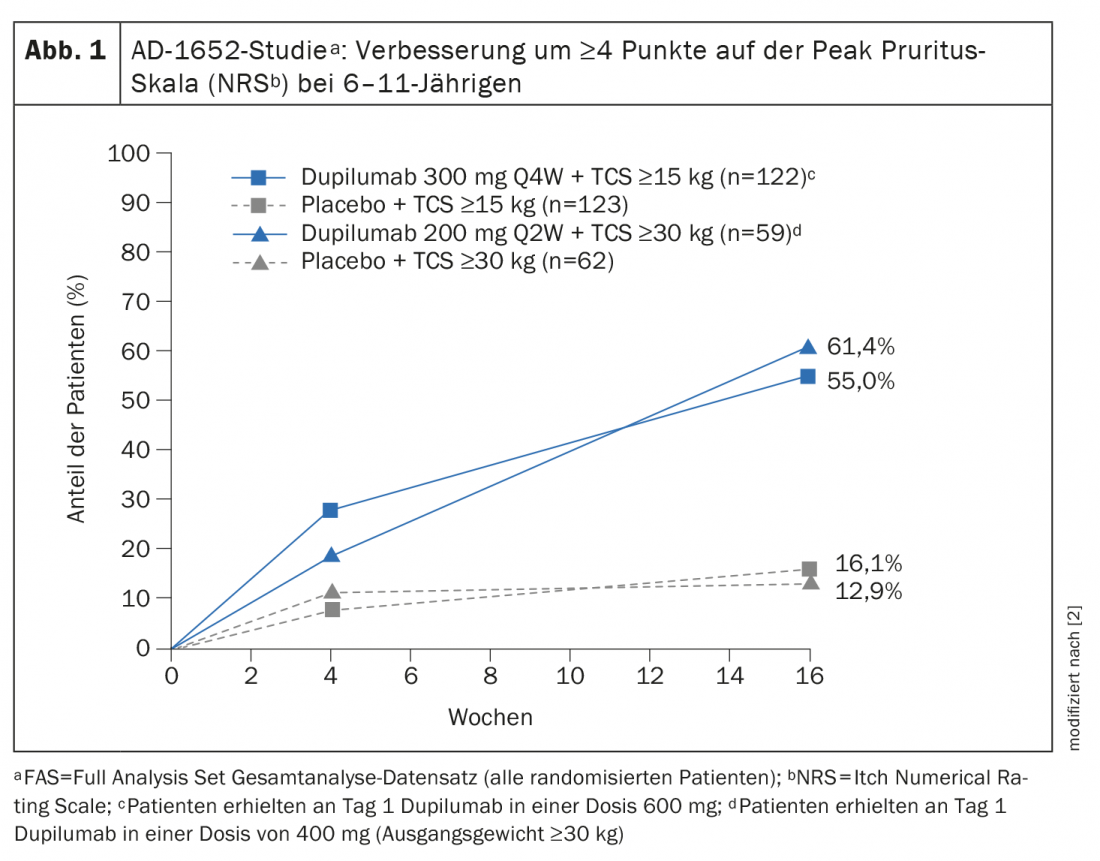
La Commissione europea ha concesso l’autorizzazione all’immissione in commercio di dupilumab per i bambini a partire dai 6 anni di età nel novembre 2020 [2,3]. L’estensione dell’indicazione si basa sui dati dello studio randomizzato, in doppio cieco AD-1652, che ha analizzato l’efficacia e la sicurezza di dupilumab in combinazione con la TCS in 367 pazienti di età compresa tra 6 e 11 anni. I risultati di importanti endpoint di efficacia sono riportati nella tabella 1 [2]. L’endpoint co-primario era la percentuale di pazienti con IGA* 0 o 1 (senza aspetto o quasi) con un miglioramento di ≥2 punti e la percentuale di pazienti con EASI-75 (miglioramento EASI di almeno il 75%) tra il basale e la settimana 16. I risultati stratificati in base al peso basale hanno mostrato per i partecipanti allo studio con un KG di 15-29,9 kg trattati con dupilumab 300 mg Q4Wd#+ TCS, il 32,8% aveva una pelle priva di aspetto o quasi priva di aspetto (IGA 0 o 1), mentre questa percentuale era dell’11,4% nei partecipanti allo studio trattati con placebo più TCS. Nei pazienti ≥30 kg che hanno ricevuto 200 mg di dupilumab ogni due settimane, la percentuale è stata del 39,0% rispetto al 9,7%. Un miglioramento del 75% nell’aspetto della pelle secondo l’Eczema Area and Severity Index (EASI-75) è stato raggiunto dal 69,7% e dal 74,6% dei pazienti trattati con dupilumab, rispettivamente, rispetto al 26,8% e al 25,8% dei gruppi placebo. Dupilumab+TCS si è dimostrato chiaramente superiore al placebo+TCS in termini di riduzione dello SCORAD e di miglioramento dell’NRS. Più della metà dei pazienti nei gruppi dupilumab ha ottenuto un miglioramento di ≥4 punti nell’NRS, mentre nei gruppi placebo questa percentuale era del 12,9% o meno. 16,1% (Fig. 1).
* IGA = Valutazione Globale dello Sperimentatore
#
Q4Wd = Intervallo di dosaggio di 4 settimane
Pazienti di età compresa tra 6 mesi e 5 anni: nuovi dati promettenti
La dermatite atopica inizia solitamente tra il 3° e il 6° mese di vita, con il 60% dei pazienti che si ammalano nel 1° anno di vita. Entro il 5° anno di vita, la malattia si manifesta nel 90% dei pazienti [4]. Lo studio di fase III LIBERTY AD PRESCHOOL ha confermato l’efficacia e il profilo di sicurezza consolidati di Dupixent® in altre fasce d’età nei bambini di età compresa tra 6 mesi e 5 anni con dermatite atopica da moderata a grave. Tutti gli endpoint primari e secondari sono stati soddisfatti. I dati dimostrano che l’aggiunta di dupilumab al trattamento standard con corticosteroidi topici (TCS) ha ridotto significativamente la gravità complessiva della malattia e ha migliorato la clearance cutanea, il prurito e la qualità di vita correlata alla salute dopo 16 settimane rispetto al solo TCS. Durante il periodo di trattamento di 16 settimane, il tasso complessivo di eventi avversi (AEs) è stato del 64% per dupilumab e del 74% per il placebo. Le EAU più comuni comprendevano nasofaringite (8% dupilumab, 9% placebo), infezioni del tratto respiratorio superiore (6% dupilumab, 8% placebo) e congiuntivite (5% dupilumab, 0% placebo), infezioni da herpes virus (6% dupilumab, 5% placebo) e reazioni al sito di iniezione (2% dupilumab, 3% placebo). In sintesi, i risultati di sicurezza di questo studio sono coerenti con il profilo di sicurezza noto di dupilumab nella dermatite atopica.
Letteratura:
- Brevi informazioni tecniche: Dupixent®, www.swissmedicinfo.ch (ultimo accesso 19.11.2021)
- Agenzia Europea dei Medicinali (EMA), www.ema.europa.eu/en/documents/product-information/dupixent-epar-product-information_de.pdf (ultimo accesso 19.11.2021)
- “Dupixent® (dupilumab) approvato dalla Commissione Europea come primo e unico farmaco biologico per i bambini di età compresa tra 6 e 11 anni con dermatite atopica grave”, Sanofi, 30.11.2021
- Barbarot S, et al: Epidemiologia della dermatite atopica negli adulti: risultati di un’indagine internazionale. Allergia 2018; 73(6): 1284-1293.
PRATICA DERMATOLOGICA 2021; 31(6): 41-42