Gli studi clinici interventistici possono essere suddivisi in fase I, II e III. Finora, tutto bene. Ma cosa significa esattamente? Ecco un breve aggiornamento per tutti coloro che non sono direttamente coinvolti nella ricerca clinica e il cui tempo di studio risale a un po’ più di tempo fa.
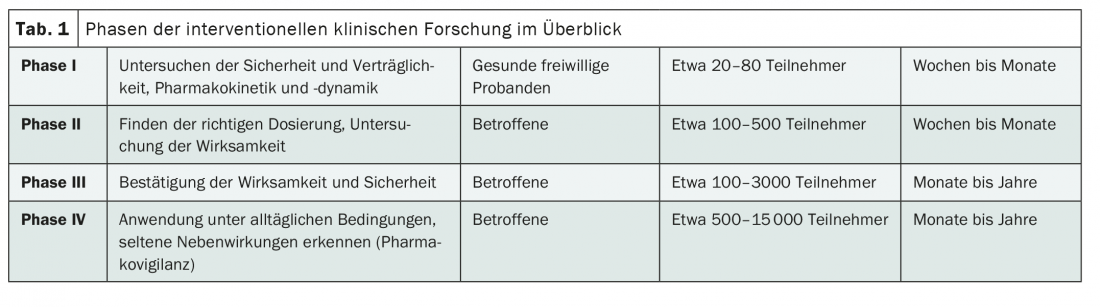
Ogni studio di intervento – cioè ogni studio in cui i partecipanti ricevono una forma attiva di trattamento – può essere assegnato a una fase di sviluppo specifica dell’intervento da testare, per esempio il farmaco in fase di sperimentazione. (Tab.1). In particolare, l’obiettivo è quello di proteggere i partecipanti allo studio da possibili effetti avversi e di permettere di caratterizzare l’intervento nel modo più accurato possibile in soggetti diversi. A proposito, questo non ha nulla a che fare con la randomizzazione, non tutti gli studi di fase III sono automaticamente studi controllati e randomizzati.
Passo dopo passo, da I a III
Classicamente, i test preclinici di un intervento sono seguiti – come suggerisce il nome – da una sperimentazione di fase I. L’intervento o il farmaco viene testato per la prima volta sugli esseri umani. L’attenzione si concentra qui sulla compatibilità dei test [1]. Di solito, uno studio di fase I coinvolge alcune decine di volontari sani. La farmacocinetica e la farmacodinamica a diverse dosi sono state studiate in dettaglio. In questo modo, è possibile raccogliere i primi risultati sugli effetti collaterali negli esseri umani e sui dosaggi adeguati [1].
Solo nella seconda fase ci si concentra sull’efficacia. Questo coinvolge per la prima volta le persone affette dalla malattia, il che rende indispensabile la collaborazione tra le aziende farmaceutiche e le organizzazioni di ricerca clinica con le cliniche. Di solito vengono inclusi circa 100-500 pazienti – con o senza un gruppo di controllo, con o senza cecità [1].
Negli studi clinici più ampi, quelli di fase III, l’intervento viene poi idealmente testato su diverse migliaia di pazienti. Si sta verificando se l’efficacia e la tollerabilità possono essere riprodotte in un’ampia popolazione di studio. Anche le analisi di sottogruppo sono importanti in questo caso, in quanto possono fornire informazioni su quali pazienti traggono particolare beneficio – e quali tendono a trarre meno beneficio – dall’intervento. Gli studi di fase III sono spesso studi comparativi con le terapie esistenti e/o con il placebo [1]. Questi sono anche i più significativi. Più avanzato è lo sviluppo di un intervento e più grande è lo studio, più è importante pianificare con largo anticipo. I punti finali devono essere determinati e la valutazione statistica deve essere il più accurata possibile. Questo perché, ad esempio, di solito non è possibile recuperare i dati raccolti da più di 1000 pazienti.
A seconda dell’intervento e della malattia, gli studi di fase III possono essere difficili da condurre. Questo è il caso di malattie molto rare, tra le altre. Ci sono anche casi in cui gli studi randomizzati controllati di fase III sono difficilmente giustificabili dal punto di vista etico – ad esempio, se un’elevata efficacia clinica è già evidente nella seconda fase . A causa di questo problema, i farmaci vengono ripetutamente approvati prima che vengano completati i relativi studi di fase III, il che è attualmente un tema caldo in oncologia. Spesso, l’inclusione in una sperimentazione clinica è ciò che dà accesso a un farmaco (non approvato) in primo luogo. Da un lato, questo può salvare delle vite, ma è anche una lotteria – e un motivo per indirizzare i pazienti corrispondenti a centri specializzati che partecipano a studi clinici. In generale, il percorso dalla sperimentazione di fase I all’approvazione è lungo e ha una scarsa probabilità di successo, appena inferiore al 10%. E questo si dimezza al 5,1% nello sviluppo di farmaci antitumorali. La maggior parte degli studi viene interrotta nella fase II [2].
Da non dimenticare: Fase 0 e IV
Sebbene lo sviluppo clinico si concentri solitamente sulla fase I-III, anche gli studi di fase 0 e IV svolgono un ruolo importante nell’innovazione medica. Mentre le sperimentazioni di fase 0 comportano l’esame di materiale umano, quelle di fase IV si svolgono dopo l’approvazione del mercato. Questi ultimi sono quindi limitati alle indicazioni, ai dosaggi e alle forme di somministrazione approvate. Tra l’altro, la dimensione della popolazione consente di rilevare effetti collaterali rari [3].
Letteratura:
- Fase clinica. www.interpharma.ch/themen/fuhrend-in-forschung-entwicklung/der-weg-eines-medikaments/klinische-phase-phase-i-ii-iii (ultimo accesso 21.11.2021).
- Thomas DW, et al.: Clinical Development Success Rates 2006-2015. www.bio.org/sites/default/files/legacy/bioorg/docs/Clinical%20Development%20Success%20Rates%202006-2015%20-%20BIO,%20Biomedtracker,%20Amplion%202016.pdf (letzter Zugriff am 21.11.2021).
- Fasi dello studio. www.dimdi.de/dynamic/de/glossar/glossareintrag/Studienphasen (ultimo accesso 21.11.2021).
- Quali tipi di studi clinici esistono? www.viomedo.de/posts/welche-arten-von-klinischen-studien-gibt-es (ultimo accesso 21.11.2021).
InFo ONCOLOGIA ED EMATOLOGIA 2021; 9(6): 42











