Al Congresso EHA di Milano, il mieloma multiplo è stato al centro di diversi eventi. Quali risultati producono attualmente gli inibitori del proteasoma e i farmaci immunomodulatori e cosa promettono per il futuro? Come si può migliorare la situazione terapeutica dei pazienti anziani? Tre esperti hanno fornito informazioni in merito.
(ag) Parlando dell’uso della pomalidomide nel mieloma multiplo avanzato recidivato e refrattario (rrMM), il Prof. Meletios Dimopoulos, MD, Atene, Grecia, ha dichiarato: “Sulla base delle evidenze attualmente disponibili, la pomalidomide e il desametasone a basso dosaggio sono ben tollerati nel rrMM e rappresentano un’opzione terapeutica efficace per i pazienti che hanno esaurito la terapia con lenalidomide e bortezomib”. La dose iniziale ottimale è di 4 mg/tgl. Pomalidomide nei giorni 1-21 di ogni ciclo di 28 giorni, indipendentemente dalle comorbidità. Secondo il Prof. Dimopoulos, non è necessario utilizzare il dosaggio di 4 mg/tgl. adeguarsi alla compromissione della funzione renale da lieve a moderata (CrCl ≥45 ml/min). Tuttavia, è necessario un attento monitoraggio degli effetti collaterali. Il desametasone viene somministrato in una dose di 40 mg alla settimana. Per i pazienti di età superiore ai 75 anni, ridurre a 20 mg.
“Il trattamento deve essere continuato fino alla progressione o alla comparsa di tossicità inaccettabili. La modifica del dosaggio è possibile nei pazienti che presentano neutropenia, trombocitopenia e altri eventi avversi di grado 3 – 4. La profilassi deve essere presa in considerazione per prevenire le infezioni e il tromboembolismo venoso (TEV)”, dice l’esperto. Uno di questi include, ad esempio, la somministrazione di fattore stimolante le colonie di granulociti (G-CSF) nei cicli 1-3 per prevenire la neutropenia, antibiotici (cicli 1-3) per ridurre il rischio di infezione e tromboprofilassi (aspirina ed eparina frazionata a basso peso molecolare in caso di rischio elevato) per ridurre al minimo il rischio di TEV in tutti i pazienti.
Paesaggio terapeutico 2014
Il Prof. Paul G. Richardson, MD, Boston, ha riassunto la situazione dei nuovi agenti come segue:
Gli inibitori del proteasoma (PI) e i farmaci immunomodulatori (IMiD) mostrano miglioramenti significativi nella sopravvivenza libera da progressione e complessiva [1]. Man mano che la loro modalità d’azione viene compresa meglio, stanno emergendo nuove combinazioni terapeutiche. Un problema serio è la diminuzione della durata della risposta e dei tassi di sopravvivenza quando si sommano i regimi di terapia di salvataggio di successo [2]. Gli inibitori del proteasoma di nuova generazione, come il carfilzomib, sono attualmente studiati in combinazione con lenalidomide e desametasone in studi di fase III.
- La funzione immunitaria al basale sembra essere un punto di commutazione chiave per il successo. Potrebbe essere possibile indirizzarli (con il blocco di PD1/PDL1).
- Gli anticorpi monoclonali mostrano attività nelle forme di malattia ad alto rischio e rappresentano nuove vie d’azione (come altri immunoterapici). Daratumumab, un anticorpo monoclonale umano CD38, ha dimostrato un’efficace distruzione delle cellule tumorali che esprimono CD38 negli studi in vitro. L’efficacia clinica è quindi sospetta. L’effetto sinergico di una combinazione di daratumumab, lenalidomide e desametasone è attualmente in fase di studio. I risultati [3] sono stati presentati all’ASCO 2014 e sono promettenti per quanto riguarda il profilo di sicurezza e di attività.
- Molti altri cosiddetti “piccoli inibitori molecolari” offrono una speranza. Anche uno studio sull’inibitore dell’istone deacetilasi (HDAC), panobinostat, è stato presentato dal Prof. Richardson all’ASCO di quest’anno: Ha dimostrato che la combinazione di panobinostat più bortezomib più desametasone ha migliorato la sopravvivenza libera da progressione in modo altamente significativo (cioè con una mediana di 3,9 mesi) rispetto agli altri due agenti da soli. Anche i tassi di risposta completa sono stati quasi raddoppiati rispetto al braccio di controllo [4].
Il fattore “età
Il Prof. Dr. med. Thierry Facon, di Lille, ha parlato delle opzioni terapeutiche dei pazienti con MM di nuova diagnosi che non sono idonei per un trapianto di cellule staminali: “Il mieloma multiplo è principalmente una malattia degli anziani. L’età superiore, tuttavia, esclude quasi sempre il trapianto.
Quali sono le opzioni per questa popolazione? Nello studio FIRST [5] abbiamo potuto dimostrare che la terapia orale continua con lenalidomide + desametasone a basso dosaggio era significativamente superiore alla tripla combinazione di melfalan + prednisone + talidomide e lenalidomide + desametasone per 18 cicli”. La sopravvivenza libera da progressione è stata di 25,5, 21,2 e 20,7 mesi, rispettivamente. Abbiamo anche riscontrato un beneficio di questa opzione terapeutica nell’analisi ad interim della sopravvivenza globale. Quindi si dovrebbe considerare il regime continuo come un nuovo standard”.
I fattori associati a una sopravvivenza più breve durante la terapia con melfalan + prednisone + talidomide e/o bortezomib comprendono, secondo uno studio sulle metastasi [6], la presenza di un’unica fonte:
- Età (>75 anni)
- Insufficienza renale
- gravi effetti collaterali cardiaci/infettivi
- Interruzione della terapia
Uno studio presentato anche al Congresso EHA 2014 ha riscontrato un rischio significativamente maggiore di tossicità e di esito sfavorevole (sopravvivenza globale) per i pazienti fragili (cioè anziani, con comorbilità, cognitivamente e funzionalmente in cattive condizioni) [7].
Sfide per il futuro
Secondo il Prof. Facon, negli ultimi anni sono stati fatti grandi progressi nei pazienti con MM che sono adatti al trapianto di cellule staminali.
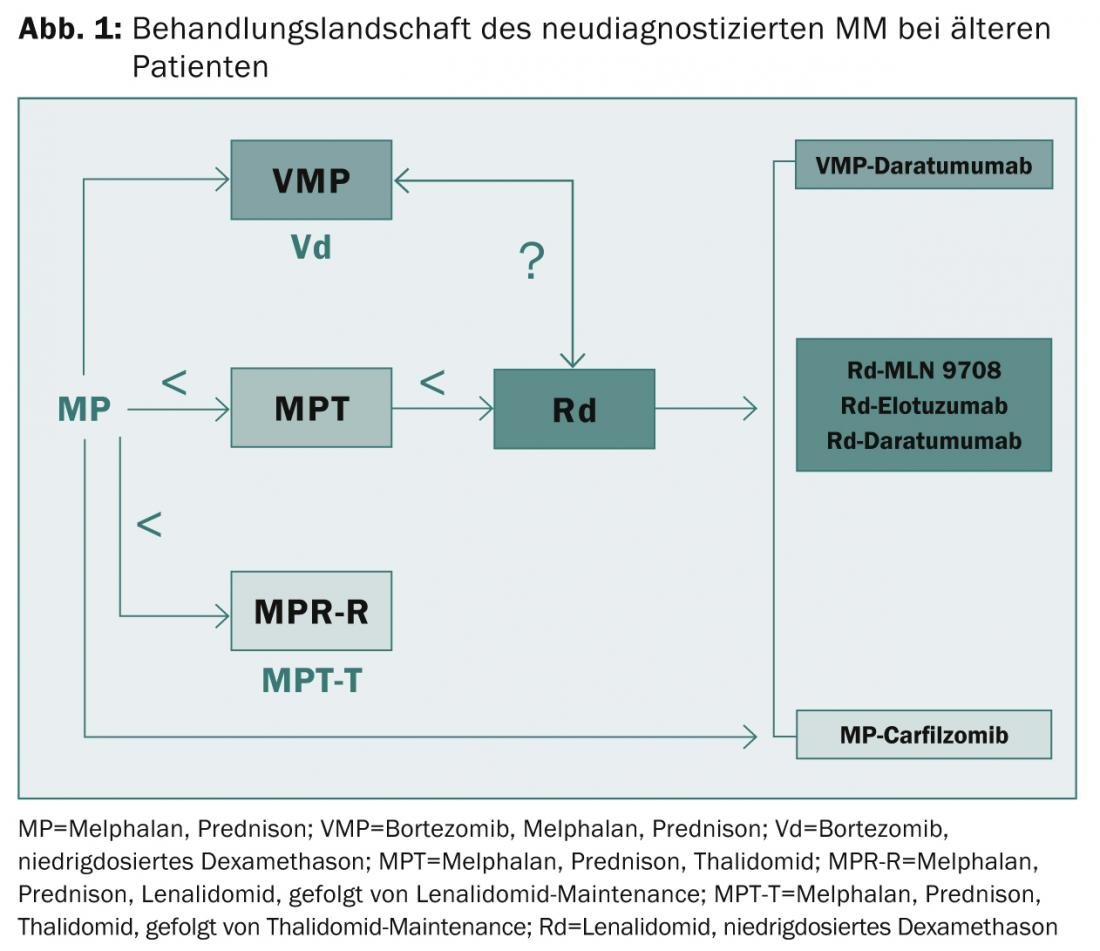
sono fuori questione. La sopravvivenza mediana libera da progressione è stata prolungata da circa 10-15 a 25-30 mesi e la sopravvivenza globale da circa 30 a 60 mesi. “Tuttavia, i pazienti ad alto rischio continuano a soffrire di un esito molto negativo anche con i nuovi agenti di prima generazione”, ha riassunto l’esperto. “La necessità di opzioni terapeutiche innovative e di un’adeguata valutazione del rischio rimane quindi grande. I pazienti fragili rappresentano una sfida continua. In questo contesto, può essere utile valutare con precisione la funzione degli organi, le comorbidità, le fragilità e le disabilità”, ha spiegato il Prof. Facon. “I PI, gli IMiD e gli anticorpi monoclonali di seconda e terza generazione svolgeranno un ruolo cruciale nel risolvere questi problemi in futuro (Fig. 1)“.
Fonte: Congresso EHA 2014, 12-15 giugno 2014, Milano
Letteratura:
- Kumar SK, et al: Blood 2008 Mar 1; 111(5): 2516-2520.
- Kumar SK, et al: Mayo Clin Proc 2004 Jul; 79(7): 867-874.
- Plesner T, et al: J Clin Oncol 2014; 32: 5s (suppl; abstr 8533).
- Richardson PG, et al: J Clin Oncol 2014; 32: 5s (suppl; abstr 8510).
- Facon T, et al: EHA 2014 #Abstract S643.
- Bringhen S, et al: Haematologica 2013 Jun; 98(6): 980-987.
- Mina R, et al: EHA 2014 #Abstract P354.
InFo Oncologia & Ematologia 2014; 2(6): 31-32