L’inibizione della coagulazione è una pietra miliare della terapia della sindrome coronarica acuta. Gli inibitori dell’aggregazione piastrinica che hanno come bersaglio la sintesi del trombossano, il recettore ADP, il recettore glicoproteico IIb/IIIa e il recettore della trombina PAR 1 sono in uso clinico a questo scopo, insieme agli inibitori della coagulazione plasmatica. Rappresentanti più potenti delle singole sostanze, così come la loro combinazione, promettono una maggiore efficacia antitrombotica, ma potrebbero dover essere soppesati rispetto al rischio di emorragia su base individuale.
Il percorso dalla prima descrizione dell’angina pectoris da parte di John Warren come “strangolamento del petto” nella prima edizione del New England Journal of Medicine nel 1812 [1] alla comprensione odierna della malattia coronarica a livello genetico e molecolare è stato costellato di importanti scoperte, innovazioni e progressi terapeutici straordinari.
Mentre fino al 1961 i pazienti affetti da ACS dovevano riposare il più indisturbati possibile e morivano nel 30% dei casi, oggi vengono monitorati continuamente nelle unità di cura coronarica, il che, insieme all’ampliamento delle opzioni di intervento terapeutico, ha portato a una riduzione della mortalità ospedaliera al 6-7%.
Oltre alla chirurgia di bypass aortocoronarico, che ha celebrato il suo 50° anniversario nel 2014, le opzioni di intervento terapeutico includono l’intervento coronarico percutaneo (PCI), lanciato nel 1977 da Andreas Grüntzig a Zurigo. Si tratta oggi di uno degli interventi più comuni nella medicina moderna [2], con tassi di impianto annuali di circa 500.000 stent a rilascio di farmaco (DES) di seconda generazione negli Stati Uniti [3]. Dato il meccanismo patogenetico essenziale della formazione di trombi locali, la terapia anticoagulante è di estrema importanza. Si tratta dell’inibizione dell’emostasi primaria e della coagulazione plasmatica. L’inibizione terapeutica dell’adesione/attivazione e dell’aggregazione piastrinica avviene attraverso l’inibizione della sintesi del trombossano, il blocco del recettore ADP e l’inibizione del recettore GP IIb/IIIa. L’inibizione di vari fattori della cascata della coagulazione assicura l’anticoagulazione plasmatica, che nel caso della PCI viene applicata con eparina, eparine a basso peso molecolare e inibitori selettivi di fattori specifici (bivalirudina per l’inibizione della trombina; fondaparinux per l’inibizione dell’FXa mediata dall’antitrombina).
Questa revisione discuterà i meccanismi d’azione e le indicazioni d’uso dei farmaci antiaggreganti in uso oggi. Per motivi di chiarezza, l’anticoagulazione, altrettanto importante nella PCI, non viene discussa qui e può essere letta altrove [4,5].
Fisiologia delle piastrine
Le piastrine sono cellule anucleari responsabili dell’emostasi primaria attraverso l’adesione, l’aggregazione, la secrezione e l’interazione con i fattori di coagulazione. La lesione dell’integrità vascolare con l’esposizione della matrice subendoteliale porta all’attivazione immediata delle piastrine. Questo è inizialmente mediato dal contatto delle piastrine circolanti con il collagene, il fattore di von Willebrand e il fibrinogeno attraverso i recettori glicoproteici VI, Ib e IIb/IIIa, ed è rafforzato dalla secrezione, tra gli altri, di trombossano e ADP nel senso di un ciclo di feedback positivo. Il recettore eterodimerico della glicoproteina GP IIb/IIIa, che è presente in gran numero (circa 80.000/P) e ha una minore affinità per i suoi ligandi nelle piastrine a riposo, subisce un cambiamento conformazionale attraverso meccanismi di segnalazione intracellulare che porta all’esposizione del sito di legame per i ligandi come il fibrinogeno, il vWF e la fibronectina. Questo media l’aggregazione piastrinica e l’adesione solida.
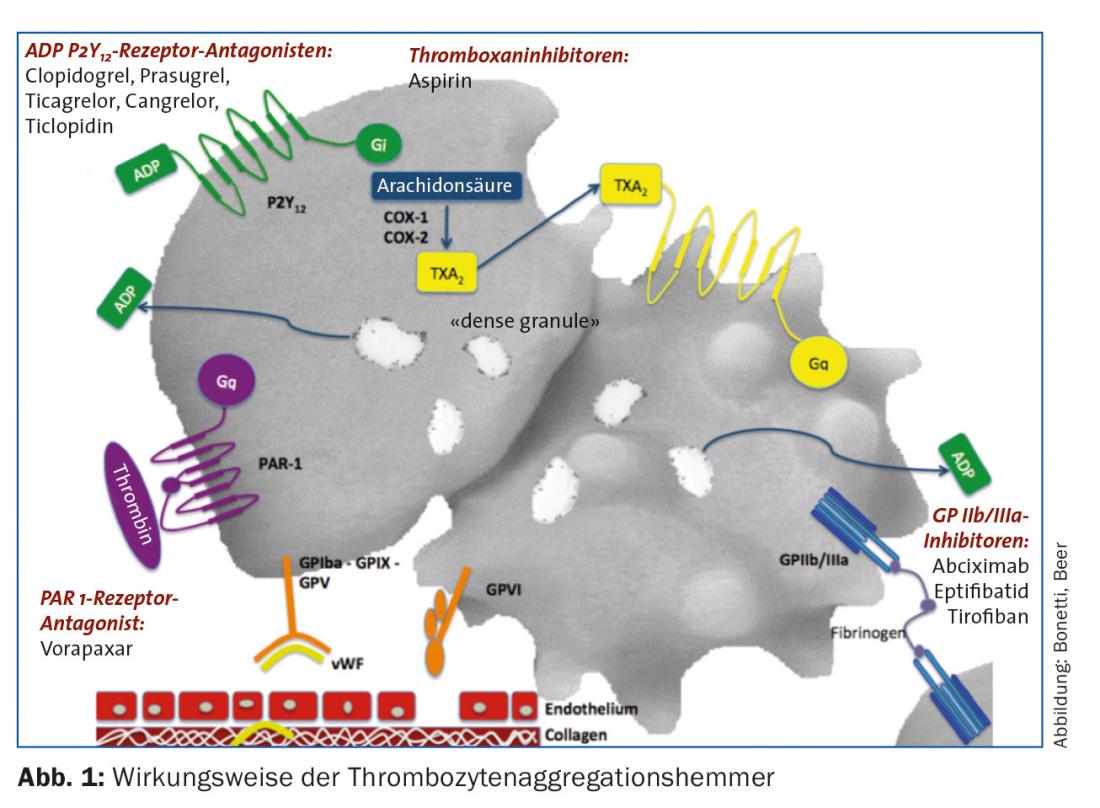
Nel contesto della sindrome coronarica acuta, questo processo può essere interrotto terapeuticamente nei seguenti punti (Fig. 1):
- Inibizione della sintesi del trombossano (l’acido acetilsalicilico [ASS] inibisce la ciclossigenasi).
- Inibizione del recettore ADP P2Y12 (irreversibile: clopidogrel, prasugrel; reversibile: ticagrelor, cangrelor [ad azione estremamente breve, adatto al bridging]).
- Inibizione del recettore GP IIb/IIIa (abciximab, eptifibatide, tirofiban)
- Inibizione del recettore della trombina (vorapaxar)
Di seguito una panoramica delle singole sostanze e dei loro meccanismi d’azione.
Aspirina
L’aspirina inibisce in modo irreversibile la ciclossigenasi 1 (COX-1) e quindi la sintesi del trombossano A2. Questo effetto persiste per tutta la durata di vita della piastrina (dieci giorni, regola generale: 10% di Tc “fresca” al giorno). L’efficacia dell’aspirina è stata dimostrata nei pazienti con angina pectoris instabile (AP). Quattro studi randomizzati e controllati dell’era pre-PCI hanno dimostrato una riduzione del 51% del tasso di infarto miocardico e della mortalità [6–9]. Una meta-analisi di questi studi ha mostrato una riduzione del 46% dell’odds ratio per le complicanze vascolari in questa popolazione di pazienti dopo due anni di terapia con aspirina.
In termini di dosaggio, lo studio CURRENT-OASIS 7, che ha studiato circa 25.000 pazienti con ACS, non ha mostrato differenze di esito tra il dosaggio più alto (300-325 mg) e quello più basso (75-100 mg). In effetti, gli effetti antiaggreganti sono già saturi a una dose intorno ai 30-75 mg allo stato stazionario, mentre gli effetti collaterali gastrointestinali e i tassi di sanguinamento aumentano in modo dose-dipendente (anche nell’intervallo di dosi più basso). In Svizzera, una dose standard di 100 mg è raccomandata di conseguenza nella prevenzione primaria e secondaria. La prevenzione primaria, invece, è raccomandata solo per i pazienti di età superiore ai 50 anni con un profilo di rischio significativamente aumentato [4]. Per la stratificazione del rischio si dovrebbero utilizzare strumenti standardizzati come il Framingham Risk Score e le Linee Guida AGLA.
Inibitori di P2Y12
Clopidogrel: il clopidogrel (300-600 mg di dose di carico e 75 mg/d di dose di mantenimento) richiede l’ossidazione da parte del sistema epatico del citocromo P450 per la conversione nel metabolita attivo. In questo processo, circa l’85% del farmaco viene idrolizzato dalle esterasi in una forma inattiva. Il metabolita attivo inattiva in modo selettivo e irreversibile il recettore P2Y12, impedendo l’attivazione piastrinica mediata dall’ADP. Sebbene la duplice terapia antiaggregante con aspirina e clopidogrel riduca il tasso di eventi ischemici dopo PCI [10–11], fino al 10% dei pazienti in terapia combinata presenta una recidiva ischemica entro il primo anno, con un tasso di trombosi dello stent fino al 2% [12]. La variabilità interindividuale, in parte grande, della reattività piastrinica, dovuta alla biodisponibilità variabile, è ritenuta responsabile di questo. Dal punto di vista farmacogenetico, ciò è dovuto in gran parte a varianti di “perdita di funzione” sull’allele CYP 2C19 e soprattutto C19*2. I pazienti con questa mutazione presentano livelli più bassi del metabolita attivo e, di conseguenza, una ridotta inibizione dell’aggregazione piastrinica. Sebbene i test genetici rapidi per questa mutazione siano ora più disponibili, l’EMA e la FDA ne sconsigliano l’uso non selettivo. I test genetici e l’analisi della funzione piastrinica devono essere riservati ai pazienti con stato post-trombosi da stent in corso di trattamento, alto rischio di emorragia e stent in vasi critici (ad esempio, stelo principale sinistro).
Le interazioni con gli IPP, in particolare con l’omeprazolo e l’esomeprazolo, sono state descritte molte volte. Mentre le interazioni farmacodinamiche sono considerate relativamente certe, non è stato possibile confermare con certezza la rilevanza clinica. In generale, gli IPP non dovrebbero essere prescritti automaticamente anche nei pazienti in doppia antiaggregazione, ma dovrebbero essere somministrati ai gruppi a rischio con stato post emorragico gastrointestinale, anticoagulazione concomitante, terapia con steroidi o FANS, età avanzata (>65 anni) o con infezione da H. pylori. Nel caso di una terapia PPI necessaria, gli studi farmacodinamici parlano dell’uso di sostanze più recenti (ad esempio, il pantoprazolo).
Prasugrel: Prasugrel (60 mg dose di carico, 10 mg/d dose di mantenimento) è un inibitore irreversibile del recettore P2Y12 con un’insorgenza d’azione più rapida e un effetto più potente del clopidogrel. Nello studio TRITON-TIMI 38, circa 10.000 pazienti con ACS (STEMI o NSTEMI) e PCI pianificato sono stati trattati con clopidogrel o prasugrel, iniziati durante o dopo l’intervento [13]. Dopo 15 mesi, gli eventi cardiovascolari ricorrenti sono stati significativamente ridotti nel gruppo prasugrel (dall’11,2% al 9,3%; rischio relativo (RR) 0,82; p=0,002). In particolare, il rischio di infarto miocardico è risultato significativamente inferiore con prasugrel (riduzione del rischio relativo del 23,9%). Tuttavia, questo ha comportato un aumento significativo del tasso di emorragie gravi e fatali (2,4% vs. 1,8%; HR 1,4; p=0,02). In considerazione del tasso significativamente inferiore di trombosi dello stent (1,13% vs. 2,35%; HR 0,48; p<0,0001), prasugrel dovrebbe essere preso in considerazione soprattutto nei pazienti con trombosi dello stent trattati con clopidogrel. Nei pazienti sottoposti a PCI per ACS (STEMI o NSTEMI), il prasugrel è preferito al clopidogrel in assenza di controindicazioni appropriate. Questi includono lo stato post CVI o TIA, in quanto esiste un profilo beneficio-rischio sfavorevole per questo gruppo. Allo stesso modo, la prescrizione deve essere evitata nelle persone di età superiore ai 75 anni e nei pazienti con un basso peso corporeo di <60 kg. Se tuttavia si ritiene necessario, la terapia di mantenimento deve essere somministrata a un dosaggio ridotto di 5 mg/d.
Ticagrelor: Ticagrelor è un inibitore reversibile di P2Y12 che inibisce anche la ricaptazione di ADP tramite ENT-1 (Equilibrative Nucleoside Transporter). L’emivita plasmatica è di 6-12 h. La dose di carico è di 180 mg, seguita da una dose di mantenimento di 2× 90 mg/d. Come il prasugrel, il ticagrelor ha un inizio d’azione accelerato e più prevedibile rispetto al clopidogrel e una rigenerazione più rapida della funzione piastrinica dopo l’interruzione. I metaboliti del sistema CYP3A4, come la simvastatina, aumentano i livelli plasmatici di ticagrelor, mentre gli inibitori del CYP3A4 (ad esempio il diltiazem) aumentano i livelli di ticagrelor. Nello studio PLATO, circa 18.000 pazienti con ACS sono stati trattati con clopidogrel o ticagrelor [14]. Dopo 12 mesi, è stata osservata una riduzione significativa dell’endpoint primario di infarto miocardico, morte vascolare e ictus con ticagrelor (9,8% vs. 11,7%; HR 0,84; p=0,001). Anche il tasso di mortalità non vascolare è stato significativamente ridotto nel gruppo ticagrelor (4% vs. 5,1%; p=0,001). La frequenza di emorragie maggiori non correlate al CABG era significativamente più alta con ticagrelor (4,5% vs. 3,8%; p=0,03). Il tasso complessivo di emorragia fatale non differiva in modo significativo tra i gruppi, sebbene il tasso di emorragia intracranica fatale fosse significativamente aumentato con ticagrelor (0,1% vs. 0,001%; p=0,02). Il ticagrelor era più associato a effetti collaterali comuni come dispnea senza correlazione morfologica (13,8% vs. 7,8%), pause ventricolari e iperuricemia asintomatica. Come il prasugrel, il ticargrelor è preferito alla terapia con clopidogrel dopo un’ACS (1B).
Cangrelor: Cangrelor è un analogo dell’ATP che viene somministrato per via endovenosa e si lega reversibilmente al recettore P2Y12 con grande affinità. L’emivita plasmatica è molto breve, pari a dieci minuti. Esercita una potente inibizione dell’attivazione piastrinica ADP-dipendente e consente un rapido recupero della funzione TC già da una o due ore dopo l’interruzione dell’infusione. Tre studi su larga scala hanno confrontato cangrelor – iniziato prima della PCI – con clopidogrel somministrato prima/dopo la PCI o secondo la prassi locale (CHAMPION-PCI; CHAMPION-PLATFORM; CHAMPION-PHOENIX). Una meta-analisi [15] ha dimostrato una riduzione del 19% del rischio relativo di mortalità periprocedurale, infarto miocardico, rivascolarizzazione del vaso bersaglio e trombosi dello stent con cangrelor. Il rischio relativo di trombosi dello stent da solo è stato addirittura ridotto del 39%. Anche in questo caso, si è trattato di un aumento significativo del tasso di sanguinamento (cangrelor 0,9% vs. clopidogrel 0,6%; OR 1,38; p=0,007). Cangrelor è approvato come aggiunta alla PCI nei pazienti senza pre-trattamento con inibitori P2Y12 e senza blocco del recettore GP IIb/IIIa.
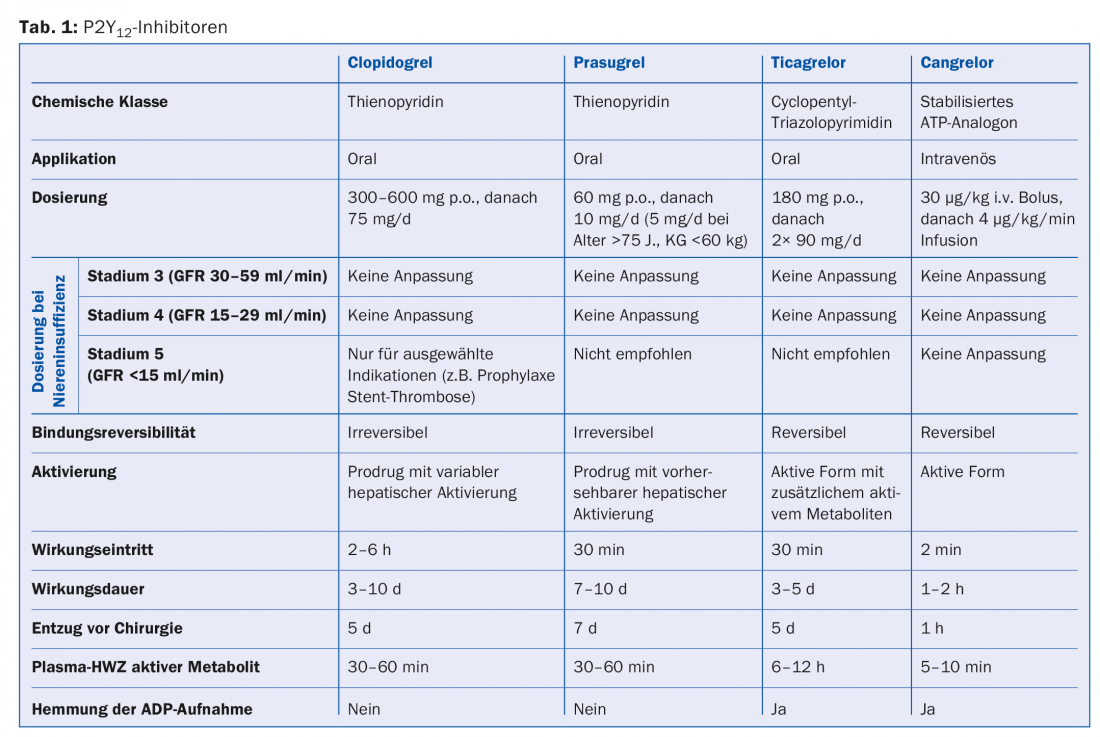
La Tabella 1 offre una panoramica degli inibitori P2Y12 in uso.
Inibitori dei recettori GP IIb/IIIa
Abciximab, eptifibatide, tirofiban: gli inibitori GP IIb/IIIa applicati per via endovenosa inibiscono l’aggregazione bloccando il legame del fibrinogeno ai recettori GP IIb/IIIa attivati sulle piastrine adiacenti. Una meta-analisi di sei studi clinici randomizzati con oltre 29.000 pazienti ha mostrato una riduzione del 9% del rischio relativo di morte e infarto miocardico non fatale aggiungendo gli inibitori della GP IIb/IIIa alla terapia con eparina [16]. L’effetto positivo era maggiore nei pazienti sottoposti a PCI. Il rischio di emorragia grave, ma non di emorragia intracranica, è risultato significativamente aumentato. Va notato che la maggior parte degli studi ha preceduto l’uso diffuso degli inibitori P2Y12 e le combinazioni con prasugrel e ticagrelor non sono mai state studiate in modo prospettico. Di conseguenza, gli inibitori della GP IIb/IIIa in combinazione con questi farmaci e anche nei pazienti in terapia con anticoagulazione orale devono essere riservati solo alle situazioni di emergenza. In caso di funzionalità renale compromessa con un GFR <50 ml/min, eptifibatide richiede un aggiustamento della dose, mentre questo è indicato solo per tirofiban a partire da un GFR di <30 ml/min e, nel caso di abciximab, i produttori raccomandano di considerare attentamente il rapporto rischio-beneficio. Per un GFR di 15-30 ml/min è approvato solo il tirofiban, mentre al di sotto di questo valore è sconsigliato l’uso di tutte le sostanze.
Antagonista del recettore PAR 1
Vorapaxar: Vorapaxar è un inibitore selettivo attivo per via orale del recettore della trombina piastrinica PAR 1. Nello studio TRACER, vorapaxar è stato confrontato con il placebo in aggiunta alla terapia standard in quasi 13.000 pazienti con NSTEMI. Non c’è stata alcuna riduzione dell’endpoint primario di morte cardiovascolare, MI, CVI, ischemia ripetuta o rivascolarizzazione ripetuta con vorapaxar (18,5% vs 19,9%; HR 0,92; p=0,07). D’altra parte, con vorapaxar si è verificato un numero significativamente maggiore di emorragie gravi e intracraniche (7,2% vs. 5,2%; HR 1,35; p<0,001). Nello studio TRA 2P-TIMI 50, vorapaxar è stato confrontato con il placebo in aggiunta alla terapia standard in poco più di 24.000 pazienti con MI st. n., CVI st. n. o PAVK. In questo caso, vorapaxar è stato associato a una moderata riduzione di morte cardiovascolare, MI e CVI nell’arco di tre anni (9,3% vs. 10,5%; HR 0,87; p=0,001). Questo, a sua volta, è avvenuto al prezzo di un aumento significativo dei tassi di emorragia intracranica (1% contro 0,5%; p<0,001). Di conseguenza, il farmaco è controindicato nei pazienti con malattia cerebrovascolare. Negli Stati Uniti, vorapaxar è stato approvato per la prevenzione secondaria dell’IMA, anche se il moderato beneficio deve essere valutato attentamente rispetto all’aumento del rischio di sanguinamento.
Inibizione dell’aggregazione piastrinica dopo PCI – utilizzo in base agli scenari clinici
Sebbene l’inibizione dell’aggregazione piastrinica sia la terapia standard per la malattia aterosclerotica, la durata e l’intensità variano a seconda dell’urgenza della malattia. Di seguito, vengono discussi diversi scenari; la tabella 2 fornisce una panoramica.
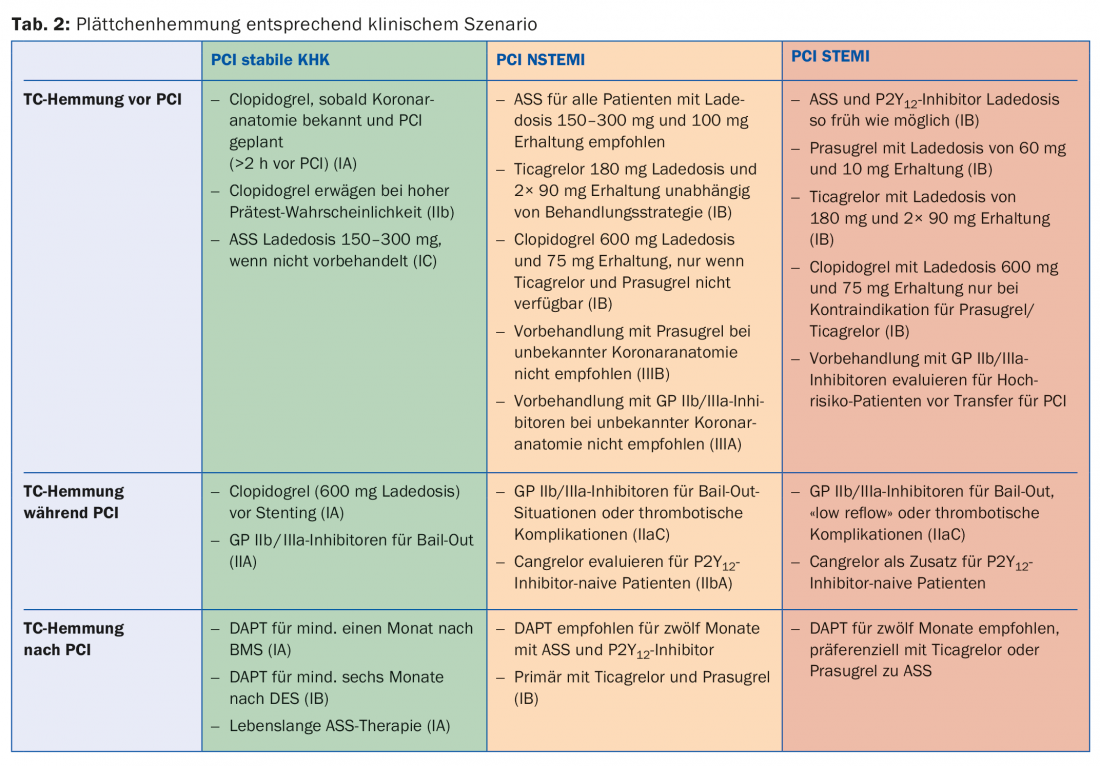
Coronaropatia stabile (SCAD): in genere si raccomanda di utilizzare un approccio radiale e preferibilmente un DES di ultima generazione per la PCI (1A). La terapia antiaggregante doppia (DAPT) nella SCAD dopo la PCI consiste solitamente in aspirina e clopidogrel. Tutti i pazienti con SCAD o sospetto di SCAD dovrebbero idealmente essere pretrattati con aspirina 100 mg. Se questo non è il caso, è necessario applicare una dose di carico orale di 150-300 mg prima della PCI elettiva. Non ci sono prove a favore di un pre-trattamento con clopidogrel prima di una PCI puramente diagnostica. Tuttavia, se l’anatomia coronarica è già nota e la rivascolarizzazione è pianificata di conseguenza, si raccomanda una dose di carico di clopidogrel 600 mg almeno due ore prima della PCI. Nei pazienti non ancora pretrattati, si raccomanda una dose di carico di 600 mg di clopidogrel durante la PCI, una volta stabilita l’indicazione allo stenting. L’uso degli antagonisti GP IIb/IIIa durante la PCI deve essere riservato alle situazioni di emergenza (ad esempio, trombosi coronarica imminente) nella SCAD. Dopo la PCI, la DAPT con clopidogrel 75 mg/d e aspirina 100 mg/d è raccomandata per un mese dopo l’impianto di BMS (1A) e per sei mesi dopo l’impianto di DES (1B). In seguito, la monoterapia, di solito con l’aspirina, dovrebbe essere continuata in modo ottimale per tutta la vita (1A). È stato dimostrato che le circostanze dell’interruzione sono importanti per lo sviluppo di complicazioni coronariche dopo la sospensione della doppia antiaggregazione. Nel 50% dei casi, l’aborto è stato prescritto da un medico e non ha comportato un aumento del rischio di eventi avversi. Nel 14% dei casi in cui l’emorragia o la malcompliance hanno causato l’interruzione, il numero di complicanze cardiache rilevanti è aumentato in modo sostanziale, anche se questo effetto è diminuito dopo 30 giorni [17]. Di conseguenza, è importante una buona informazione e istruzione dei pazienti.
NSTEMI: la DAPT dopo NSTEMI consiste in aspirina e un inibitore P2Y12, preferibilmente ticagrelor o prasugrel (1B). L’aspirina è raccomandata per tutti i pazienti con una dose di carico di 150-300 mg p.o. (o 80-150 mg i.v.) nei pazienti naïve all’aspirina, seguita da una dose di mantenimento a lungo termine di 100 mg/d. Un inibitore P2Y12 viene combinato con l’aspirina, di solito per 12 mesi (1A). Ticagrelor con una dose di carico di 180 mg seguita da una dose di mantenimento di 2× 90 mg/d è raccomandato per tutti i pazienti a rischio moderato-alto di ischemia, indipendentemente dalla strategia di trattamento iniziale. Questo non esclude i pazienti che sono stati pretrattati con clopidogrel, che deve essere sospeso con ticagrelor. Prasugrel con una dose di carico di 60 mg seguita da una dose di mantenimento di 10 mg/d è raccomandato per i pazienti con anatomia coronarica nota che sono sicuramente sottoposti a PCI. Il clopidogrel (dose di carico 300-600 mg seguita da 75 mg/d) deve essere utilizzato solo nei pazienti con controindicazioni al ticagrelor o al prasugrel e in anticoagulazione orale. Gli inibitori della GP IIb/IIIa durante la PCI possono essere utilizzati in caso di complicazioni trombotiche o nelle cosiddette situazioni di bail-out (“operazioni di salvataggio”, ad esempio in caso di trombo di grandi dimensioni, flusso lento o assente). Cangrelor può essere considerato come agente antiaggregante nei pazienti senza blocco P2Y12 precedente e stimati ad alto rischio. Sebbene la DAPT sia generalmente raccomandata per 12 mesi, la durata può essere ridotta a tre-sei mesi o estesa fino a 30 mesi (IIA) in pazienti selezionati, a seconda del loro rischio individuale di sanguinamento e ischemia [4]. Per facilitare il processo decisionale, l’AHA raccomanda l’uso del punteggio DAPT (tab. 3) nelle attuali linee guida. Questo è stato progettato nello studio DAPT e convalidato nello studio PROTECT. Un punteggio da -2 a 1 indica i pazienti il cui rischio di emorragia è aumentato di 2,5 volte rispetto all’effetto protettivo anti-ischemico e che, di conseguenza, hanno maggiori probabilità di non beneficiare di una DAPT prolungata. A loro volta, i pazienti con un punteggio di >2 sperimentano un beneficio otto volte superiore di ischemia evitata rispetto al rischio di sanguinamento e hanno maggiori probabilità di trarre beneficio [18].

STEMI: i pazienti con STEMI sottoposti a PCI primario devono ricevere una DAPT con aspirina e un inibitore P2Y12 oltre all’anticoagulazione parenterale il prima possibile (IA). L’aspirina con una dose di carico di 300 mg p.o. è raccomandata per tutti i pazienti, indipendentemente da un eventuale pre-trattamento, per garantire il blocco totale della sintesi di TXA2. La monoterapia a vita con 100 mg/d è raccomandata in assenza di controindicazioni. Un inibitore P2Y12 deve essere solitamente associato all’aspirina per 12 mesi dopo lo STEMI (IA). Prasugrel e ticagrelor (IB) sono ancora una volta generalmente da preferire in questo caso, dopo che un’analisi in pool di ben 48.000 pazienti ha mostrato un vantaggio in termini di sopravvivenza senza un aumento significativo dei tassi di sanguinamento nei pazienti con STEMI con queste sostanze [19]. È importante ricordare che gli inibitori P2Y12 più recenti e più potenti devono essere evitati in caso di ictus (emorragico) o di insufficienza epatica da moderata a grave. Mancano anche dati sulla combinazione con (D)OAK, che dovrebbe essere evitata. In questo caso, o anche se le sostanze non sono disponibili, si continua a utilizzare il clopidogrel con 600 mg di carico e 75 mg/d di mantenimento (IB). L’uso degli inibitori della GP IIb/IIIa durante la PCI sembra essere appropriato in caso di trombo di grandi dimensioni, flusso lento o assente o complicanze trombotiche (IIC) ed è comunemente utilizzato a livello internazionale, sebbene non esistano studi randomizzati di grandi dimensioni. La cosiddetta applicazione a monte (cioè già prima della PCI) degli inibitori GP IIb/IIIa è controversa, anche se può essere presa in considerazione nei pazienti ad alto rischio che devono essere trasferiti prima (IIB). Cangrelor può essere utilizzato come ponte/integrazione alla PCI nei pazienti senza pre-trattamento con inibitori P2Y12 e senza inibitori GP IIb/IIIa aggiuntivi, secondo la prassi locale.
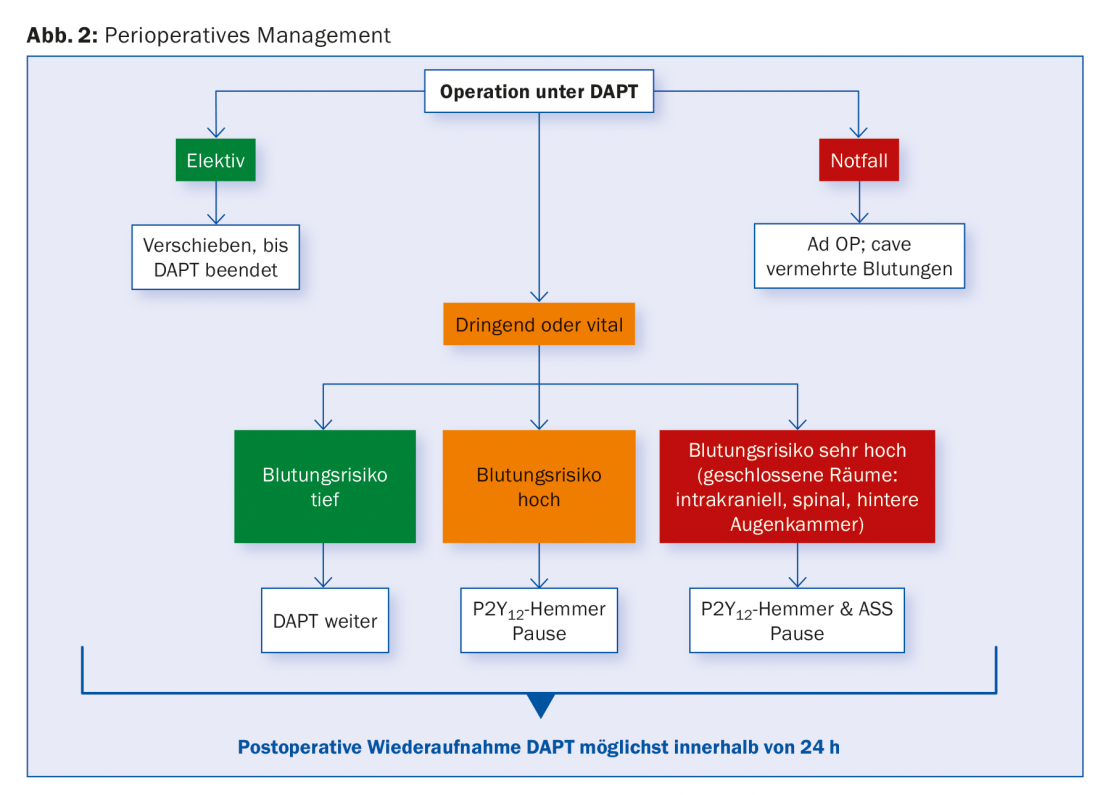
Intervento chirurgico sotto DAPT
Per i pazienti con SCAD, la DAPT è raccomandata da uno a sei mesi, a seconda del tipo di stent, e generalmente per dodici mesi per gli stent dopo ACS.
Non è raro che durante questo periodo si presenti la necessità di un intervento chirurgico, sia in termini di rivascolarizzazione chirurgica (CABG) che di natura non cardiaca. Anche in questo caso, la gestione dipende dal rischio individuale di emorragia e ischemia e deve essere discussa su base interdisciplinare. Per le procedure con un basso rischio di emorragia, si deve cercare di continuare la DAPT. Se questo non è possibile, almeno l’aspirina deve essere lasciata al suo posto. I dati di un ampio studio di coorte hanno mostrato che il rischio di complicanze cardiache rilevanti dopo l’intervento chirurgico era particolarmente aumentato nei primi sei mesi dopo la PCI. Non è stato possibile trovare differenze tra i vari tipi di stent.
Le procedure chirurgiche elettive dovrebbero idealmente essere rimandate fino al completamento della durata raccomandata della DAPT. Per gli interventi urgenti che richiedono un’interruzione, si raccomanda di sospendere clopidogrel e ticagrelor per cinque giorni e prasugrel per sette giorni prima, continuando ad assumere ASA. I dati dei pazienti sottoposti a CABG suggeriscono che le misurazioni della reattività TC consentono di determinare un tempo chirurgico sicuro e possono abbreviare la pausa del 50%. Questa sarebbe una possibile alternativa a un’interruzione arbitraria.
Nei pazienti ad alto rischio, ad esempio nei primi giorni e nelle prime settimane dopo lo stenting, viene talvolta suggerito un ponte antiaggregante per via endovenosa con inibitori della GP IIb/IIIa fino a quattro ore prima della procedura, anche se non esistono dati clinici prospettici in merito. Cangrelor è stato studiato nello studio BRIDGE per il passaggio al CABG nei pazienti pretrattati con un inibitore P2Y12. Cangrelor ha comportato una migliore conservazione dell’antiaggregazione senza un aumento della frequenza di sanguinamento [20]. Nessuna delle sostanze ha ancora ricevuto un’approvazione ufficiale in questo settore. Sostituire una DAPT con LMWH o UFH non ha senso. Dopo l’intervento, si raccomanda di riprendere tutti gli inibitori di P2Y12 il prima possibile. La Figura 2 offre una panoramica.
Conclusione
L’anticoagulazione è un principio chiave nel trattamento della malattia coronarica. Diversi agenti antiaggreganti e inibitori della coagulazione plasmatica sono di uso clinico quotidiano. Le aree di applicazione e le opzioni di combinazione si stanno espandendo, come l’uso di rivaroxaban a basso dosaggio dopo l’ACS in aggiunta alla DAPT. Il successo clinico dei singoli preparati e delle loro combinazioni è determinato, in ultima analisi, dal fatto che la maggiore efficacia antitrombotica migliori effettivamente la prognosi, senza che il possibile beneficio sia compensato da un aumento dei tassi di sanguinamento. Data la prevalenza della malattia e il suo impatto importante nelle statistiche delle principali cause di morte – e questo non è più limitato al mondo occidentale – è importante che i medici conoscano le varie sostanze, le loro indicazioni, i vantaggi e gli svantaggi, al fine di perseguire la strategia ottimale per una popolazione di pazienti sempre più complessa.
Letteratura:
- Warren J: Osservazioni sull’angina pectoris. N Engl J Med Surg 1812; 1: 1-11.
- Stefanini G, et al: Stent coronarici a rilascio di farmaco. N Engl J Med 2013; 368: 254-265.
- Roger VL, et al: Statistiche sulle malattie cardiache e sull’ictus – aggiornamento 2012: un rapporto dell’American Heart Association. Circolazione 2012; 125(22): e1002.
- La Task Force sulla rivascolarizzazione miocardica della Società Europea di Cardiologia (ESC) e dell’Associazione Europea di Chirurgia Cardio-Toracica (EACTS): Linee guida ESC/EACTS 2014 sulla rivascolarizzazione miocardica. European Heart Journal 2014; 35: 2541-2619.
- Bonetti N, Beer JH: Aggiornamento NOAK – una piccola guida di viaggio attraverso un paesaggio in movimento. Practice Dispatch 2016; 12-19.
- Il Gruppo RISC: Rischio di infarto miocardico e di morte durante il trattamento con aspirina a basso dosaggio ed eparina per via endovenosa negli uomini con malattia coronarica instabile. Il gruppo RISC. Lancet 1990; 336: 827-830.
- Lewis HD Jr, et al: Effetti protettivi dell’aspirina contro l’infarto miocardico acuto e la morte negli uomini con angina instabile. Risultati di uno studio cooperativo dell’Amministrazione Veterana. N Engl J Med 1983; 309: 396-403.
- Theroux P, et al: Aspirina, eparina o entrambi per trattare l’angina instabile acuta. N Engl J Med 1988; 319: 1105-1111.
- Cairns JA, et al: Aspirina, sulfinpirazone o entrambi nell’angina instabile. Risultati di uno studio multicentrico canadese. N Engl J Med 1985; 313: 1369-1375.
- Yusuf S, et al: Effetti del clopidogrel in aggiunta all’aspirina nei pazienti con sindromi coronariche acute senza innalzamento del segmento ST. N Engl J Med 2001; 345: 494-502.
- Mehta SR, et al: Effetti del pretrattamento con clopidogrel e aspirina seguito da una terapia a lungo termine nei pazienti sottoposti a intervento coronarico percutaneo: lo studio PCI-CURE. Lancet 2001; 358: 527-533.
- Parodi G, et al.: Alta reattività piastrinica residua dopo il carico di clopi- dogrel ed eventi cardiovascolari a lungo termine tra i pazienti con sindromi coronariche acute sottoposti a PCI. JAMA 2011; 306: 1215-1223.
- Wiviott SD, et al: Prasugrel rispetto a clopidogrel nei pazienti con sindromi coronariche acute. N Engl J Med 2007; 357: 2001-2015.
- Wallentin L, et al: Ticagrelor vs. clopidogrel nei pazienti con sindromi coronariche acute. N Engl J Med 2009; 361(11): 1045-1057.
- Steg PG, et al: Effetto di cangrelor sugli esiti periprocedurali negli interventi coronarici percutanei: un’analisi congiunta dei dati a livello di paziente. Lancet 2013; 382: 1981-1992.
- Roffi M, et al: Inibizione della glicoproteina IIb/IIIa piastrinica nelle sindromi coronariche acute. Gradiente di beneficio legato alla strategia di rivascolarizzazione. Eur Heart J 2002; 23: 1441-1448.
- Mehran R, et al: Cessazione del doppio trattamento antiaggregante ed eventi cardiaci dopo l’intervento coronarico percutaneo (PARIS): risultati a 2 anni di uno studio osservazionale prospettico. Lancet 2013; 382(9906): 1714-1722.
- Levine GN, et al: Focused Update Writing Group, 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease. JACC 2016. doi:10.1016/j.jacc.2016.03.513 [Epub ahead of Print].
- Bellemain-Appaix A, et al: Nuovi inibitori P2Y12 vs. clopidogrel nell’intervento coronarico percutaneo: una meta-analisi. J Am Coll Cardiol 2010; 56(19): 1542-1551.
- Angiolillo DJ, et al: Terapia antiaggregante con cangrelor nei pazienti sottoposti a chirurgia cardiaca: uno studio randomizzato controllato. JAMA 2012; 307(3): 265-274.
PRATICA GP 2016; 11(6): 22-29