Con il numero crescente di opzioni terapeutiche personalizzate e immuno-oncologiche, cresce anche l’importanza dei marcatori predittivi. Ad oggi, per determinarlo è necessaria la diagnostica tissutale, che include il prelievo invasivo di una biopsia. Questo potrebbe presto cambiare con l’introduzione della cosiddetta biopsia liquida. Tuttavia, ci sono ancora alcuni ostacoli da superare prima della distribuzione su larga scala.
Laddove l’analisi genetica richiedeva l’asportazione di tessuto tumorale, presto potrebbe bastare un semplice campione di sangue. Nell’ambito dell’analisi degli acidi nucleici basata sul sangue mediante biopsia liquida , le cellule tumorali circolanti, il DNA tumorale e l’RNA vengono isolati dal sangue venoso ed esaminati. Si tratta di un metodo reso possibile solo dal rilevamento altamente sensibile degli acidi nucleici. Se questo può essere convalidato per un uso diffuso, potrebbe, tra l’altro, semplificare in modo significativo la diagnosi delle mutazioni driver e quindi la scelta della terapia. Sebbene manchino ancora procedure standardizzate e dati a lungo termine, la tecnologia ha conosciuto un vero e proprio boom negli ultimi anni. Questo si riflette in un impressionante aumento dei contributi ai congressi e delle pubblicazioni. Mentre la ricerca su PubMed di “biopsia liquida” produce un misero 21 articoli pubblicati nel 2013, la cifra per il 2020 è di 1374 [1]. Il nuovo campo diagnostico sembra essere interessante anche dal punto di vista economico. Di conseguenza, è emerso un gran numero di aziende che si dedicano esclusivamente alla ricerca e alla commercializzazione della biopsia liquida . La più famosa di queste è probabilmente la start-up GRAIL, che è sostenuta da Bill Gates e si è dedicata in particolare alla diagnosi precoce del cancro attraverso gli acidi nucleici tumorali liberi da cellule circolanti [2].
DNA tumorale nel sangue
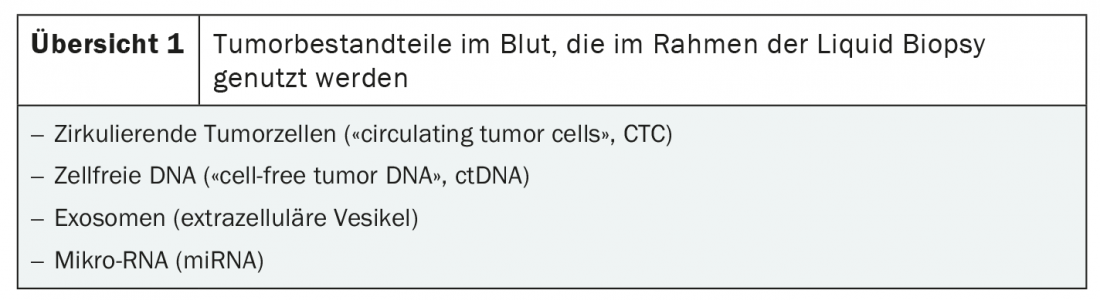
Il prerequisito per la biopsia liquida è l’isolamento dei componenti del tumore nel sangue. Esistono due fonti principali di DNA maligno: le cellule tumorali circolanti (CTC) e il DNA tumorale libero da cellule (ctDNA). Inoltre, la biopsia liquida può essere utilizzata per identificare i tumori. Si possono rilevare gli esosomi e i microRNA (miRNA) (panoramica 1) [3]. La procedura si basa su metodi altamente sensibili di rilevamento degli acidi nucleici, come il sequenziamento parallelo (NGS), la PCR e le analisi di singole cellule [3,4].
I diversi approcci vengono utilizzati in aree diverse in base ai loro vantaggi e svantaggi. Per esempio, l’eterogeneità del tumore può essere mappata analizzando il ctDNA, mentre è più difficile fare una dichiarazione sulla composizione del tumore complessivo utilizzando le cellule tumorali circolanti. In entrambi i casi, è stato possibile dimostrare un valore prognostico dell’esame per diversi tumori maligni: Più cellule tumorali circolanti e DNA libero vengono rilevati, più alto è il rischio di recidiva e progressione. Inoltre, il grado e lo stadio del tumore sono correlati al carico di ctDNA. Ma le possibilità diagnostiche vanno ben oltre queste analisi quantitative. I cambiamenti qualitativi sono anche di importanza prognostica e predittiva. Non solo possono essere utilizzati per identificare i bersagli terapeutici e le aberrazioni genetiche, ma servono anche come parametri di progressione che potrebbero essere utilizzati per valutare la risposta terapeutica in futuro. Ad esempio, la persistenza dell’espressione di PD-L1 sulle cellule tumorali circolanti in presenza di un blocco del checkpoint appropriato è classificata come prognosticamente sfavorevole [5]. Risultati simili si applicano alla terapia con inibitori della tirosin-chinasi nei pazienti con cancro al polmone: In risposta, il livello di ctDNA per le mutazioni del recettore del fattore di crescita epidermico (EGFR) diminuisce [6]. In generale, l’instabilità dei microsatelliti (MSI) nel ctDNA, tra le altre cose, sembra indicare uno stadio tumorale avanzato. Molte indagini in questo campo sono attualmente in pieno svolgimento, e con il numero crescente di bersagli terapeutici e di marcatori predittivi, ci sono innumerevoli altre domande che aspettano di essere testate per l’idoneità alla biopsia liquida .
Di esosomi e micro RNA
Tuttavia, non solo le cellule tumorali circolanti e il ctDNA sono oggetto della ricerca attuale, ma anche altri componenti tumorali che possono essere rilevati nel sangue: Esosomi e microRNA (miRNA). Questi ultimi sono piccoli frammenti di RNA non codificante. Questi sono coinvolti nella regolazione della proliferazione, della differenziazione cellulare e dell’apoptosi e quindi funzionano come oncogeni o geni soppressori del tumore [7]. Dal punto di vista clinico, il miRNA è particolarmente promettente come biomarcatore, perché il livello di espressione è correlato al cambiamento maligno. E questo accade spesso anche prima che i cambiamenti fenotipici diventino rilevabili [8]. Inoltre, ogni neoplasia ha una firma di miRNA caratteristica – un grande vantaggio quando si tratta di determinare l’origine tissutale di un tumore scarsamente differenziato. Sia per la diagnosi precoce che per chiarire l’identità del tumore, i miRNA saranno probabilmente ancora più ascoltati nei prossimi anni.
In questo contesto, è interessante anche l’analisi degli esosomi, cioè delle vescicole extracellulari. Perché contengono alte concentrazioni di miRNA. Come presumibilmente tutte le cellule, anche quelle tumorali secernono vescicole di origine endosomiale. Il loro ruolo è ancora in gran parte poco chiaro, ma è oggetto di intense ricerche. Per esempio, ci sono indicazioni che gli esosomi tumorali possono promuovere l’angiogenesi o inattivare gli anticorpi terapeutici attraverso l’espressione di antigeni tumorali.
Che si tratti di ctDNA, cellule tumorali circolanti, miRNA o esosomi – la biopsia liquida viene presa in considerazione per numerose aree di applicazione. Il metodo potrebbe essere particolarmente adatto per il rilevamento precoce del tumore, la caratterizzazione genetica e come parametro di progressione durante la terapia [4]. I vantaggi sono evidenti: la diagnosi meno invasiva, che è possibile anche in assenza di tessuto tumorale e, inoltre, è relativamente a basso rischio, significa che si può ottenere un’immagine dinamica del profilo genetico del tumore. Da un lato, le recidive possono essere individuate precocemente e, dall’altro, il loro profilo molecolare, spesso alterato, può essere decifrato attraverso il prelievo di sangue – e attaccato di conseguenza. Se la biopsia liquida dovesse affermarsi come metodo standard, ciò significherebbe probabilmente un’altra pietra miliare nell’era della pianificazione terapeutica personalizzata.
È necessario un ulteriore sviluppo
Anche se sono state fatte molte ricerche, il processo è ancora agli inizi. Di conseguenza, ci sono ancora grandi incertezze nella valutazione e anche nell’attuazione. L’applicabilità sembra differire in modo significativo tra diversi tipi di tumore e stadi. Ad esempio, il ctDNA è rilevabile solo nel 70% circa dei tumori maligni metastatici. In molte entità tumorali, una percentuale significativa di pazienti non ha quasi alcun ctDNA. Nel caso dei tumori cerebrali, l’uso dell’analisi del ctDNA è discutibile a causa della barriera emato-encefalica, poiché solo pochissimi frammenti di DNA entrano nel sangue [3,4]. Con un ulteriore aumento della sensibilità dei metodi di misurazione, queste limitazioni potranno probabilmente essere contrastate in modo sempre più efficiente nei prossimi anni. Tuttavia, devono ancora essere apportate alcune ottimizzazioni tecniche prima che possa essere utilizzato nella pratica clinica quotidiana [4].
Per consentire un’applicazione più ampia, attualmente mancano anche la standardizzazione e la gestione della qualità dei metodi. Gli esperti concordano su questo punto e chiedono, tra l’altro, la definizione di chiari valori di cut-off e di pannelli standardizzati. È inoltre necessario determinare in che misura i vari marcatori sono in grado di rappresentare l’eterogeneità del tumore. La possibilità di registrare le caratteristiche molecolari di una neoplasia in modo più completo rispetto, ad esempio, alla biopsia classica, potrebbe rappresentare un altro vantaggio decisivo del nuovo metodo. L’importanza della biopsia liquida nella diagnosi precoce del cancro, con tutti i suoi dilemmi, resta da vedere. In questo contesto, la rilevanza di un risultato “patologico” deve essere analizzata in dettaglio, soprattutto per quanto riguarda il rischio effettivo di malattia, prima di un uso più ampio della diagnostica [4]. Quindi c’è ancora molta strada da fare prima che venga messo in pratica quotidianamente, il che rimarrà certamente emozionante nei prossimi anni.
Fonte: Wallesch M, Wirth M, Wollenberg B: La “biopsia liquida” come figura chiave nell’immuno-oncologia. ENT. 2020; 68(12): 899-904.
Letteratura:
- www.ncbi.nlm.nih.gov/pubmed/ (consultato il 07.03.2021)
- https://grail.com/ (consultato il 07.03.2021)
- Nitz P: Biopsia liquida. Società tedesca per il cancro; 2018. www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/diagnosemethoden/liquid-biopsy.html (consultato il 07.03.2021)
- Dahl E: Diagnostica: Biopsia liquida – Stato 2016. Dtsch Arztbl. 2016; 113(4). DOI: 10.3238/PersOnko/2016.09.30.01
- Hofman P, et al.: La biopsia liquida nell’era dell’immuno-oncologia: è pronta per l’uso in prima serata per i pazienti oncologici? Ann Oncol. 2019; 30(9): 1448-1459.
- Thress KS, et al: La mutazione acquisita di EGFR C797S media la resistenza all’AZD9291 nel carcinoma polmonare non a piccole cellule con EGFR T790M. Nat Med. 2015; 21(6): 560-562.
- Iorio MV, Croce CM: Disregolazione dei microRNA nel cancro: diagnostica, monitoraggio e terapia. Una revisione completa su . EMBO Mol Med. 2017; 9(6): 852.
- du Rieu MC, et al: Il microRNA-21 è indotto precocemente nelle lesioni precursori dell’adenocarcinoma duttale pancreatico. Clin Chem. 2010; 56(4): 603-612.
InFo ONCOLOGIA ED EMATOLOGIA 2021; 9(2): 42-43