A causa del crescente invecchiamento della popolazione e del miglioramento dell’assistenza medica, negli ultimi anni è aumentato il numero di pazienti sottoposti a procedure di sostituzione del rene. Alla fine del 2015, circa 4100 pazienti erano in un programma di dialisi, 423 pazienti erano in dialisi domiciliare (per lo più dialisi peritoneale) [1], il resto era in emodialisi in centro. Inoltre, in Svizzera ci sono circa 5000 pazienti con un trapianto funzionante. Molte specialità mediche sono coinvolte nella cura dei pazienti con insufficienza renale cronica. Per lo stadio CKD 1-3, il medico di base è l’assistente principale, mentre per lo stadio CKD 4+5 (pazienti in dialisi), è più probabile che l’assistenza sia fornita dal nefrologo (Fig. 1). Se la funzione renale è <30% (GFR <30 ml/min.), è necessario rivolgersi a un nefrologo, in modo da preparare accuratamente il paziente a una procedura di sostituzione renale [2].
Di norma, la dialisi cronica viene avviata quando il GFR è compreso tra 8-12 ml/min, per cui la decisione di iniziare non si basa solo sui valori di laboratorio [3]. Nei pazienti asintomatici, l’indicazione di iniziare la dialisi può essere fatta con cautela [4]. Un’indicazione assoluta è l’iperkaliemia che non può essere controllata con misure conservative, o l’ipervolemia che non può essere controllata con i diuretici (soprattutto nella sindrome cardiorenale). Con una buona collaborazione tra nefrologo, medico di base e paziente, il quadro clinico della pericardite uremica o dell’encefalopatia uremica non dovrebbe verificarsi; entrambe le condizioni cliniche costituirebbero un’indicazione di emergenza per l’avvio della dialisi.
Dialisi peritoneale [5]
- CAPD = dialisi peritoneale ambulatoriale continua
- APD = dialisi peritoneale automatizzata
Come procedura di dialisi acuta negli adulti, la dialisi peritoneale non ha posto. Al contrario, la procedura è stabilita per l’insufficienza renale cronica che richiede la dialisi. In Svizzera, la percentuale di pazienti in dialisi peritoneale è aumentata negli ultimi anni (10-12%). Non esistono studi prospettici randomizzati con un confronto diretto tra mortalità e morbilità tra PD e HD, ma almeno nei primi anni di terapia sostitutiva renale le procedure sembrano equivalenti. Nei casi di insufficienza cardiaca grave (e di instabilità circolatoria durante l’HD) e di mancanza di accesso vascolare per l’emodialisi, è preferibile la PD. Una buona alternativa all’emodialisi in centro è l’APD notturna, soprattutto per i pazienti più giovani che lavorano.
La Figura 2 mostra gli aspetti tecnici: la PD viene eseguita tramite un catetere per dialisi intraperitoneale, solitamente inserito per via laparoscopica. La procedura utilizza il peritoneo come membrana semipermeabile per rimuovere i prodotti metabolici attraverso la diffusione e l’osmosi. Nella dialisi peritoneale, la compliance del paziente è molto importante, in quanto è lui stesso a eseguire la terapia. Viene istruito e monitorato da personale infermieristico specializzato e, se il decorso è stabile, i controlli nefrologici e le consultazioni avvengono ogni 4-6 settimane.
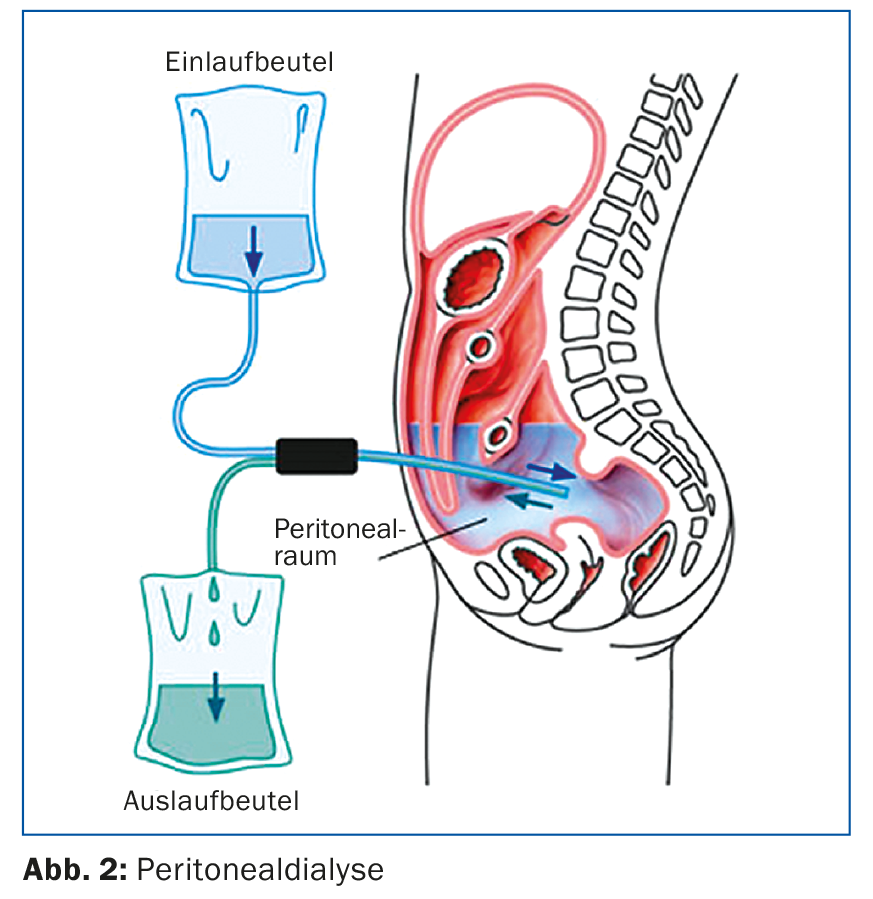
Un possibile vantaggio della dialisi peritoneale rispetto all’emodialisi è che la funzione residua o il flusso sanguigno possono essere ridotti. la diuresi residua viene conservata più a lungo. Per questo motivo, è importante che venga effettuato il minor numero possibile di esami radiologici con mezzo di contrasto iodato. Anche i farmaci antinfiammatori non steroidei devono essere evitati per preservare la funzione residua, che è importante per la dialisi peritoneale. In caso di complicazioni della dialisi peritoneale, il centro di nefrologia è solitamente responsabile, soprattutto per i problemi del catetere, come la dislocazione o la perdita del catetere. Con gli attuali sistemi di dialisi peritoneale, la peritonite è rara ma ancora pericolosa [5]. Se si verifica un intorbidimento del dialisato o un dolore addominale, il dialisato deve essere esaminato in emergenza e si deve iniziare una terapia antibiotica (di solito intraperitoneale, spesso si può evitare il ricovero in ospedale).
Emodialisi
Per la maggior parte dei pazienti, l’emodialisi viene eseguita nel centro di dialisi (dialisi in centro), solo alcuni pazienti eseguono la dialisi a casa (emodialisi domiciliare). Un singolo trattamento di emodialisi dura 3,5-4,5 ore, a seconda della funzione residua e di altri fattori individuali. Di solito vengono eseguite tre sessioni di emodialisi alla settimana. Nella maggior parte dei centri è tecnicamente possibile eseguire la cosiddetta emodiafiltrazione (disintossicazione attraverso una combinazione di emodialisi ed emofiltrazione). Per una dialisi efficiente, è necessario un accesso vascolare [6] che fornisca un flusso sanguigno sufficiente (>300 ml/min.) è consentito. L’accesso vascolare è ancora chiamato la “zampa di cavallo della dialisi” a causa di vari problemi tecnici. Le diverse possibilità sono illustrate nella figura 3 : se all’inizio della dialisi non è disponibile alcuno shunt, la procedura viene eseguita tramite un catetere atriale con tunnel sottocutaneo. Il vantaggio è che la dialisi può essere iniziata immediatamente. Un catetere atriale può anche essere la scelta primaria di accesso vascolare, in particolare nei pazienti anziani e in quelli con condizioni vascolari periferiche molto precarie e insufficienza cardiaca grave. Dopo ogni dialisi, i volumi del catetere vengono bloccati con una soluzione speciale (ad esempio, liquemina o soluzione di citrato). La manipolazione dei cateteri per la dialisi a lungo termine deve essere effettuata solo da personale addestrato per la dialisi, altrimenti le complicazioni come la disfunzione o le infezioni del catetere sono pre-programmate [7].
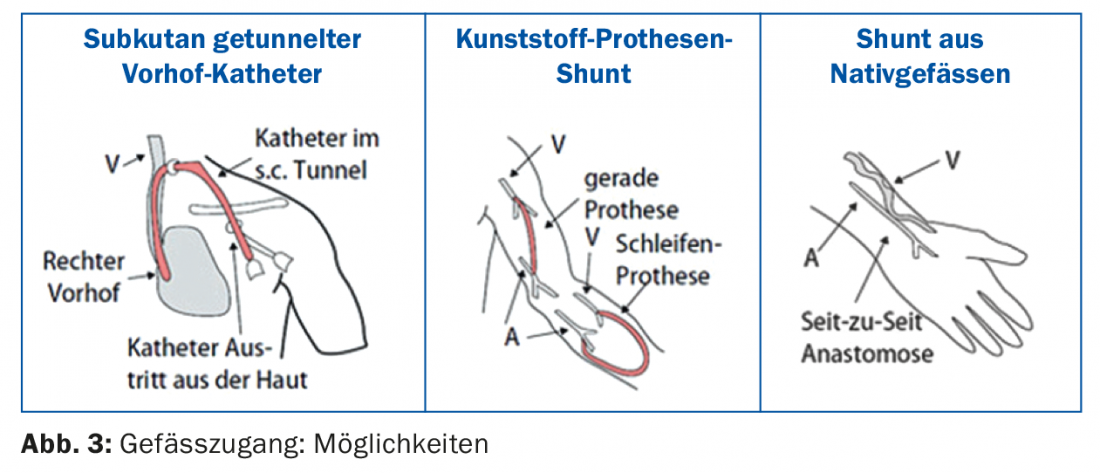
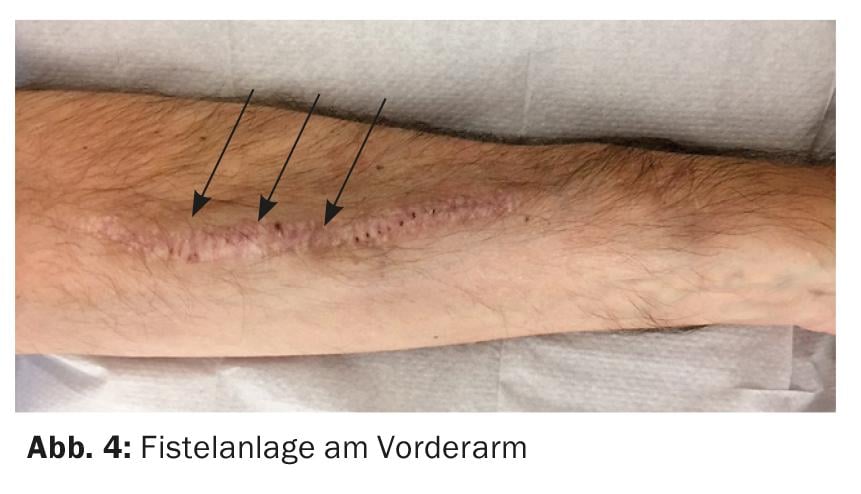
Il miglior accesso vascolare è ancora una fistola artero-venosa (AV) nativa. Preferibilmente, la fistola viene creata nell’avambraccio non dominante (Fig. 4) . Un’alternativa è quella di utilizzare la vena cefalica della parte superiore del braccio, ma con un vaso di grande diametro c’è il rischio di uno shunt iperdinamico con il pericolo di stress cardiaco.
L’alternativa a una fistola nativa è uno shunt protesico in plastica, ad esempio sotto forma di protesi ad anello sull’avambraccio. È importante che il braccio con uno shunt per dialisi funzionante venga utilizzato solo come accesso vascolare per la dialisi, evitando il prelievo di sangue o le cannule indwelling.
Aspetti dietetici
Gli aspetti dietetici devono essere considerati sia nella PD che nella HD. Nel corso del trattamento dialitico, è prevedibile una diminuzione della funzione residua e, parallelamente, diventa più importante la restrizione di potassio, fosfato, sale e liquidi. Per entrambe le procedure, vale il principio dell’assunzione di liquidi: diuresi residua + 800 ml al giorno, assunzione di soluzione salina 4-6 g al giorno. Soprattutto nei pazienti in emodialisi, è necessaria una restrizione nutritiva del potassio (Tab. 1) e l’uso di scambiatori di ioni cat (ad esempio, polisterolo sulfonato, Resonio A). I farmaci che aumentano il potassio sierico (ACE-inibitori, bloccanti dell’angiotensina II) devono essere usati con cautela; lo spirolonactone e il Bactrim ad alte dosi non devono essere usati.

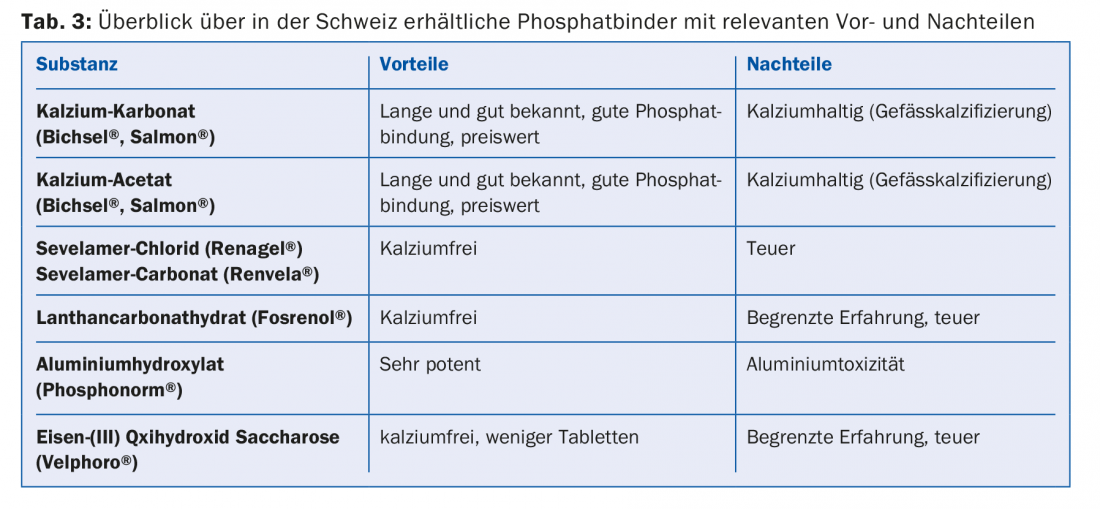
Un altro problema è l’iperfosfatemia, poiché la dialisi può eliminare solo una parte del fosfato riassorbito. L’iperfosfatemia persistente è accompagnata da una crescente calcificazione dei vasi [9], per cui i pazienti in dialisi a lungo termine spesso soffrono di arteriosclerosi grave generalizzata. Allo stesso tempo, l’iperfosfatemia promuove l’iperparatiroidismo secondario renale [8]. Per questi motivi, da un lato è necessaria una dieta a basso contenuto di fosfati (alimenti contenenti fosfati, tab. 2) con l’assunzione contemporanea di leganti del fosfato. Distinguiamo tra leganti del fosfato contenenti calcio e leganti del fosfato senza calcio, che differiscono per potenza, profilo di effetti collaterali e interazioni (Tab. 3).

Aspetti farmacologici
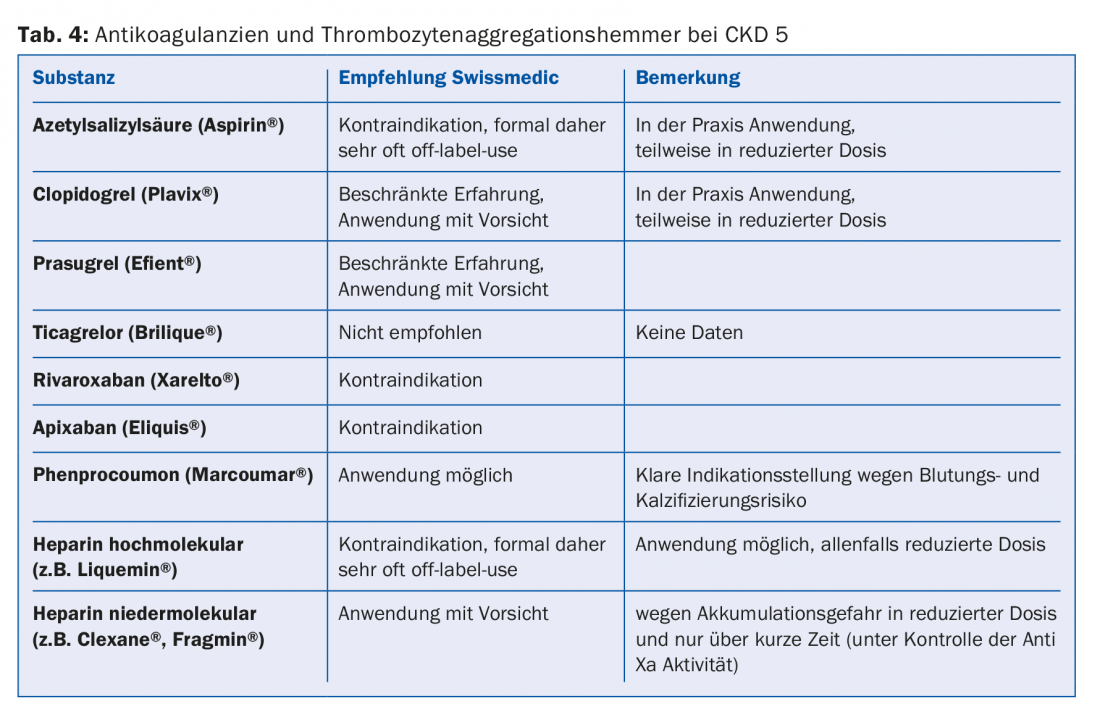
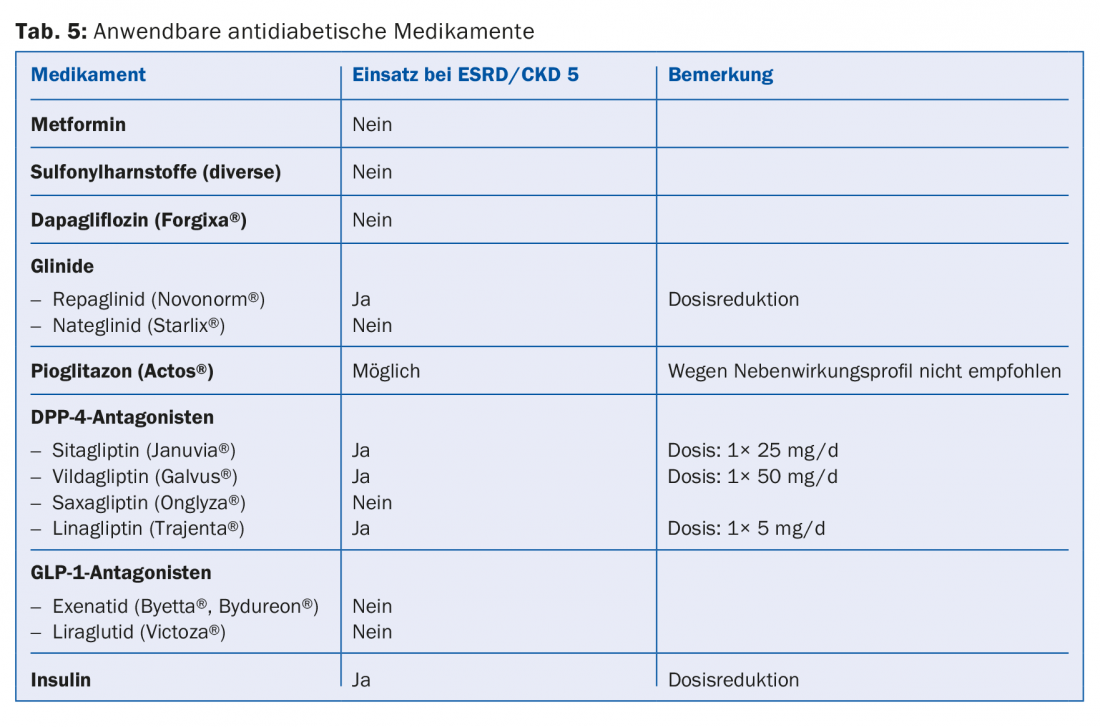
Una buona parte dei farmaci o i loro metaboliti vengono eliminati per via renale. Pertanto, le controindicazioni assolute e relative devono essere regolate in base alle linee guida (ad esempio, Compendium). Questo è particolarmente vero per la maggior parte degli antibiotici, degli anticoagulanti e degli antiaggreganti (tab. 4). Poiché il 30-40% dei pazienti in dialisi ha il diabete, è importante evitare del tutto alcuni farmaci antidiabetici (ad esempio metformina, sulfoniluree) o ridurre la dose (ad esempio sitagliptin, vildagliptin, ecc.) (tab. 5) [10]. Per quanto riguarda i farmaci antidolorifici, gli antinfiammatori non steroidei devono essere somministrati solo per un breve periodo di tempo, se non addirittura per nulla (rischio di iperkaliemia, riduzione della diuresi residua, ulteriore disturbo dell’aggregazione piastrinica). I preparati di paracetamolo (fino a 3 g/die) e il metamizolo sono considerati relativamente sicuri. Gli oppiacei devono essere assunti a basse dosi; anche in questo caso, bisogna tenere conto dell’accumulo di metaboliti. I preparati a base di buprenorfina o fentanil sono adatti a questo scopo (di solito con un GFR <15 ml/min). Dimezzamento della dose [11]. I preparati a base di codeina sono meno adatti (rischio di accumulo e potenziale di interazione). Allo stesso modo, il tramadolo deve essere dosato solo a basso dosaggio. Controindicata è la petidina (rischio di convulsioni).
Importanza dell’assistenza del medico di famiglia
Nei pazienti in emodialisi che vengono visitati tre volte alla settimana, il nefrologo è spesso anche il medico di base. Per i pazienti più lontani dal centro di dialisi o che vivono in un istituto di cura, il medico di famiglia ha ancora un’alta priorità. Questo vale anche per i pazienti con CAPD, che vengono visitati nel centro di dialisi solo ogni 1-2 mesi.
Il medico di famiglia è importante anche come confidente quando un paziente anziano con una qualità di vita in declino decide di interrompere il trattamento dialitico. L’interruzione attiva della dialisi è responsabile di quasi il 20% dei decessi annuali nei pazienti con sostituzione renale. Il medico di famiglia, che conosce il paziente da anni, è in grado di giudicare se si tratta di un equilibrio di vita o, al massimo, di una depressione (curabile). Questo problema dovrebbe essere affrontato con i farmaci prima di prendere l’importante decisione di interrompere il trattamento dialitico.
Letteratura:
- Associazione svizzera per i compiti comuni dell’assicurazione malattia (SVK): www.svk.org/assets/uploads.
- Elsässer H, et al: Pianificare una procedura di sostituzione renale: cosa bisogna sapere? Schweiz Med Forum 2008; 8: 70-74.
- Kleophas W: Quando è il momento giusto per iniziare la terapia renale sostitutiva? Nefrologo 2012; 7: 96-103.
- Cooper BA, et al: Un percorso randomizzato e controllato di inizio precoce rispetto a quello tardivo della dialisi. N Engl J Med 2010; 363: 609-619.
- Kribben A, et al: Stato, indicazioni e limiti della dialisi peritoneale. Nefrologo 2007; 2: 74-81.
- KDOQI. Linee guida di pratica clinica per l’accesso vascolare. Am J Kidney Dis 2006; 48: 176-247.
- Quick-Alert: “Uso improprio dei cateteri per dialisi”; in corso (Sicurezza dei pazienti Svizzera).
- Gruppo di lavoro CKD-MBD Malattia renale: migliorare gli esiti globali (KDIGO). Linea guida di pratica clinica KDIGO per la diagnosi, la valutazione, la prevenzione e il trattamento della malattia renale cronica-disordine minerale e osseo (CKD-MBD), Kidney Int 2009; 76(Suppl): 1-130.
- Herzog CA, et al: Malattie cardiovascolari nella malattia renale cronica. Un modulo di aggiornamento clinico Malattia renale; miglioramento degli esiti globali (KDIGO). Kidney Int 2011; 80: 572-586.
- Zanchi A, et al: Insufficienza renale e diabete, agire con lungimiranza. Schweiz Med Forum 2014; 14(6): 100-104.
- Liechti ME: Farmacologia degli analgesici per la pratica, parte 2: gli oppioidi. Switzerland Med Forum 2014; 14: 460-464.
PRATICA GP 2016; 11(10): 32-38