La risposta Th2 della dermatite atopica è fortemente controllata dall’IL-13, che attiva il recettore di tipo II legandosi alla catena IL-13Rα. L’IL-13 è espressa a un livello superiore rispetto all’IL-4 nella pelle lesionata dei pazienti con dermatite atopica e gli effetti dannosi diretti sulla pelle sono sempre più noti. Influenzando in modo specifico questi meccanismi patologici, ci avviciniamo all’obiettivo della medicina di precisione personalizzata.
La dermatologia, come la pelle stessa, è in costante evoluzione. Come in ogni altro settore della medicina, la nostra comprensione dei processi fisiopatologici di base si è ampliata notevolmente e stiamo imparando ogni giorno. Per molto tempo, l’unico trattamento per la dermatite atopica consisteva prevalentemente nell’uso di steroidi molto potenti, integrati al massimo da inibitori topici della calcineurina, fototerapia e, nelle forme più gravi, immunosoppressori come la ciclosporina A. Questo approccio può ora essere sempre più ampliato attraverso un uso molto più mirato dei farmaci, grazie alla nostra comprensione più dettagliata della patologia sottostante [1].
La dermatite atopica, come l’alopecia areata o l’asma bronchiale, è una malattia dominante di tipo 2, causata da interazioni complesse tra genetica e ambiente. Ciononostante, si possono identificare dei punti in comune tra fenotipi clinicamente molto diversi. Alcune interleuchine e i loro recettori, nonché le vie di segnalazione a valle, hanno dimostrato di essere di importanza centrale.
L’origine della risposta immunitaria T2 risiede probabilmente nella protezione contro le infezioni parassitarie. Oltre alle classiche cellule T helper di tipo 2 (cellule Th2), le fonti delle citochine essenziali IL-4, IL-13 e IL-5 includono le cellule linfoidi innate di tipo 2 (ILC-2), i mastociti e i basofili. L’IL-5 svolge anche un ruolo chiave nella maturazione e nel reclutamento degli eosinofili nella maggior parte dei tessuti, dove agiscono come cellule effettrici delle reazioni allergiche [2].
Modalità d’azione molecolare
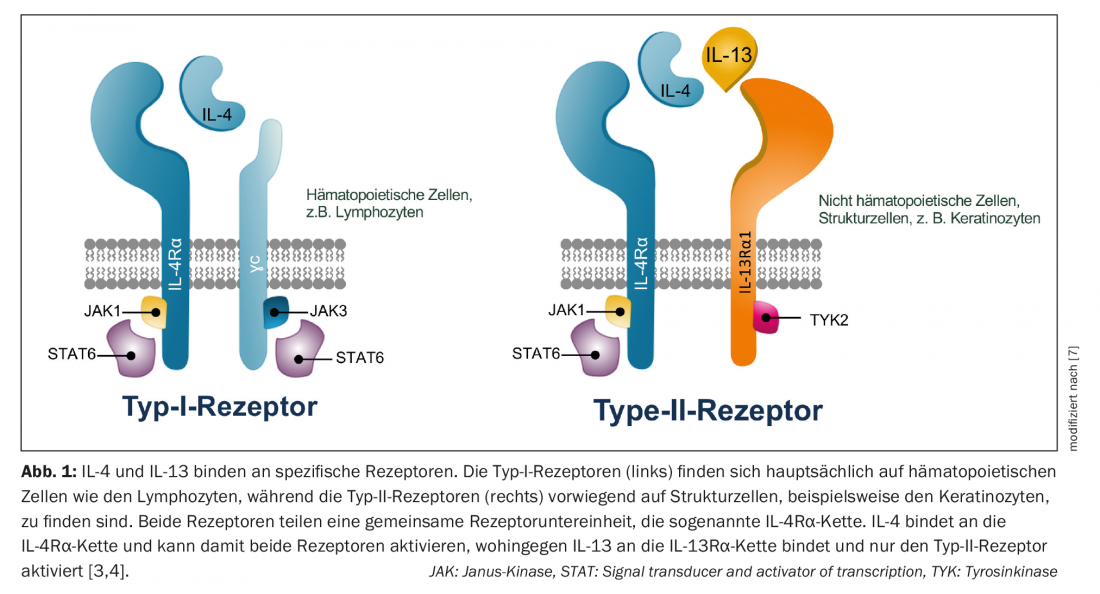
IL-4 e IL-13 si legano a recettori specifici. I recettori di tipo I sono espressi principalmente nei linfonodi e svolgono un ruolo nella risposta immunitaria umorale, mentre i recettori di tipo II mediano la risposta immunitaria nei tessuti periferici e quindi nella pelle. L’IL-4 può attivare entrambi i recettori, mentre l’IL-13 attiva solo il recettore di tipo II [3]. Sia l’IL-13 che l’IL-4 si legano al cosiddetto recettore di tipo II, costituito dalla subunità IL-4Rα e dalla subunità IL-13Rα1. In questo processo, le due citochine competono per legarsi al recettore di tipo II – pertanto, il rapporto IL-4/IL-13 presente determina quale delle due citochine controlla la risposta infiammatoria [4] (Fig. 1). Inoltre, l’IL-13 si lega al recettore IL-13Rα2, il cui ruolo, tuttavia, non è ancora stato completamente chiarito [5]. La risposta Th2 della dermatite atopica probabilmente non è controllata prevalentemente dall’IL-4, come si pensava in precedenza, ma piuttosto principalmente dall’IL-13 attraverso il recettore di tipo II [6–8].
Espressione e progressione della malattia di IL-13
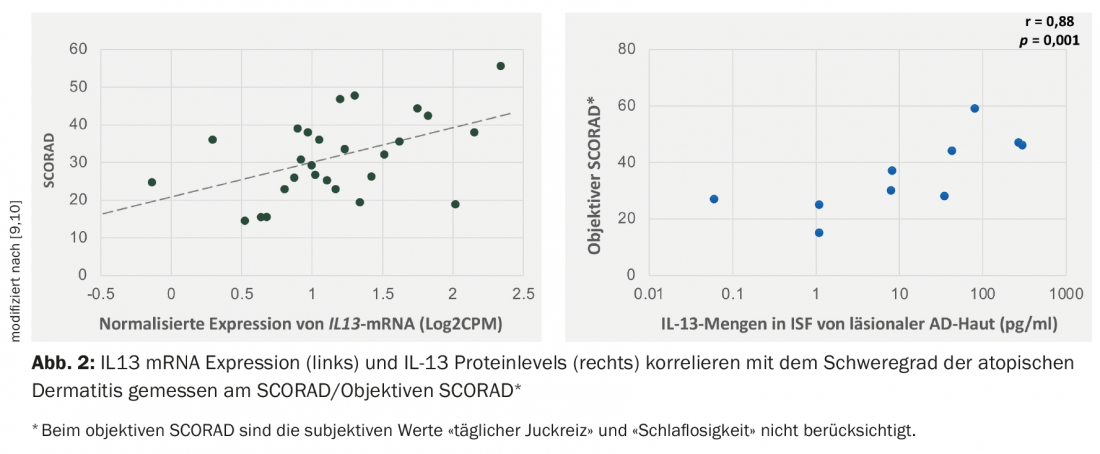
Gli studi hanno dimostrato che l’IL-13 è espressa in misura maggiore rispetto all’IL-4 nella pelle lesionata dei pazienti con dermatite atopica. Il livello di espressione del mRNA dell’IL13 si correla positivamente con l’indice di gravità (SCORAD, SCORing Atopic Dermatitis) [9–11] (Fig. 2).
Cascata di segnalazione intracellulare
Prendere di mira le vie di segnalazione coinvolte nella malattia è l’obiettivo della medicina di precisione (vedere la sezione seguente). Il legame di IL-13 e IL-4 ai loro recettori attiva le chinasi a valle che si fosforilano a vicenda. Al recettore di tipo II, l’IL-4 si lega tramite la catena IL-4Rα e l’IL-13 si lega tramite la catena IL-13Rα e attiva la Janus chinasi (JAK) 1 e la tirosina chinasi 2 (TYK2). Il legame dell’IL-4 con il recettore di tipo I attiva JAK1 e JAK3 [4]. L’IL-5, che è importante per il reclutamento degli eosinofili come cellule effettrici importanti nelle allergie, attiva anche JAK2 [12]. La fosforilazione delle rispettive JAK attiva il fattore di trascrizione STAT6 (Signal transducer and activator of transcription 6), che avvia l’espressione genica nel nucleo cellulare. Poiché le JAK sono coinvolte in una varietà di cascate di segnalazione attraverso diversi tipi di recettori, il loro blocco con gli inibitori delle JAK (JAKis) è un altro approccio terapeutico possibile ed efficace, ma meno specifico [13].
Effetti della sovraespressione di IL-13 sulla pelle
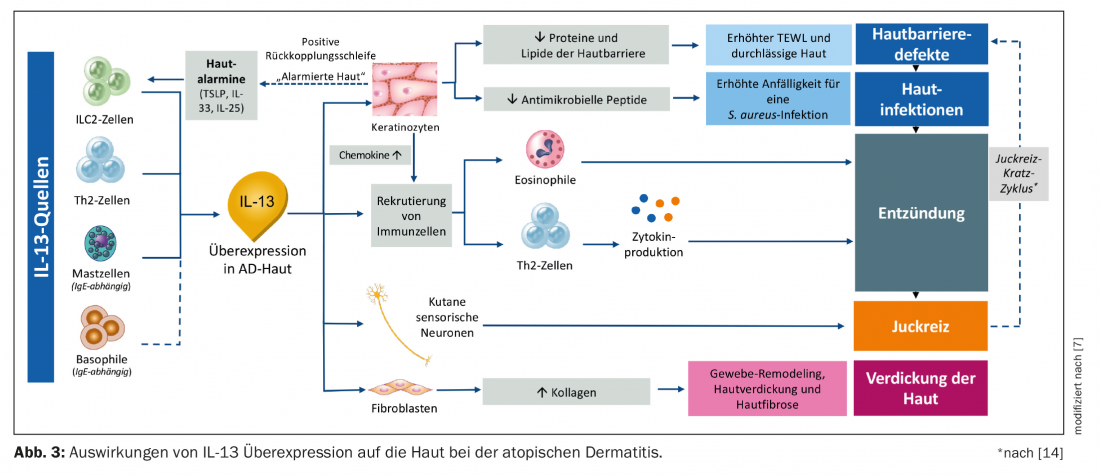
Nella dermatite atopica, l’IL-13 è sempre più prodotta dai mastociti, dalle cellule Th2, ILC-2 e dai basofili. I cheratinociti secernono le cosiddette allarmine (TSLP, IL-33, IL-25) e stimolano così le cellule ILC-2 a secernere IL-13 e IL-5. Allo stesso tempo, questo riduce la secrezione di peptidi e lipidi antimicrobici, il che rende la barriera cutanea più permeabile e determina una maggiore suscettibilità allo S. aureus e all’infiammazione cutanea. La sovrapproduzione di IL-13 allerta anche il sistema immunitario, causando un aumento della produzione di eosinofili e cellule Th2 e innescando l’infiammazione mediata da citochine del tessuto (Fig. 3) [7]. Sono coinvolte anche altre citochine come IL-10, IL-22 e IL-31 [8].
L’aumento del prurito è dovuto alla stimolazione ripetuta dei neuroni sensoriali cutanei, che rilasciano più IL-4 e IL-13 [7]. Un’altra citochina con un potenziale altamente pruritogeno è l’IL-31 [15,16]. Il rilascio di queste sostanze porta a un ciclo prurito-graffio che aumenta ulteriormente la permeabilità della barriera cutanea. Il ciclo di feedback innescato da questo fa sì che i cheratinociti entrino di nuovo in allerta e producano più allarmine cutanee, che stimolano di nuovo le cellule ILC-2 a produrre ancora più IL-13. Attraverso questo ciclo, la cascata di segnalazione viene avviata di nuovo e lo stato di malattia peggiora. Inoltre, i fibroblasti vengono stimolati a riprodursi tramite l’IL-13; la produzione di collagene aumenta, il che può provocare un ispessimento della pelle e un’ulteriore fibrosi cutanea. A lungo termine, questo porta alla lichenificazione cronica della pelle [5,17–22].
Strategie terapeutiche
La dermatite atopica è una patologia fortemente controllata dall’IL-13. Sono possibili le seguenti strategie terapeutiche per inibire l’attività biologica [7]:
- piccole molecole che influenzano l’interazione tra IL-13 e il recettore: Modulatori dell’interazione proteina-proteina (PPIM).
- piccole molecole che influenzano le vie di segnalazione intracellulare a valle (inibitori delle chinasi, JAKis).
- Biologici che inibiscono la segnalazione attraverso l’IL-13, ad esempio bloccando il suo legame con il recettore.
I PPIM sono attualmente oggetto di ricerca; vengono progettati con l’aiuto di librerie molecolari e simulazioni dinamiche. Questo approccio in silicoconsente lo sviluppo di nuovi farmaci mirati a interleuchine specifiche e ai loro recettori [7,23].
I JAKis con diversa selettività sono già in uso nel trattamento dell’artrite reumatoide. Le applicazioni orali e topiche sono possibili per il trattamento della dermatite atopica e l’inizio dell’azione è molto rapido. Grazie alla loro modalità d’azione, le JAKis inibiscono parzialmente diverse citochine, ad esempio IL4, IL-5, IL-31 e altre citochine oltre a IL-13 – a differenza dei biologici, che inibiscono solo singole citochine quasi completamente. I JAKis di prima generazione inibiscono principalmente JAK1 e JAK2 (ruxolitinib e baricitinib) o tutte le JAK in misura simile (pan-JAKis delgocitinib, tofacitinib, peficitinib, oclacitinib) [13,24–27]. Baricitinib è già approvato in Svizzera per il trattamento di pazienti adulti con AD da moderata a grave [28]. Oclacitinib ha un’autorizzazione all’immissione in commercio in ambito veterinario per il trattamento dell’AD nei cani [29]. I JAKis di seconda generazione sono un po’ più selettivi e agiscono principalmente, ma non esclusivamente, su JAK1 (abrocitinib, filgotinib, upadacitinib, itacitinib) o TYK2 (BMS-986165) [25–27]. I profili di sicurezza e tollerabilità dei vari JAKis differiscono a seconda della forma di dosaggio e della molecola. Nel complesso, le infezioni del tratto respiratorio superiore sono osservate come l’effetto collaterale più comune; inoltre, si può misurare un aumento della creatina fosfochinasi e delle transaminasi epatiche. Inoltre, un aumento del rischio di sviluppare l’herpes zoster è un possibile effetto collaterale [25,28].
Un biologico di prima generazione per il trattamento della dermatite atopica è dupilumab, un anticorpo monoclonale somministrato per via sottocutanea che si lega alla subunità IL-4Rα dei recettori di tipo I e II. Quindi, l’effetto di segnalazione mediato da IL-4 e IL-13 è impedito dai recettori di tipo I e II. Dupilumab è stato approvato per il trattamento dei pazienti con dermatite atopica da moderata a grave in Svizzera dal 2019 [30]. Ha un’ottima efficacia e un profilo di tollerabilità favorevole. Oltre alla dermatite atopica, può essere utilizzato anche per diverse altre condizioni, come le forme gravi di asma bronchiale e la rinosinusite cronica con polipi nasali. Si noti la comparsa di eosinofilia transitoria e l’aumento della congiuntivite come sintomi concomitanti più comuni; altri effetti collaterali o cambiamenti nei parametri di laboratorio sono molto rari [2,31–33].
Medicina di precisione attraverso l’inibizione selettiva dell’IL-13
Il blocco mirato e specifico delle vie di segnalazione molecolare è l’obiettivo della medicina di precisione. Lo sviluppo dei PPIM probabilmente indicherà la strada per il futuro. Per l’inibizione specifica dell’IL-13, finora sono stati sviluppati i biologici lebrikizumab e tralokinumab, entrambi già studiati nella dermatite atopica [34]. Lebrikizumab inibisce selettivamente la formazione di complessi di segnalazione recettoriale eterodimerici di IL-13Rα1 e IL-4Rα [35]. Gli studi di fase IIb hanno mostrato effetti rapidi, dose-dipendenti su vari parametri clinici nella dermatite atopica [36]. Tralokinumab è un anticorpo monoclonale IgG4 completamente umano che si lega con un’affinità molto elevata all’IL-13. L’epitopo si sovrappone al sito di legame dei recettori IL-13Rα, impedendo il legame dell’IL-13 sia con IL-13Rα1 che con IL-13Rα2 [37]. In questo modo, un importante fattore della patogenesi della dermatite atopica viene eliminato in modo selettivo.
È stato ipotizzato che questa strategia possa essere più efficace del solo blocco del legame di IL-13Rα1 [9]. Negli studi clinici condotti su pazienti con dermatite atopica da moderata a grave, tralokinumab in combinazione con gli steroidi ha determinato un miglioramento rapido e sostenuto dei sintomi della DA per almeno 52 settimane. L’EASI, l’indice SCORAD, l’indice di qualità di vita dermatologica (DLQI) e la scala di valutazione numerica del prurito hanno mostrato punteggi significativamente migliori rispetto al gruppo placebo [2,38–40]. Inoltre, è stato dimostrato un buon profilo di tollerabilità e sicurezza, anche con un’eosinofilia transitoriamente misurabile e un leggero aumento dell’incidenza di congiuntivite, con una contemporanea riduzione delle infezioni cutanee rispetto al gruppo di controllo [7,39,40].
Prospettiva
La dermatite atopica è caratterizzata da un ampio spettro di fenotipi clinici. Riconosciamo sempre più che alla base di questa malattia ci sono complessi meccanismi basali, genetici e immunopatogenetici. L’assenza di un singolo fattore, che spieghi tutto, complica la risposta terapeutica e richiede una terapia personalizzata. Il trattamento su misura è la sfida e l’obiettivo della medicina centrata sul paziente. L’IL-13 è espressa a un livello superiore rispetto all’IL-4 nella pelle lesionata dei pazienti con dermatite atopica e gli effetti dannosi diretti sulla pelle sono sempre più noti. Quanto più riusciremo a influenzare in modo specifico questi pato-meccanismi, tanto più ci avvicineremo all’obiettivo di una medicina di precisione personalizzata anche nella dermatite atopica.
Messaggi da portare a casa
- Le fonti delle citochine IL-4, IL-13, IL-5 sono le cellule Th2 e le cellule ILC-2, i mastociti e i basofili.
- L’IL-4 si lega ai recettori di tipo I e di tipo II.
- L’IL-13 si lega solo ai recettori di tipo II presenti nella pelle.
- La risposta Th2 della dermatite atopica è fortemente controllata dall’IL-13, che attiva il recettore di tipo II legandosi alla catena IL-13Rα.
- L’IL-13 è espressa a un livello superiore rispetto all’IL4 nei pazienti con dermatite atopica e si correla con la gravità della malattia.

Letteratura:
- Siegels D, Heratizadeh A, Abraham S, European Academy of Allergy, Clinical Immunology Atopic Dermatitis Guideline group, et al: European Academy of Allergy, Clinical Immunology Atopic Dermatitis Guideline group. Trattamenti sistemici nella gestione della dermatite atopica: una revisione sistematica e una meta-analisi. Allergia. 2021;76: 1053-1076.
- Gandhi NA, Bennett BL, Graham NM, et al.: Prendere di mira i fattori chiave prossimali dell’infiammazione di tipo 2 nella malattia. Nat Rev Drug Discov. 2016;15: 35-50.
- Mueller TD, Zhang JL, Sebald W, Duschl A: Struttura, legame e antagonisti nel sistema dei recettori IL-4/IL-13. Biochim Biophys Acta. 2002;1592(3): 237-250.
- McCormick SM, Heller NM: Commento: recettori e segnalazione di IL-4 e IL-13. Citochine. 2015; 75: 38-50.
- Bao K, Reinhardt RL: L’espressione differenziale dell’IL-4 e dell’IL-13 e il suo impatto sull’immunità di tipo-2. Citochine. 2015; 75: 25-37.
- Leung DY, Bieber T: Dermatite atopica. Lancet 2003; 361: 151-160. [PubMed: 12531593]
- Bieber T: Interleuchina-13: puntare su una citochina sottovalutata nella dermatite atopica. Recensione. Allergia 2020; 75: 54-62.
- Langan SM, Irvine AD, Weidinger S: Dermatite atopica. Lancet. 2020; 396: 345-360.
- Tsoi J, Rodriguez E, Sarkar MK, et al: La dermatite atopica è una malattia dominante IL-13 con una maggiore eterogeneità molecolare rispetto alla psoriasi. J Invest Dermatol 2019;139: 1480-1489.
- Szegedi K, Lutter R, et al: Profili di citochine nel liquido interstiziale della pelle della dermatite atopica cronica. JEADV 2015; 29: 2136-2144.
- Ungar B, Garcet S, Gonzalez J, et al: Un modello integrato di biomarcatori della dermatite atopica evidenzia la natura sistemica della malattia. J Invest Dermatol 2017; 137: 603-613.
- Long H, Liao W, Wang L, Lu Q: Un attore e un coordinatore: i ruoli versatili degli eosinofili nel sistema immunitario. Transfus Med Hemother. 2016; 43: 96-108.
- Mobasher P, Heydari Seradj M, Raffi J, et al: Piccole molecole orali per il trattamento della dermatite atopica: una revisione sistematica. J Dermatolog Treat. 2018; 201: 1-8.
- Mack MR, Kim BS: Il ciclo prurito-graffio: una prospettiva neuroimmunitaria. Trends Immunol 2018; 39: 980-991.
- Datsi A, Steinhoff M, Ahmad F, et al.: Interleuchina-31: La citochina “pruriginosa” nell’infiammazione e nella terapia. Allergia. 2021 Feb 24. doi: 10.1111/all.14791. Pubblicato prima della stampa.
- Dillon SR, Sprecher C, Hammond A, et al; L’interleuchina 31, una citochina prodotta dalle cellule T attivate, induce la dermatite nei topi. Nat Immunol 2004;5: 752-760.
- Salimi M, Barlow JL, Saunders SP, et al.: Un ruolo per le cellule linfoidi innate di tipo 2 guidate da IL-25 e IL-33 nella dermatite atopica. J Exp Med. 2013; 210: 2939-2950.
- Moriya C, Jinnin M, Yamane K, et al: L’espressione della metalloproteinasi-13 della matrice è controllata dall’IL-13 tramite PI3K/Akt3 e PKC-d nei fibroblasti dermici umani normali. J Invest Dermatol 2011; 131: 655-661.
- Howell MD, Kim BE, Gao P, et al: Modulazione delle citochine dell’espressione cutanea della filaggrina nella dermatite atopica. J Allergy Clin Immunol 2007; 120: 150-155.
- Kim BE, Leung DY, Boguniewicz M, Howell MD: L’espressione della loricrina e dell’involucrina è regolata dalle citochine Th2 attraverso STAT-6. Clin Immunol 2008; 126: 332-337.
- Berdyshev E, Goleva E, Bronova I, et al. Le anomalie lipidiche nella pelle atopica sono determinate dalle citochine di tipo 2. JCI Insight. 2018;3(4). https://doi.org/10.1172/jci.insight.98006
- Oetjen LK, Mack MR, Feng J, et al: I neuroni sensoriali cooptano le classiche vie di segnalazione immunitaria per mediare il prurito cronico. Cell 2017; 171: 217-228.
- Majumdar S, Ghosh A, Saha S: Modulazione delle interazioni delle interleuchine e dei loro recettori con piccole sostanze chimiche utilizzando un approccio in silico per l’asma. Curr Top Med Chem 2018; 18: 1123-1113.
- Gadina M, Le MT, Schwartz DM, et al: Dalle chinasi di Janus ai jakinib: dalle intuizioni di base alla pratica clinica. Reumatologia. 2019;58(suppl 1): i4-i16.
- Rodrigues MA, Torres T: Inibitori di JAK/STAT per il trattamento della dermatite atopica. J Dermatolog Treat. 2020; 31: 33-40.
- Cotter DG, Schairer D, Eichenfield L: Terapie emergenti per la dermatite atopica: gli inibitori JAK. J Am Acad Dermatol. 2018;78(suppl 1): S53-S62.
- Schwartz DM, Kanno Y, Villarino A, et al: L’inibizione di JAK come strategia terapeutica per le malattie immunitarie e infiammatorie. Nat Rev Drug Discov 2017: 843-862.
- Informazioni sul prodotto Olumiant® (baricitinib). www.swissmedicinfo.ch
- Informazioni specialistiche Apoquel® (oclacitinib). www.tierarzneimittel.ch
- Informazioni tecniche Dupixent® (Dupilumab). www.swissmedicinfo.ch
- Chang HY, Nadeau KC. Inibitore di IL-4Ralfa per la malattia atopica. Cellula. 2017;170:222.
- Beck LA, Thaçi D, Hamilton JD, et al: Trattamento con dupilumab negli adulti con dermatite atopica da moderata a grave. N Engl J Med. 2014 Jul 10; 371: 130-139.
- Simpson EL, Bieber T, Guttman-Yassky E, et al: Due studi di fase 3 su dupilumab rispetto al placebo nella dermatite atopica. N Engl J Med. 2016; 375: 2335-2348.
- Gonçalves F, Freitas E, Torres T: Inibitori selettivi dell’IL-13 per il trattamento della dermatite atopica. Contesto della droga. 2021;10: 1-7.
- Ultsch M, Bevers J, Nakamura G, et al: Base strutturale del blocco della segnalazione da parte dell’anticorpo anti-IL-13 Lebrikizumab. J Mol Biol. 2013; 425(8): 1330-1339.
- Guttman-Yassky E, Blauvelt A, Eichenfield LF, et al: Efficacia e sicurezza di Lebrikizumab, un inibitore dell’Interleuchina 13 ad alta affinità, negli adulti con dermatite atopica da moderata a grave: uno studio clinico randomizzato di fase 2b. JAMA Dermatol 2020 Apr 1; 156(4): 411-420.
- Popovic B, Breed J, Rees DG, et al: La caratterizzazione strutturale rivela il meccanismo dell’anticorpo monoclonale neutralizzante l’IL-13, tralokinumab, come inibizione del legame con IL-13Ralfa1 e IL-13Ralfa2. J Mol Biol 2017;429: 208-219.
- Wollenberg A, Howell MD, Guttman-Yassky E, et al: Trattamento della dermatite atopica con il tralokinumab, un mAb anti-IL-13. J Allergy Clin Immunol 2019; 143: 135-141.
- Wollenberg A, Blauvelt A, Guttman-Yassky E, et al: Tralokinumab per la dermatite atopica da moderata a grave: risultati di due studi di fase III, randomizzati, in doppio cieco, multicentrici, controllati con placebo, della durata di 52 settimane (ECZTRA 1 e ECZTRA 2). Br J Dermatol 2021; 184: 437-449.
- Silverberg JI, Toth D, Bieber T, et al: Tralokinumab più corticosteroidi topici per il trattamento della dermatite atopica da moderata a grave: risultati dello studio di fase III ECZTRA 3 in doppio cieco, randomizzato, multicentrico, controllato con placebo. Br J Dermatol 2021; 184: 450-463.
PRATICA DERMATOLOGICA 2021; 31(4): 10-14