I programmi di screening aumentano l’incidenza degli stadi precoci del cancro al polmone. La chirurgia è ancora la prima scelta di trattamento. Con una linfadenectomia accurata, la resezione del segmento anatomico è un’alternativa equivalente alla lobectomia.
Il cancro ai polmoni è il secondo tumore più comune in Svizzera, con un’incidenza dell’11,9% negli uomini e il terzo più comune nelle donne, con un’incidenza dell’8,7%. Il tasso di mortalità è il più alto negli uomini (21,9%) e il secondo più alto nelle donne (15,4%) – e la tendenza è in aumento [1]. Ciò è dovuto principalmente al fatto che la diagnosi iniziale viene spesso fatta in uno stadio avanzato e prognosticamente sfavorevole. Ecco perché i programmi di diagnosi precoce sono diventati importanti.
I-ELCAP (International Early Lung Cancer Action Program), il programma internazionale per la diagnosi precoce del cancro al polmone, esiste dal 1992. In Svizzera, il Programma nazionale di screening del cancro al polmone fa parte dell’I-ELCAP ed è attuato dalla Fondazione per la diagnostica polmonare, istituita nel 2011 [2]. Lo strumento più importante di questo programma di screening è l’esecuzione di una TAC a “basso dosaggio” nei pazienti ad alto rischio senza sintomi come tosse, emottisi, dispnea, raucedine, disfagia o dolore toracico. Questo include tutti i pazienti che hanno avuto in precedenza un tumore al polmone e che ora sono considerati guariti, tutti i fumatori di età superiore ai 50 anni e gli ex fumatori con almeno 20 packyears (py). Inoltre, tutti i pazienti di età superiore ai 50 anni che hanno già tumori del naso e della gola o che sono esposti a sostanze cancerogene (amianto, fumo passivo, cromo, arsenico, ecc.) o che hanno almeno due parenti di primo grado affetti da cancro ai polmoni (Tab. 1) [3].

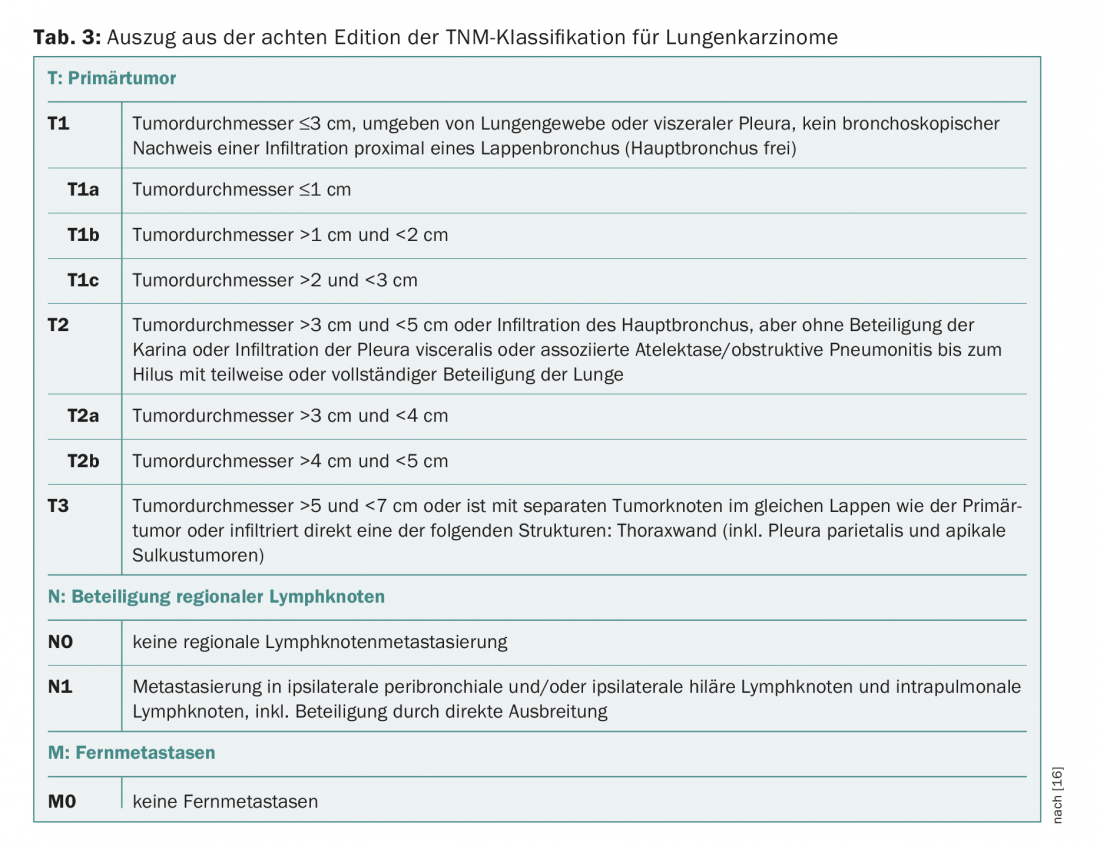
Se si sospetta un tumore al polmone non a piccole cellule (NSCLC) nell’ambito di questo programma di screening, vengono eseguiti ulteriori accertamenti come la broncoscopia con EBUS e la PET-CT. I risultati vengono utilizzati per la classificazione nella classificazione TNM (“metastasi ai nodi tumorali”). A seconda dello stadio TNM, lo stadio clinico è IA, IB, IIA, IIB, IIIA, IIIB o IV, classificato secondo l’ottava edizione dell’AJCC.
Poiché questo articolo è destinato a trattare la terapia degli stadi iniziali del carcinoma polmonare, di seguito ci limiteremo a una panoramica degli stadi IA, IB, IIA e IIB e della loro corrispondente classificazione TNM (Tab. 2 e 3).

Opzioni terapeutiche
Sulla base di questa stadiazione, si possono ora pianificare le ulteriori fasi terapeutiche nell’ambito del comitato interdisciplinare obbligatorio per i tumori. Esistono due diverse opzioni di trattamento per gli stadi precoci I e II: Chirurgia e non chirurgia o radioterapia. Per prendere una decisione tra i due, vengono eseguiti esami come i test di funzionalità polmonare, l’ergometria e, nei casi critici, la spiroergometria in combinazione con la scintigrafia di perfusione, per valutare le condizioni generali del paziente. Si raccomanda di seguire le linee guida ESMO [4].
Radioterapia
La radioterapia è raccomandata per i pazienti che non sono adatti alle opzioni chirurgiche a causa di comorbidità o di una funzione polmonare ridotta (FEV1 minimo postoperatorio <1 litri). All’interno di questo spettro terapeutico, vi sono la radioterapia stereotassica (SBRT), la radioterapia con ablazione stereotassica (SABR) e l’ablazione con radiofrequenza (RFA).
Sebbene negli ultimi anni la radioterapia abbia guadagnato notevolmente in precisione e accuratezza grazie ai progressi tecnici, presenta un importante svantaggio, oltre al noto profilo di effetti collaterali: il trattamento viene effettuato solo sulla base della stadiazione clinica, senza conferma patoanatomica o conferma della diagnosi. Tenga presente che la stadiazione clinica è spesso errata e lo stadio clinico spesso non corrisponde allo stadio patologico [5]: Nell’11-14% dei casi, si trovano linfonodi colpiti occulti che non vengono rilevati con la sola radioterapia [6]. Senza resezione chirurgica e campionamento linfonodale o linfadenectomia radicale, questi pazienti non saranno correttamente stadiati e di conseguenza riceveranno un’assistenza terapeutica inadeguata. Pertanto, la chirurgia rimane la prima scelta per i pazienti con NSCLC in condizioni generali operabili.
Chirurgia
Le opzioni chirurgiche comprendono le lobectomie e le resezioni sublobari (resezione del segmento anatomico e resezione a cuneo) (Fig. 1). In genere, si sceglie un approccio minimamente invasivo (VATS) o aperto (toracotomia), a seconda della posizione del tumore e delle condizioni intraoperatorie. Nella nostra popolazione di pazienti, una tecnica minimamente invasiva viene scelta in un buon 70% dei casi e quindi offre anche opzioni terapeutiche per i pazienti con condizioni generali ridotte.
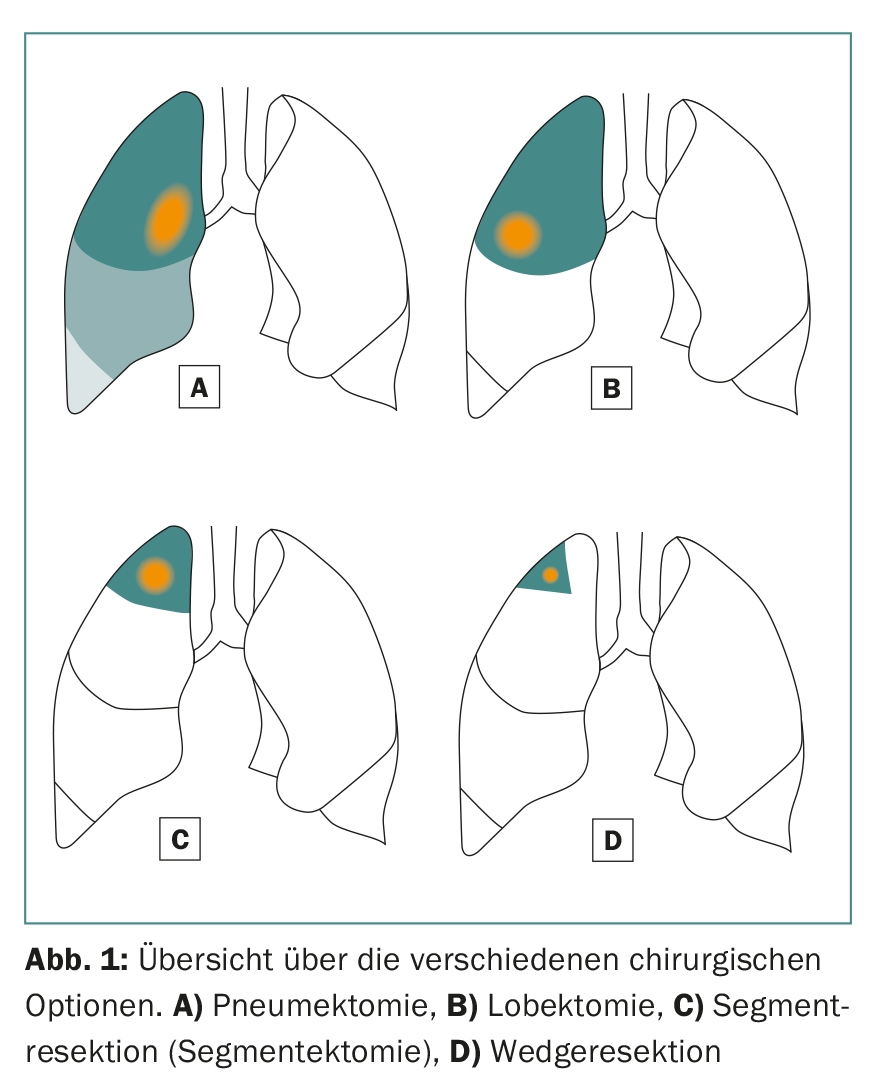
In una lobectomia, come suggerisce il nome, viene rimosso almeno un intero lobo del polmone destro o sinistro. Questo è consigliato per i tumori di dimensioni superiori a 3 cm. Questa procedura ha anche uno svantaggio importante: nel processo si perde molto tessuto polmonare sano e vitale.
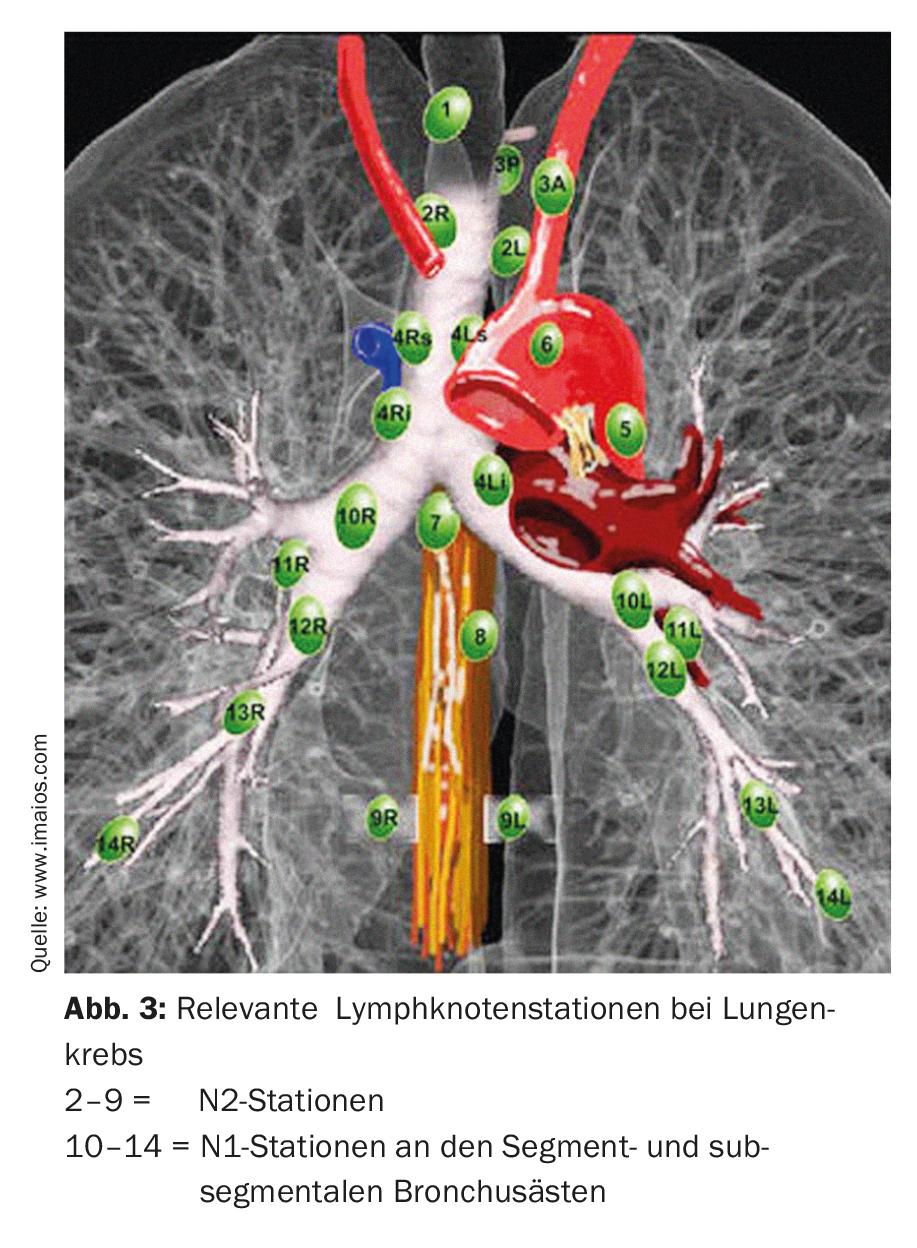
Nella resezione anatomica dei segmenti (segmentectomia), vengono asportati singoli segmenti o fino a tre segmenti (resezione trisegmentale) di singoli lobi, il che consente di preservare una quantità notevolmente maggiore di tessuto polmonare vitale rispetto alla lobectomia. Questo è particolarmente importante per i pazienti con una funzione polmonare ridotta o per eventuali ulteriori resezioni in caso di un secondo o terzo carcinoma polmonare primario [7]. Per eseguire una resezione anatomica del segmento di successo, è importante che il chirurgo conosca le relazioni anatomiche esatte, cioè il polmone e la sua divisione in dieci o nove segmenti per polmone (Fig. 2).
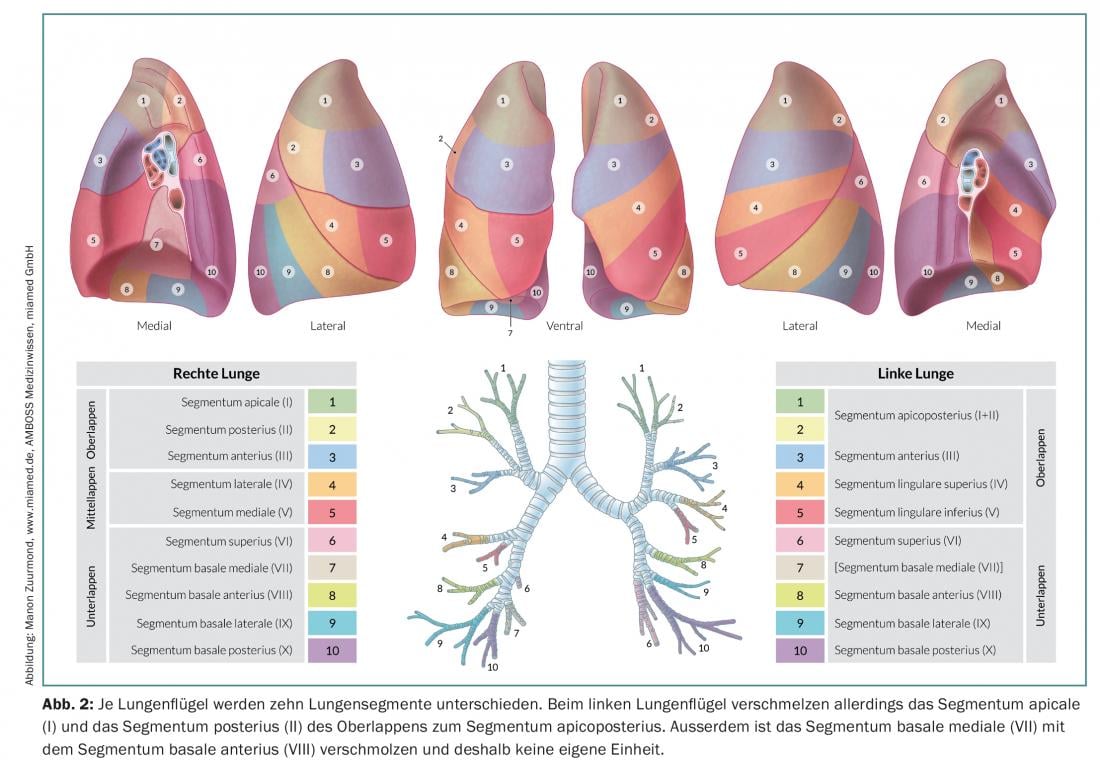
A seconda della posizione e delle dimensioni del tumore, si decide tra segmentectomia o lobectomia. In ogni caso, è importante confermare lo stato N0 con un’accurata dissezione linfonodale mediastinica (dall’ilo al ramo segmentale e subsegmentale del bronco) con analisi in sezione congelata. Se i risultati intraoperatori mostrano un coinvolgimento N1 o N2, la terapia chirurgica deve essere cambiata immediatamente e deve essere eseguita una lobectomia completa con linfoadenectomia radicale. Si devono prendere in considerazione anche l’età e le condizioni generali del paziente. Inoltre, il chirurgo deve conoscere i fattori prognostici per il trattamento chirurgico del NSCLC. Secondo le conoscenze attuali, i seguenti fattori sono fattori prognostici indipendenti (ponderati per importanza) [8]:
- Numero di stazioni linfonodali interessate
- Classificazione e differenziazione istologica
- Linfoinvasione nell’istologia definitiva
- Numero totale di linfonodi colpiti
- Risposta con la terapia neoadiuvante
- Sesso ed età del paziente
- Dimensioni del tumore.
Se un paziente è stato sottoposto a resezione segmentaria e si scopre nel post-operatorio che esistono molti dei fattori di rischio prognostico sopra menzionati, è necessaria una lobectomia di completamento nel senso di un secondo intervento e una chemioterapia additiva deve essere discussa nella commissione tumori.
Confronto tra lobectomia e segmentectomia e linfadenectomia
In passato, si è discusso più volte se la resezione anatomica del segmento potesse sostituire la lobectomia come gold standard per la terapia dei carcinomi di stadio IA. Il vantaggio maggiore della segmentectomia anatomica è la possibilità di resecare il tumore preservando la riserva funzionale del paziente, che potrebbe anche sostituire le opzioni non chirurgiche come trattamento del tumore al polmone nei pazienti con bassa funzionalità polmonare. Studi precedenti hanno mostrato tassi di sopravvivenza più bassi con la resezione sublobare rispetto alla lobectomia [9]. Va notato, tuttavia, che le resezioni non anatomiche e anatomiche sono state raggruppate insieme e che la raccolta dei dati è stata effettuata 25 anni fa.
Studi precedenti hanno dimostrato che un vantaggio di sopravvivenza è associato a un numero crescente di linfonodi resecati: Ludwig et al. ha mostrato che il beneficio in termini di sopravvivenza raggiunge il picco a 13-16 linfonodi resecati e Gulack et al. ha trovato risultati simili (undici linfonodi resecati) [10,11].
Un recente lavoro di Stiles et al. ha studiato il ruolo della linfoadenectomia nel NSCLC di stadio IA ed è stato in grado di dimostrare un vantaggio significativo per la sopravvivenza a lungo termine e la sopravvivenza libera da recidiva locale nei pazienti con resezione sublobare (segmentectomia o resezione a cuneo) e linfoadenectomia rispetto alla resezione sublobare senza linfoadenectomia [12].
Pertanto, se si sceglie la resezione sublobare, la linfoadenectomia sistematica è fondamentale per l’esito postoperatorio e la sopravvivenza a lungo termine.
Radioterapia vs. chirurgia
La radioterapia può essere considerata la procedura di scelta nei casi di tumore al polmone in stadio I e II, nei pazienti che non sono candidati alla resezione chirurgica a causa di comorbidità o di una ridotta funzionalità polmonare.
Lo svantaggio più importante della radioterapia è il fatto che non è disponibile una diagnosi istologica prima della decisione sul trattamento e non viene eseguita una linfoadenectomia di stadiazione. Questo può essere fatale per il futuro della salute del paziente, perché lo stadio clinico e quello patologico divergono, come dimostrato in uno studio di quasi 3000 pazienti di López-Encuentra et al. mostrato. In quel caso, la concordanza era solo del 47% [5]. I linfonodi colpiti in modo occulto non vengono rilevati durante l’ablazione stereotassica, anche se, come già detto, sono presenti nell’11-14% dei casi [6]. Ciò comporta l’assegnazione di un TNM errato e, in ultima analisi, di uno stadio clinico errato.
D’altra parte, oggi quasi tutti gli stadi precoci vengono trattati chirurgicamente con metodi minimamente invasivi (con toracoscopia e/o procedure assistite da robot). L’istologia viene sempre ottenuta, la resezione anatomica segmentale e la linfoadenectomia N1/N2 vengono eseguite sistematicamente. Inoltre, la diagnostica rapida intraoperatoria (tumore primario e linfonodi) crea la possibilità di adattare la strategia terapeutica ottimale nella stessa anestesia – se necessario (estensione della resezione in caso di coinvolgimento dei linfonodi). Tutti i fattori rilevanti e determinanti per la prognosi saranno disponibili anche per la procedura post-operatoria e la ripresentazione alla commissione tumori, cosa che manca completamente nelle procedure radio ablative stereotassiche.
Procedura postoperatoria
Se l’istologia definitiva mostra T1a/b/c N0 M0 o T2a N0 M0 e, di conseguenza, uno stadio IA o IB, non sono raccomandate ulteriori terapie adiuvanti. Come follow-up sono previsti esami fisici e TAC a “basso dosaggio” a intervalli di sei mesi nei primi due anni post-operatori. In seguito, le ispezioni dovranno essere effettuate annualmente. A partire dallo stadio II, le opzioni per la terapia adiuvante devono essere discusse nell’ambito di un comitato tumori interdisciplinare [13].
Terapie adiuvanti
Le terapie a base di cisplatino hanno dimostrato di essere agenti adiuvanti di successo in termini di sopravvivenza a lungo termine nello stadio II in tre studi clinici. Questi vantaggi non sono stati dimostrati per i pazienti in stadio I; al contrario, la chemioterapia adiuvante si è rivelata piuttosto dannosa in questo caso [14].
Le terapie sistemiche più recenti, come la terapia oncologica mirata con anticorpi monoclonali, non sono attualmente consolidate al di fuori degli studi clinici. Attualmente, diversi studi clinici randomizzati stanno valutando il ruolo delle terapie mirate a EGFR o ALK nel contesto adiuvante per i pazienti EGFR- o ALK-positivi. Finora, è stato dimostrato che i pazienti con mutazioni EGFR hanno una sopravvivenza libera da recidiva più lunga con erlotinib. Tuttavia, non è ancora chiaro se questo aumenti anche la sopravvivenza a lungo termine o se prolunghi solo il tempo fino alla ricaduta.
La radioterapia postoperatoria è raccomandata solo nei casi in cui non è stato possibile creare una situazione R0 chirurgicamente [15].
Sommario
Nel contesto della diagnosi precoce, negli ultimi anni sempre più carcinomi polmonari sono stati diagnosticati in fase iniziale. A seconda dello stadio clinico e delle condizioni generali del paziente, la decisione di trattamento tra radioterapia e chirurgia deve essere attentamente ponderata. La chirurgia è ancora il trattamento di scelta per gli stadi iniziali del NSCLC. In questo campo, con l’aumentare dell’esperienza e della competenza, la resezione anatomica segmentale con linfoadenectomia completa sta diventando sempre più importante grazie alla sua esattezza anatomica e al risparmio della riserva funzionale del paziente. Con l’adeguata accuratezza della linfoadenectomia, è un’alternativa equivalente alla lobectomia e una terapia migliore rispetto alla radioterapia.
Messaggi da portare a casa
- I programmi di diagnosi precoce stanno aumentando l’incidenza degli stadi iniziali del cancro al polmone. Questo può ridurre significativamente la mortalità.
- Il tasso di sopravvivenza a 5 anni potrebbe essere aumentato dall’attuale 17% circa (tutti gli stadi del cancro al polmone) a oltre il 50%.
- La chirurgia è ancora la prima scelta per il trattamento degli stadi precoci del carcinoma polmonare, con la competenza adeguata del chirurgo.
- quasi tre quarti di tutti gli interventi possono essere eseguiti con le più recenti tecniche minimamente invasive.
- La resezione del segmento anatomico è ideale per la resezione nei pazienti con funzione polmonare compromessa, grazie al risparmio di tessuto polmonare vitale.
- Con un’adeguata accuratezza della linfoadenectomia, la resezione del segmento anatomico è un’alternativa equivalente alla lobectomia.
- La radioterapia stereotassica e altre procedure ablative sono procedure di seconda scelta, a causa della mancanza di una conferma diagnostica patoanatomica.
Letteratura:
- Krebsliga: Il cancro in Svizzera: figure importanti. 2016. www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- I-ELCAP: Fondazione per la diagnostica polmonare. %C3%diagnostica.
- Fondazione per la diagnostica polmonare: Domande frequenti. www.lungendiagnostik.ch/index.php/haufige_fragen.html.
- Vansteenkiste J, et al.: 2a Conferenza di consenso ESMO sul cancro al polmone: consenso sul cancro al polmone non a piccole cellule in fase precoce su diagnosi, trattamento e follow-up. Ann Oncol 2014; 25(8): 1462-1474.
- López-Encuentra A, et al: Confronto tra la stadiazione clinica e patologica in 2.994 casi di cancro al polmone. Ann Thorac Surg 2005; 79(3): 974-979.
- Stiles BM, et al.: Punto: Lo stadio clinico IA del carcinoma polmonare non a piccole cellule, determinato dalla tomografia computerizzata e dalla tomografia ad emissione di positroni, spesso non è lo stadio patologico IA del carcinoma polmonare non a piccole cellule: il problema della sottostadiazione. J Thorac Cardiovasc Surg 2009; 137(1): 13-19.
- Hattori A, et al: Esiti oncologici della resezione sublobare per i pazienti con carcinoma polmonare non a piccole cellule di stadio clinico IA ad alto rischio con aspetto radiologicamente solido alla tomografia computerizzata. Gen Thorac Cardiovasc Surg 2016; 64(1): 18-24.
- Schöb O: Terapia chirurgica per il cancro al polmone. La stadiazione, l’operabilità e i fattori prognostici determinano l’indicazione. InFo ONCOLOGIA & EMATOLOGIA 2015; 3(1): 13-17.
- Ginsberg RJ, et al: Studio randomizzato sulla lobectomia rispetto alla resezione limitata per il carcinoma polmonare non a piccole cellule T1 N0. Ann Thorac Surg 1995; 60(3): 615-622.
- Ludwig MS, et al: Sopravvivenza postoperatoria e numero di linfonodi campionati durante la resezione del carcinoma polmonare non a piccole cellule nodo-negativo. Chest 2005 Sep; 128(3): 1545-1550.
- Gulack BC, et al: L’impatto delle dimensioni del tumore sull’associazione tra l’estensione della resezione linfonodale e la sopravvivenza nel carcinoma polmonare non a piccole cellule in stadio clinico I. Cancro al polmone 2015; 90(3): 554-560.
- Stiles BM, et al: L’importanza della dissezione linfonodale che accompagna la resezione a cuneo per il carcinoma polmonare in stadio clinico IA†. Eur J Cardiothorac Surg 2017; 51(3): 511-517.
- Nessun autore elencato: Chemioterapia nel carcinoma polmonare non a piccole cellule: una meta-analisi che utilizza i dati aggiornati sui singoli pazienti di 52 studi clinici randomizzati. Gruppo collaborativo sul cancro del polmone non a piccole cellule. BMJ 1995; 311(7010): 899-909.
- Pignon JP, et al: Valutazione del cisplatino adiuvante per il polmone: un’analisi congiunta del Gruppo Collaborativo LACE. J Clin Oncol 2008; 26(21): 3552-3559.
- Wang EH, et al: La radioterapia postoperatoria è associata a una migliore sopravvivenza complessiva nel cancro al polmone non a piccole cellule di stadio II e III, completamente resecato. J Clin Oncol 2015; 33(25): 2727-2734.
- Thomas KW, Gould MK: Sistema di stadiazione del tumore, del nodo e delle metastasi (TNM) per il carcinoma polmonare non a piccole cellule. UpToDate 2017 Jan 16.
InFo ONCOLOGIA & EMATOLOGIA 2017; 5(3): 8-12