La trombosi venosa profonda si sviluppa ogni anno in 1/1000 persone nell’Europa occidentale. Nella fase acuta, è fondamentale prevenire la complicazione dell’embolia polmonare. Oggi, questo viene fatto efficacemente al momento della diagnosi con l’anticoagulazione. Tuttavia, ogni anno diverse migliaia di persone muoiono a causa di questa tromboembolia polmonare, perché la diagnosi non è stata fatta.
La trombosi venosa profonda si sviluppa ogni anno in 1/1000 abitanti dell’Europa occidentale [1]. Nella fase acuta, è fondamentale prevenire la complicazione dell’embolia polmonare. Oggi, questo viene fatto efficacemente al momento della diagnosi con l’anticoagulazione. Tuttavia, circa 25.000 persone in Germania muoiono ogni anno a causa di questa tromboembolia polmonare, perché i pazienti muoiono improvvisamente con embolia polmonare acuta, tra l’altro, o la diagnosi viene fatta troppo tardi.
Per quanto l’anticoagulazione sia efficace nel prevenire la tromboembolia, è inefficace nel prevenire la sindrome post-trombotica (PTS). Nel decorso a lungo termine, i pazienti con trombosi venosa profonda sviluppano la sindrome post-trombotica nel 20-83%, a seconda della posizione e dell’estensione della trombosi [2,3]. Le vene iliache sono coinvolte nella trombosi iliofemorale in circa il 40% dei casi e, nonostante l’anticoagulazione, la ricanalizzazione non ha successo nel 70% dei casi [4,5]. Questo porta all’ostruzione cronica del drenaggio e, di conseguenza, alla STP.
L’STP riassume i disturbi dovuti a vene profonde danneggiate e/o bloccate, causati dalla trombosi venosa profonda. Questi includono generalmente una sensazione di pesantezza, parestesia, prurito, crampi, dolore ed edema periferico alle gambe. Si verificano anche indurimenti cutanei, iperpigmentazione, arrossamento, ectasia venosa, ulcere alle gambe e dolore da compressione al polpaccio. In particolare, la claudicatio venosa è un sintomo principale che, come la claudicatio intermittente, porta a una limitazione della distanza da percorrere a piedi. L’ulcera, come stadio finale della sintomatologia, comporta conseguenze socioeconomiche come la riduzione della mobilità e la necessità di assistenza, che possono portare a costi elevati per il sistema sanitario [6,7].
Trombosi venosa profonda
Diagnosi: nei casi di sospetta trombosi venosa profonda, la procedura diagnostica è chiaramente definita nelle linee guida. Qualsiasi sospetto di trombosi venosa profonda deve essere chiarito immediatamente per iniziare la terapia anticoagulante, se necessario. Questo è l’unico modo per ridurre il rischio di embolia polmonare e arrestare la progressione della TVP [8]. La valutazione comprende innanzitutto un’anamnesi e un esame fisico. A causa della sensibilità solo bassa, questo da solo non è sufficiente per diagnosticare o escludere la trombosi. Pertanto, a seconda della probabilità clinica (CL), seguono la diagnostica di laboratorio, in particolare la determinazione dei D-dimeri, e/o l’ecografia compressiva. Esistono punteggi convalidati per determinare il KW per la presenza di TVP, come il punteggio di Wells, frequentemente utilizzato [8].
Utilizzando il punteggio, i fattori come la malattia tumorale o la differenza di circonferenza della gamba vengono interrogati e viene attribuito un punteggio di 0 o 1. Ne consegue una KW alta o bassa per la presenza di TVP. Questo dovrebbe essere documentato come una fase diagnostica separata. Se la KW è bassa, di solito segue il test del D-dimero. Se il risultato è negativo, è altamente probabile che la TVP sia stata esclusa e non è necessario eseguire ulteriori esami diagnostici [8]. Se la probabilità clinica è alta, segue l’ecografia compressiva. Se questo non è conclusivo, è necessario eseguire un’ulteriore diagnostica per immagini o ripetere l’esame ecografico dopo 3-5 giorni. Si raccomanda di esaminare l’intera gamba interessata, comprese le vene pelviche, con un’ecografia compressiva. Se la diagnostica per immagini non è disponibile in modo tempestivo, l’anticoagulazione è indicata nei casi di alta probabilità clinica, dopo aver soppesato il rischio di sanguinamento [8].
Terapia: il trattamento della TVP comprende l’anticoagulazione, la terapia compressiva e la mobilizzazione rapida. Si raccomanda anche di interrompere o modificare il possibile fattore di rischio scatenante, come la contraccezione, e di trattare una malattia sottostante di nuova diagnosi, come una malattia tumorale. L’anticoagulazione è stata ampliata negli ultimi anni dai Nuovi Anticoagulanti Orali (NOAK), che hanno certamente reso più facile la gestione per i pazienti. Tuttavia, i NOAK interagiscono sempre più spesso con altri farmaci, come gli antibiotici e gli antiaritmici. Questo deve essere verificato al momento della preparazione e durante i controlli di avanzamento.
Dopo una terapia di mantenimento per 3-6 mesi, si dovrebbe discutere di una terapia di mantenimento prolungata. La Società tedesca di angiologia ha uno schema a semaforo adatto per aiutare a decidere se continuare la terapia. (Tab. 1). Va detto che i due studi con rivaroxaban e apixaban per la terapia di mantenimento prolungata con dosi inferiori non hanno ancora ricevuto attenzione in questa sede, e anche questi sono approvati solo per 1 anno. [9,10]. Una verifica della trombofilia può essere effettuata in pazienti selezionati durante il decorso, ma solo raramente ha una conseguenza terapeutica. Esempi di conseguenze terapeutiche sono la sindrome antifosfolipidica, la carenza di antitrombina III o la carenza di inibitori significativi.

Un controllo clinico del paziente con TVP deve essere eseguito nei primi 21 giorni, uno ecografico dopo 3 mesi o dopo il completamento dell’anticoagulazione.
Per quanto riguarda la terapia compressiva, nonostante tutti i punti deboli del protocollo di studio, il Sox Trial non ha mostrato alcun vantaggio della terapia compressiva nella prevenzione della sindrome post-trombotica (PTS) [13]. Tuttavia, la compressione è indispensabile per alleviare i sintomi; la terapia compressiva deve essere effettuata soprattutto nelle prime settimane.
La TVP di origine non chiara ha il tasso di recidiva più alto, fino al 9% nel primo anno. La discussione se i pazienti con TVP abbiano un rischio maggiore di malattia tumorale non è ancora stata decisa in modo definitivo [14,15]. Se viene effettuato uno screening, uno screening adeguato all’età più l’anamnesi e il laboratorio sembrano essere sufficienti [16]. Nei pazienti più giovani, può essere utile un work-up della vasculite.
I pazienti affetti da tumore presentano un rischio diverso di TVP a seconda dell’entità e della localizzazione del tumore. I pazienti con un tumore al pancreas presentano il rischio più elevato di TVP. La comparsa di TVP nei pazienti con tumore è associata a un esito significativamente peggiore [17]. I pazienti affetti da tumore hanno una probabilità clinica più elevata fin dall’inizio e i D-dimeri sono di per sé regolarmente elevati. Pertanto, si raccomanda di chiarire una possibile TVP nei pazienti affetti da tumore soprattutto con l’aiuto della sonografia duplex a colori e, se necessario, di ulteriori immagini [18]. I pazienti affetti da tumore devono essere trattati con un’eparina a basso peso molecolare per 3-6 mesi, poiché è superiore all’eparina non frazionata [19,20] e a Marcumar [21–23]. Il dosaggio e la durata devono essere decisi in consultazione con i colleghi oncologi curanti. A causa del rischio molto elevato di recidiva, fino al 20%, si raccomanda l’anticoagulazione a lungo termine in base al rischio di emorragia, almeno fino a quando la malattia tumorale è presente, anche se i dati a riguardo sono limitati.
Rispetto all’eparina a basso peso molecolare, sono stati condotti diversi studi con i NOAK nei pazienti affetti da tumore. Edoxaban, rispetto a dalteparina, ha mostrato un tasso di recidiva ridotto (7,9% vs. 11,3%), ma al costo di un aumento del tasso di sanguinamento (6,9% vs. 4,0%) a 12 mesi [24]. L’aumento del tasso di sanguinamento si è verificato soprattutto nel tratto gastrointestinale nei pazienti con tumori gastrointestinali. Lo studio pilota Select-D ha analizzato rivaroxaban in confronto a dalteparina per un periodo di 6 mesi. Anche in questo caso, c’è stato un vantaggio per rivaroxaban nel tasso di trombosi ricorrente (4% vs. 11%), mentre il tasso di emorragia maggiore è aumentato (6% vs. 4%) [25]. In questo studio, si è notato anche un aumento del tasso di sanguinamento gastrointestinale. Dopo l’aggiornamento delle linee guida a questo proposito, i dati su apixaban erano ancora in sospeso. Uno studio internazionale randomizzato è stato in grado di dimostrare la non inferiorità di apixaban rispetto a dalteparina in termini di tasso di recidiva (5,6% vs. 7,9%). Apixaban, tuttavia, a differenza di edoxaban e rivaroxaban, non ha aumentato le complicanze emorragiche (3,8% vs. 4,0%) [26] in una popolazione di pazienti comparabile.
In sintesi, i NOAK sembrano essere un’alternativa per i pazienti affetti da tumore, ma i pazienti con tumori gastrointestinali o urogenitali devono ancora prestare molta attenzione. In base a questi dati, i NOAK potrebbero essere utilizzati a partire dalla diagnosi di TVP, ma ciò dipende dall’entità del tumore, dallo stadio del tumore e dall’attuale trattamento del tumore.
La trombosi della gamba inferiore (trombosi venosa profonda distale), come la trombosi venosa muscolare, viene anticoagulata per un massimo di 3 mesi a causa del suo decorso prognostico favorevole, anche in caso di recidiva o di genesi idiopatica [27,28]. Tuttavia, non esistono prove evidenti della necessità dell’anticoagulazione e il dosaggio è attualmente in discussione.
|
Punteggio LEFT
|
Una delle cause più comuni di morte durante la gravidanza e il puerperio è la TVP, con un rischio quadruplicato [29]. La TVP si verifica nella gamba sinistra nel 70-90% dei casi nelle donne in gravidanza [30,31]. Anche la trombosi venosa pelvica viene diagnosticata più frequentemente durante la gravidanza. Il punteggio LEFt, con un elevato valore predittivo negativo, viene quindi utilizzato per la diagnosi, ma richiede un’ulteriore valutazione in una popolazione di pazienti più ampia (riquadro) . I D-dimeri sono elevati in gravidanza, ma non sono noti da Morse et al. e Chan et al. Questo può essere adattato all’età gestazionale [32,33]. Tuttavia, studi recenti indicano una scarsa praticità clinica dell’uso dei soli D-dimeri per escludere la TVP, al di fuori dei pazienti ad alto rischio [34]. Piuttosto, le regole di prevedibilità clinica sembrano utili in combinazione con il test del D-dimero per risparmiare le radiazioni quando si sospetta un’embolia polmonare.

A questo proposito, l’algoritmo YEARS adattato alla gravidanza, proposto nelle attuali linee guida ESC per l’embolia polmonare, non dovrebbe essere dimenticato [35,36]. In definitiva, tuttavia, l’ecografia compressiva deve essere utilizzata regolarmente per escludere la TVP in gravidanza, se necessario anche in posizione laterale. Se non è possibile trarre una conclusione sulla TVP, si raccomanda di eseguire l’imaging con la flebografia MR [37], evitando il gadolinio e utilizzando sequenze non contrastate [8]. Se l’ecografia compressiva è negativa, si raccomanda un controllo 7 giorni dopo [8].
Se viene rilevata una TVP, si raccomanda l’anticoagulazione con eparine, preferibilmente a basso peso molecolare, che deve essere effettuata per 3 mesi a una dose terapeutica. Successivamente, è possibile ridurre la dose a intermedia (2× profilattica) o la profilassi [8]. Tuttavia, l’anticoagulazione deve essere continuata per almeno 6 settimane dopo il parto [38]. I NOAK sono controindicati durante la gravidanza a causa della loro tossicità placentare, ma anche durante l’allattamento a causa della mancanza di dati sulla sicurezza [39].
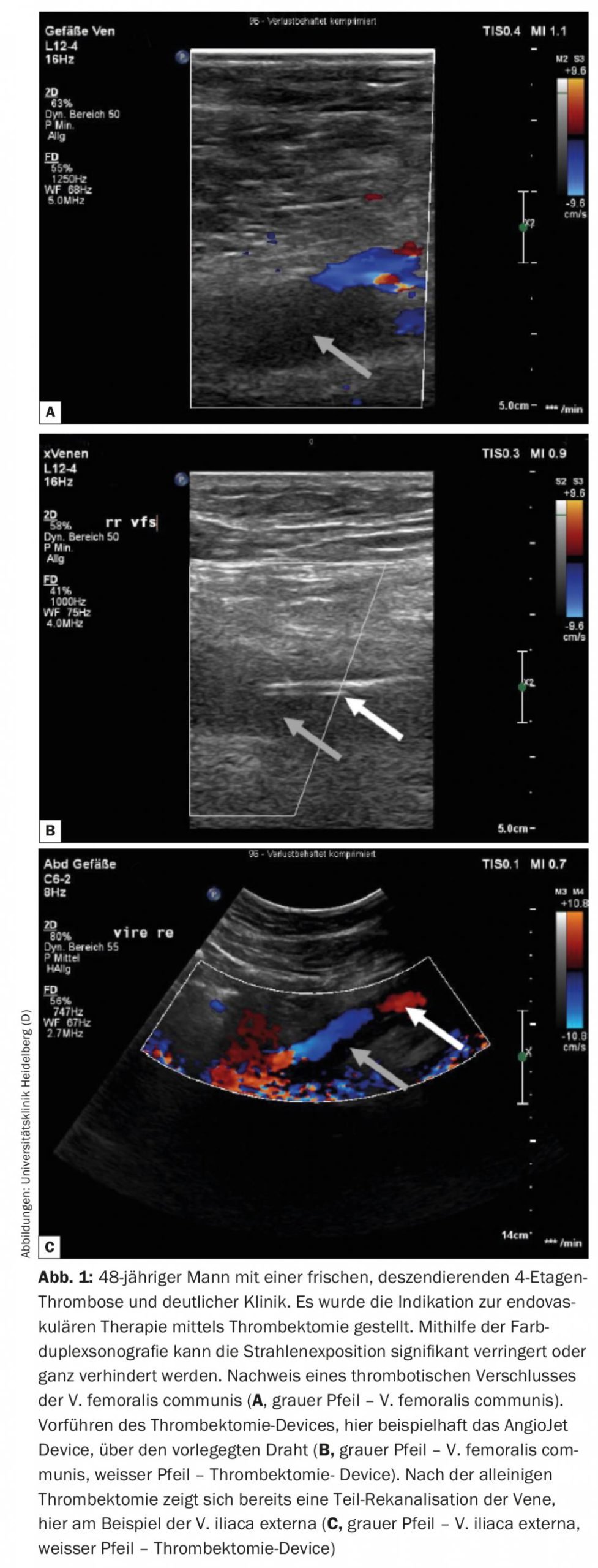
Nei pazienti con sintomi pronunciati dovuti alla trombosi acuta della vena pelvica discendente, deve essere discusso un approccio endovascolare con un basso rischio di sanguinamento. La trombosi discendente di solito ha origine da una stenosi/occlusione nella vena cava inferiore e/o nella vena iliaca, con conseguente rapida crescita discendente del trombo, che porta a una sintomatologia rapida e intensa nel paziente colpito. I pazienti con questo tipo di trombosi traggono beneficio da una procedura interventistica, secondo un’analisi di sottogruppo del trial Attract [11]. Poiché si tratta per lo più di pazienti giovani, l’esposizione alle radiazioni deve essere ridotta al minimo o evitata con l’aiuto della terapia endovascolare guidata dagli ultrasuoni (Fig. 1). Sotto guida ecografica, è possibile eseguire la trombectomia, la terapia di lisi locale, la PTA e l’impianto di stent, come parzialmente mostrato nella seguente casistica [12].
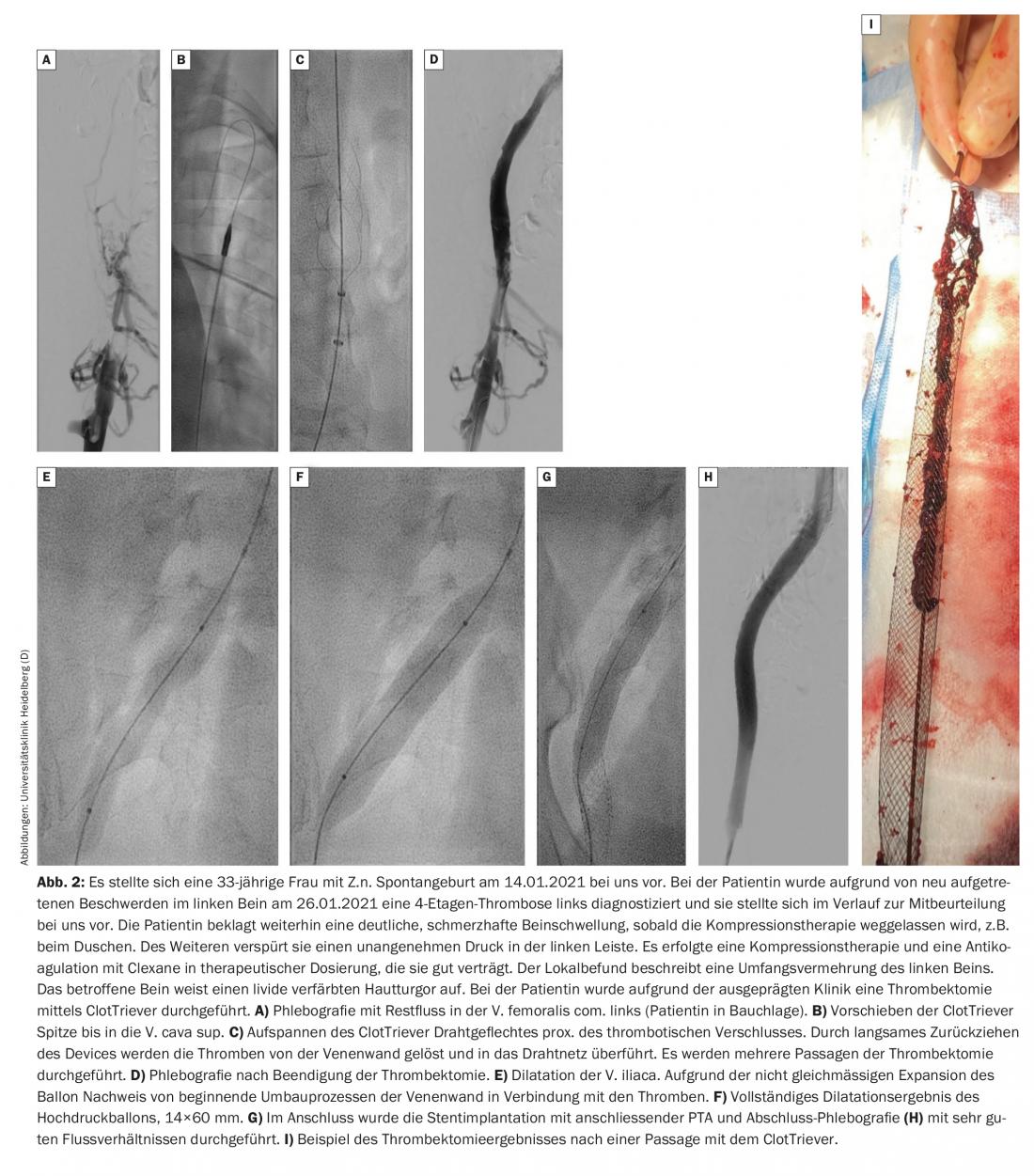
Secondo il protocollo di Heidelberg, i pazienti vengono prima trattati in modo conservativo per alcuni giorni. Se non c’è un miglioramento significativo dei sintomi o dell’estensione del trombo durante questo periodo, si deve discutere con il paziente una procedura endovascolare e realizzarla, se necessario. La trombectomia deve essere eseguita possibilmente entro 14 giorni dalla comparsa dei sintomi. Un nuovo dispositivo, il cosiddetto ClotTriever, sembra che permetta di trattare efficacemente anche la trombosi venosa pelvica subacuta. Attualmente è in corso un registro e resta da vedere quali saranno i primi risultati (Fig. 2).
Terapia per la sindrome post-trombotica (PTS)
Indicazione e chiarimento diagnostico prima di un intervento endovascolare: l’indicazione per un intervento endovascolare dipende dai sintomi del paziente. A partire dallo stadio CEAP 3, c’è l’indicazione di riaprire le vene occluse secondo le raccomandazioni americane. Le seguenti vene possono essere trattate con interventi endovascolari: la vena femorale comune, la vena iliaca, la vena cava inferiore e superiore e, in parte, la vena succlavia. Prima dell’intervento, la diagnosi viene fatta con un esame clinico, un test del cammino, una sonografia duplex a colori e, se necessario, ulteriori immagini come una risonanza magnetica o una TAC. L’estensione dell’occlusione venosa, così come l’afflusso e il deflusso sono essenziali in questo caso, poiché il tasso di apertura a lungo termine dipende da questi fattori.
Terapia: la terapia di base per la STP consiste nella terapia compressiva, nelle misure fisiche e nell’esercizio fisico. Il movimento è essenziale per lo sviluppo dei circuiti di bypass e quindi per il miglioramento dei sintomi. Inoltre, il trattamento ottimale della ferita è elementare nel caso di un’ulcera alla gamba.
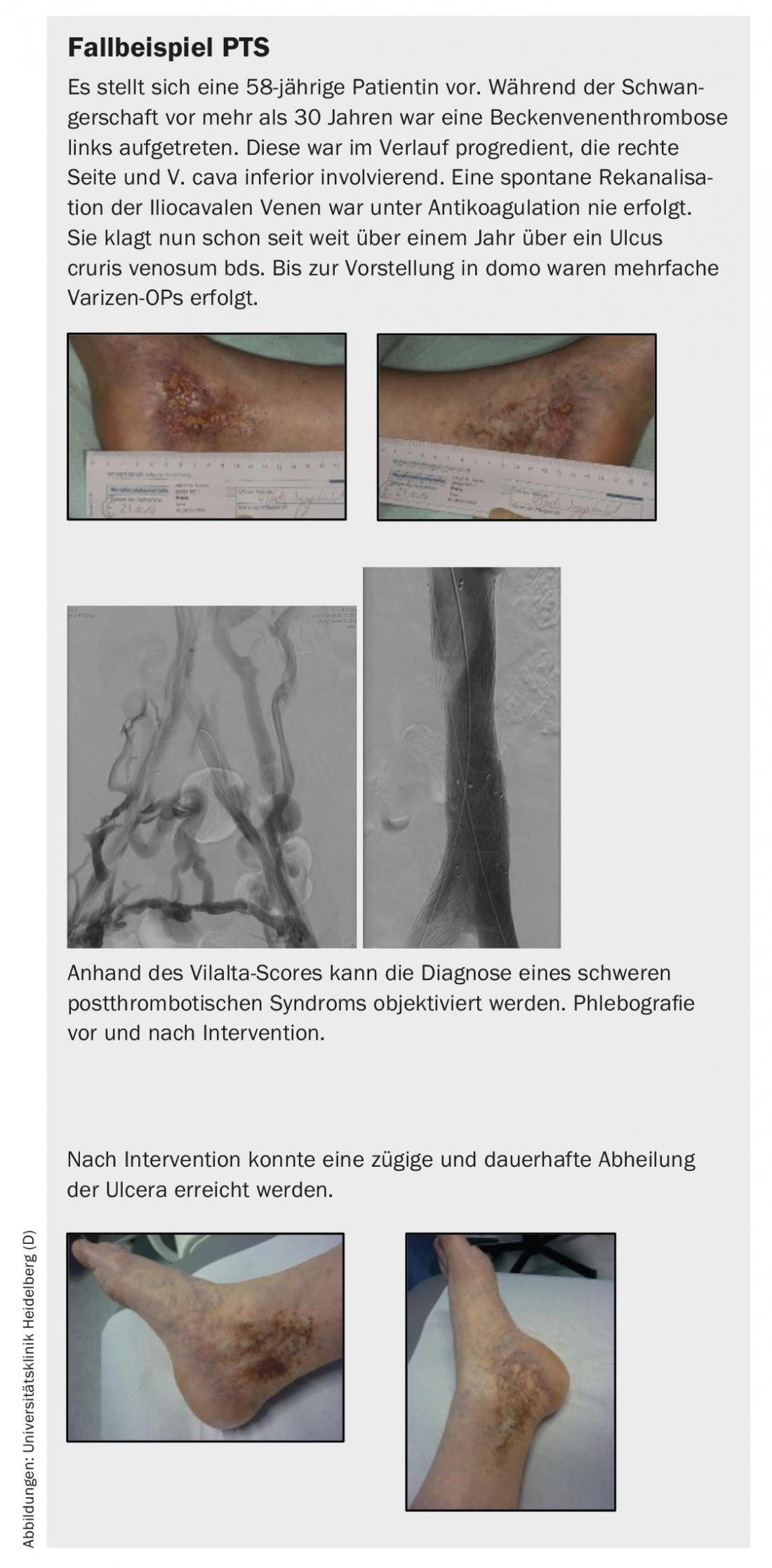
Il trattamento invasivo della trombosi venosa prossimale o dell’occlusione venosa cronica è stato introdotto a livello internazionale già 30 anni fa; nel nostro Paese, gli interventi endovascolari sono stati eseguiti con successo nei maggiori centri da diversi anni, con alti tassi di apertura, e hanno portato a un miglioramento significativo dei sintomi del paziente e alla guarigione delle ulcere venose.
Se la clinica è appropriata, si può discutere con il paziente di un possibile intervento venoso e dei vantaggi, nonché degli svantaggi o dei rischi. Non è importante l’età dell’ostruzione per quanto riguarda le possibilità di successo dell’intervento. Il tasso di apertura primario dopo 5 anni è quasi del 70%. In questa meta-analisi, si è registrato anche un miglioramento significativo dei sintomi; fino all’82% dei pazienti trattati era libero dal dolore dopo 5 anni. Inoltre, la procedura ha portato alla guarigione a lungo termine di un’ulcera alla gamba fino all’80% [1].
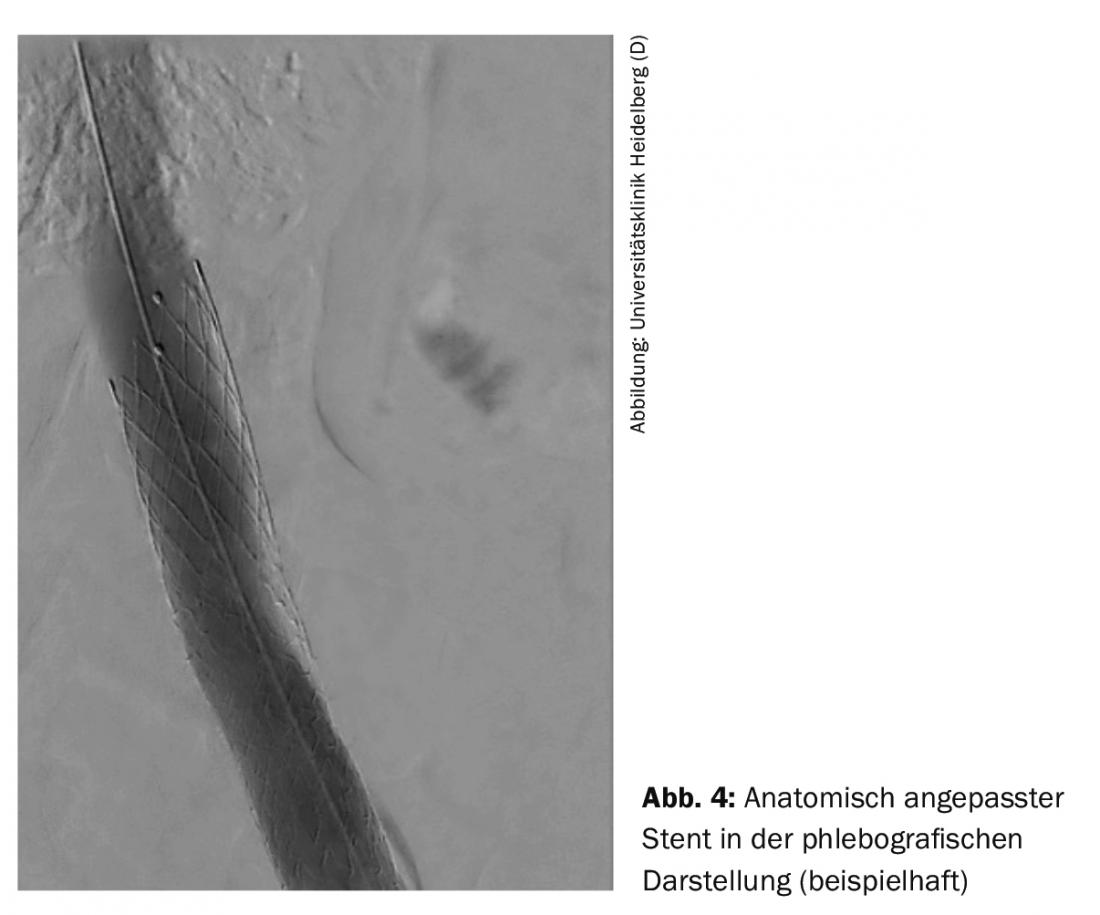
La procedura endovascolare viene solitamente eseguita attraverso la vena poplitea. Altre vie di accesso sono la vena femorale e la vena giugulare. A seconda dei casi, la procedura può essere eseguita in anestesia analgesica o intubazione. Dopo la flebografia, si effettua un passaggio del filo attraverso l’occlusione. Successivamente, a causa della rigidità delle occlusioni venose, per una dilatazione adeguata si utilizzano palloncini speciali ad alta pressione con diametri di 14-16 mm nella vena iliaca e di 20-24 mm nella vena cava inferiore. usato. Dopo la dilatazione, la parete della vena non è una struttura stabile e crolla rapidamente, per questo motivo si utilizzano stent specificamente progettati per le vene, per garantire un tasso di apertura a lungo termine. Per ottenere un posizionamento ottimale dello stent nell’intervento unilaterale nell’area della vena iliaca prossimale, sono disponibili stent adattati anatomicamente (Fig. 4).
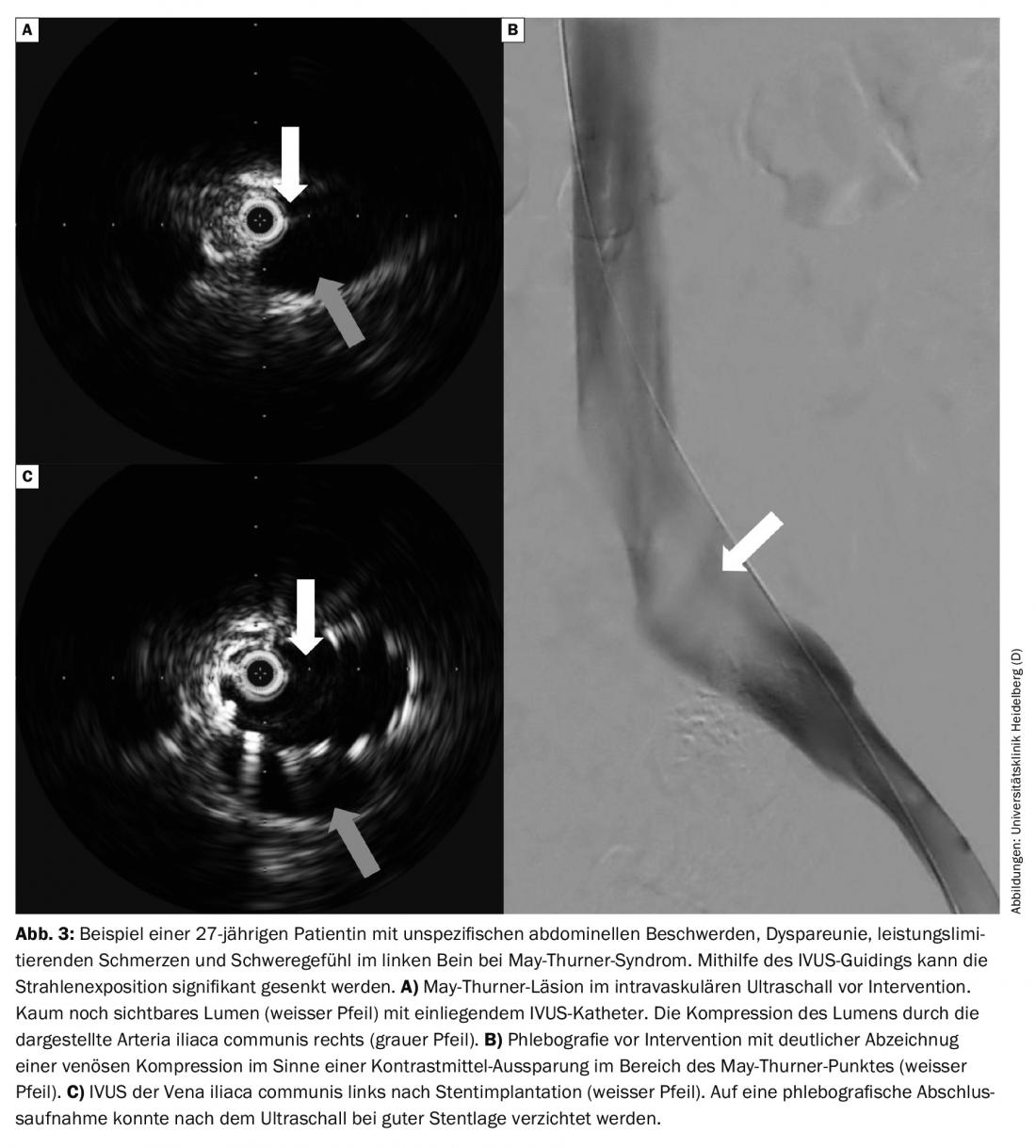
Altri gruppi di pazienti: Le eziologie complementari sono la compressione della vena da parte delle arterie, le cosiddette stenosi venose non trombotiche (NIVL) o le lesioni che occupano spazio, come i tumori. La NIVL di solito comporta la compressione della vena iliaca com. sinistra attraverso la A. iliaca com. destra, la cosiddetta stenosi di May-Thurner. Se si aggiungono le lamentele, si parla di sindrome di May-Thurner. Queste compressioni NIVL possono essere eseguite oggi in modo efficace con un tasso di apertura molto elevato, pari a circa il 90% dopo 5 anni, con un tempo di intervento breve e un prodotto a bassa dose di area [1].
Le limitazioni della sonografia duplex a colori, della TAC e della flebografia a risonanza magnetica nel rilevamento dell’ostruzione dinamica iliaca possono ora essere soddisfatte dall’uso dell’ecografia intravascolare (IVUS) nei casi di sospetta trombosi venosa pelvica con sintomi tipici senza correlazione diagnostica. (Fig. 3A). In questo modo, è possibile risparmiare o addirittura rinunciare alle dosi di raggi X nella diagnosi di questo gruppo di pazienti, spesso più giovani. Se è necessario un intervento, l’IVUS può essere un aiuto nella scelta delle dimensioni e della lunghezza dello stent.
Il trattamento invasivo della compressione venosa da parte di un tumore può portare a un rapido sollievo dai sintomi, non solo in ambito palliativo. Dopo il posizionamento dello stent e la post-dilatazione, lo stent raggiunge la sua forma ottimale per mantenere aperta la vena corrispondente con forze verso l’esterno.
Follow-up: le visite di follow-up sono consigliate dopo 1, 3 e 12 mesi. In questi giorni, viene effettuato un follow-up clinico ed ecografico duplex a colori. Una nuova flebografia o CTA non è necessaria di routine.
Il trattamento antitrombotico post-intervento dipende dall’eziologia del rischio di trombosi ed emorragia dell’individuo. Viene fatto individualmente. Nella maggior parte dei casi, è necessaria un’anticoagulazione terapeutica completa per 6-12 mesi. Successivamente, l’ulteriore procedura viene discussa ed eseguita individualmente con il paziente. Inoltre, l’inibizione delle piastrine può essere consigliata per i primi 6 mesi. Le NIVL richiedono un regime meno rigido dopo l’intervento rispetto alle occlusioni croniche complesse. Si raccomanda l’anticoagulazione completa per 3-6 mesi. Dopodiché, l’anticoagulazione viene interrotta.
In sintesi, la terapia endovascolare delle occlusioni venose è un ottimo modo per aiutare efficacemente i pazienti con sintomi più marcati a lungo termine.
Messaggi da portare a casa
- La terapia NOAK può essere somministrata ai pazienti affetti da tumore.
- Tuttavia, ciò dipende dall’entità del tumore (non nei tumori gastrointestinali e urogenitali), dallo stadio del tumore e dalla sua terapia.
- L’anticoagulazione guidata minimizza il tasso di tromboembolismo, ma non la probabilità di sindrome post-trombotica (PTS).
- Nella trombosi venosa pelvica acuta, chiaramente sintomatica, si dovrebbe discutere una procedura interventistica se i sintomi e l’estensione del trombo non migliorano con la terapia conservativa.
- Nella sindrome post-trombotica, la riapertura endovascolare delle vene occluse può migliorare significativamente la qualità di vita dei pazienti sintomatici. Inoltre, si tratta di una terapia efficace per la guarigione a lungo termine delle ulcere venose.
- Nelle stenosi venose non trombotiche (ad esempio la stenosi di May-Thurner), il tasso di apertura dopo l’intervento è di circa il 90% dopo 5 anni.
Letteratura:
- Razavi MK, Jaff MR, Miller LE: Sicurezza ed efficacia del posizionamento di stent per l’ostruzione del deflusso venoso iliofemorale: revisione sistematica e meta-analisi. Circ Cardiovasc Interv 2015; 8: e002772.
- Kahn SR, Shrier I, Julian JA, et al: Determinanti e decorso temporale della sindrome post-trombotica dopo una trombosi venosa profonda acuta. Ann Intern Med 2008; 149: 698-707.
- Prandoni P, Lensing AW, Cogo A, et al: Il decorso clinico a lungo termine della trombosi venosa profonda acuta. Ann Intern Med 1996; 125: 1-7.
- Johnson BF, Manzo RA, Bergelin RO, Strandness DE, Jr: Relazione tra i cambiamenti nel sistema venoso profondo e lo sviluppo della sindrome post-trombotica dopo un episodio acuto di trombosi venosa profonda degli arti inferiori: un follow-up da uno a sei anni. J Vasc Surg 1995; 21: 307-312; discussione 13.
- Akesson H, Brudin L, Dahlstrom JA, et al: Funzione venosa valutata durante un periodo di 5 anni dopo una trombosi venosa acuta ileo-femorale trattata con anticoagulazione. Eur J Vasc Surg 1990; 4: 43-48.
- Ashrani AA, Heit JA: Incidenza e onere dei costi della sindrome post-trombotica. J Thromb Thrombolysis 2009; 28: 465-476.
- Guanella R, Ducruet T, Johri M, et al: Onere economico e determinanti dei costi della trombosi venosa profonda nei 2 anni successivi alla diagnosi: una valutazione prospettica. J Thromb Haemost 2011; 9: 2397-2405.
- Linea guida S2: Diagnosi e terapia della trombosi venosa e dell’embolia polmonare. www.awmf.org/leitlinien/detail/ll/065-002.html. Stato attuale: 10 ottobre 2015.
- Agnelli G, Buller HR, Cohen A, et al: Apixaban per il trattamento prolungato del tromboembolismo venoso. N Engl J Med 2013; 368: 699-708.
- Weitz JI, Lensing AWA, Prins MH, et al: Rivaroxaban o Aspirina per il trattamento prolungato del tromboembolismo venoso. N Engl J Med 2017; 376: 1211-1222.
- Comerota AJ, Kearon C, Gu CS, et al: Rimozione endovascolare del trombo per la trombosi venosa profonda iliofemorale acuta. Circolazione 2019; 139: 1162-1173.
- Heckmann MB, Wangler S, Katus HA, Erbel C: Trattamento endovascolare assistito da ultrasuoni delle trombosi venose acute. Vasa 2019; 48: 443-449.
- Kahn SR, Shapiro S, Wells PS, et al: Calze compressive per prevenire la sindrome post-trombotica: uno studio randomizzato controllato con placebo. Lancet 2014; 383: 880-888.
- Carrier M, Lazo-Langner A, Shivakumar S, et al: Screening per il cancro occulto nel tromboembolismo venoso non provocato. N Engl J Med 2015; 373: 697-704.
- Robin P, Le Roux PY, Planquette B, et al: Screening limitato con o senza (18)F-fluorodeossiglucosio PET/CT per malignità occulta nel tromboembolismo venoso non provocato: uno studio randomizzato controllato in aperto. Lancet Oncol 2016; 17: 193-199.
- Khan F, Vaillancourt C, Carrier M.: Dobbiamo fare uno screening estensivo per il cancro dopo una trombosi venosa non provocata? BMJ 2017; 356: j1081.
- Levitan N, Dowlati A, Remick SC, et al: Tassi di malattia tromboembolica iniziale e ricorrente tra i pazienti con malignità rispetto a quelli senza malignità. Analisi del rischio utilizzando i dati dei sinistri Medicare. Medicine (Baltimora) 1999; 78: 285-291.
- Gary T: Tromboembolismo venoso correlato al cancro – profilassi e terapia. Vasa 2014; 43: 245-251.
- Akl EA, Rohilla S, Barba M, et al: Anticoagulazione per il trattamento iniziale del tromboembolismo venoso nei pazienti con cancro: una revisione sistematica. Cancro 2008; 113: 1685-1694.
- Akl EA, Kahale L, Neumann I, et al: Anticoagulazione per il trattamento iniziale del tromboembolismo venoso nei pazienti con cancro. Cochrane Database Syst Rev 2014: CD006649.
- Akl EA, Kahale L, Barba M, et al: Anticoagulazione per il trattamento a lungo termine del tromboembolismo venoso nei pazienti con cancro. Cochrane Database Syst Rev 2014: CD006650.
- Hull RD, Pineo GF, Brant RF, et al: Eparina a basso peso molecolare a lungo termine rispetto all’assistenza abituale nei pazienti affetti da trombosi venosa prossimale con cancro. Am J Med 2006; 119: 1062-1072.
- Lee AYY, Kamphuisen PW, Meyer G, et al: Tinzaparina vs Warfarin per il trattamento del tromboembolismo venoso acuto nei pazienti con cancro attivo: uno studio clinico randomizzato. JAMA 2015; 314: 677-686.
- Raskob GE, van Es N, Verhamme P, et al: Edoxaban per il trattamento del tromboembolismo venoso associato al cancro. N Engl J Med 2018; 378: 615-624.
- Young AM, Marshall A, Thirlwall J, et al: Confronto tra un inibitore orale del fattore Xa e l’eparina a basso peso molecolare nei pazienti affetti da cancro con tromboembolismo venoso: risultati di uno studio randomizzato (SELECT-D). J Clin Oncol 2018; 36: 2017-2023.
- Agnelli G, Becattini C, Meyer G, et al: Apixaban per il trattamento del tromboembolismo venoso associato al cancro. N Engl J Med 2020; 382: 1599-1607.
- Galanaud JP, Sevestre MA, Genty C, et al: Incidenza e predittori di recidiva di tromboembolismo venoso dopo una prima trombosi venosa profonda distale isolata. J Thromb Haemost 2014; 12: 436-443.
- Baglin T, Douketis J, Tosetto A, et al: La presentazione clinica e l’estensione della trombosi venosa predicono la probabilità e il tipo di recidiva? Una meta-analisi a livello di paziente. J Thromb Haemost 2010; 8: 2436-2442.
- Marik PE, Plante LA: Malattia tromboembolica venosa e gravidanza. N Engl J Med 2008; 359: 2025-2033.
- Chan WS, Spencer FA, Ginsberg JS: Distribuzione anatomica della trombosi venosa profonda in gravidanza. CMAJ 2010; 182: 657-660.
- Ginsberg JS, Brill-Edwards P, Burrows RF, et al: Trombosi venosa in gravidanza: gamba e trimestre di presentazione. Thromb Haemost 1992; 67: 519-520.
- Morse M: Stabilire un intervallo di normalità per i livelli di D-dimero durante la gravidanza per aiutare la diagnosi di embolia polmonare e trombosi venosa profonda. J Thromb Haemost 2004; 2: 1202-1204.
- Chan WS, Lee A, Spencer FA, et al: Il test del D-dimero nelle pazienti in gravidanza: verso la determinazione del prossimo ‘livello’ nella diagnosi di trombosi venosa profonda. J Thromb Haemost 2010; 8: 1004-1011.
- Goodacre S, Horspool K, Nelson-Piercy C, et al: Lo studio DiPEP: uno studio osservazionale sull’accuratezza diagnostica della valutazione clinica, del D-dimero e della radiografia del torace per il sospetto di embolia polmonare in gravidanza e nel post-partum. BJOG 2019; 126: 383-392.
- Konstantinides SV, Meyer G, Becattini C, et al: Linee guida ESC 2019 per la diagnosi e la gestione dell’embolia polmonare acuta sviluppate in collaborazione con la European Respiratory Society (ERS). Eur Heart J 2020; 41: 543-603.
- van der Pol LM, Tromeur C, Bistervels IM, et al: Algoritmo YEARS adattato alla gravidanza per la diagnosi di sospetta embolia polmonare. N Engl J Med 2019; 380: 1139-1149.
- Tan M, Mol GC, van Rooden CJ, et al: La risonanza magnetica per immagini diretta del trombo differenzia la trombosi venosa profonda acuta ricorrente omolaterale dalla trombosi residua. Sangue 2014; 124: 623-627.
- Chan WS, Rey E, Kent NE, et al: Tromboembolismo venoso e terapia antitrombotica in gravidanza. J Obstet Gynaecol Can 2014; 36: 527-553.
- Cohen H, Arachchillage DR, Middeldorp S, et al: Gestione degli anticoagulanti orali diretti nelle donne con potenziale fertile: guida del SSC dell’ISTH. J Thromb Haemost 2016; 14: 1673-1676.
- Bauersachs, et al.: Dtsch Med Wochenschr 2018; 143: 1-6 (13).
PRATICA GP 2021; 16(12): 4-11