La comprensione sempre migliore dei rapporti patogenetici del carcinoma a cellule renali ha contribuito allo sviluppo di nuovi farmaci. Questi interferiscono in modo specifico con le vie di segnalazione di VEGF, PDGF e mTOR. Negli ultimi anni, sono state sviluppate anche terapie che indirizzano il sistema immunitario a combattere i tumori. A che punto siamo con il mRCC oggi? Cosa dicono le attuali linee guida?
Il carcinoma a cellule renali è relativamente raro in Svizzera, con un’incidenza di circa 950 casi e l’1,8% dei decessi per cancro all’anno. Gli uomini sono colpiti molto più spesso delle donne (67,9% contro 32,1%) e circa un terzo dei pazienti presenta già metastasi locali o a distanza al momento della diagnosi [1]. In circa il 25% dei pazienti con malattia localizzata, si verificano metastasi a distanza dopo una nefrectomia con finalità curativa [2].
Tra i numerosi sottotipi, il carcinoma renale a cellule chiare è il più comune, rappresentando il 70-75% dei casi, ed è associato all’inattivazione dei geni Von Hippel-Lindau (VHL), con conseguente aumento dell’attività del fattore indotto dall’ipossia (HIF) e, in ultima analisi, alla sovraespressione del fattore di crescita endoteliale vascolare (VEGF) e del fattore di crescita derivato dalle piastrine (PDGF) [3,4]. L’attività di HIF può anche essere potenziata dalla via di segnalazione Mammalian Target of Rapamycin (mTOR) [5]. La comprensione di queste relazioni ha contribuito in modo significativo allo sviluppo di nuovi farmaci che interferiscono in modo specifico con le vie di segnalazione di VEGF, PDGF e mTOR (Fig. 1).
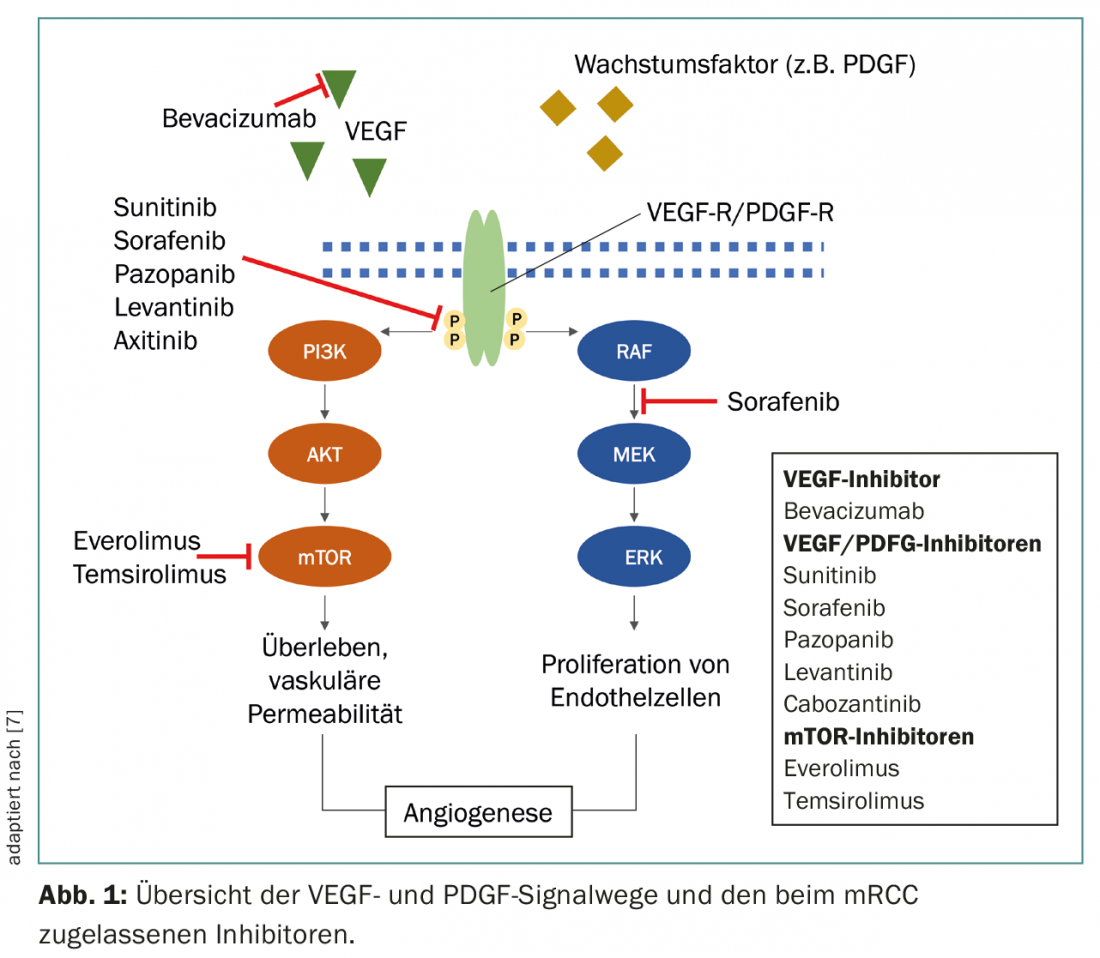
Negli ultimi anni, sono state sviluppate anche terapie che indirizzano il sistema immunitario a combattere il tumore. L’espressione di CTLA-4 e PD-1 da parte delle cellule T attivate porta a una riduzione dell’attività delle cellule T in diverse fasi della risposta immunitaria. L’anticorpo monoclonale anti-CTLA-4 (mAB) ipilimumab e il mAB anti-PD-1 nivolumab contribuiscono a indurre un’efficace risposta antitumorale delle cellule T bloccando questi recettori di checkpoint [6].
Classificazione dei gruppi di rischio e linee guida
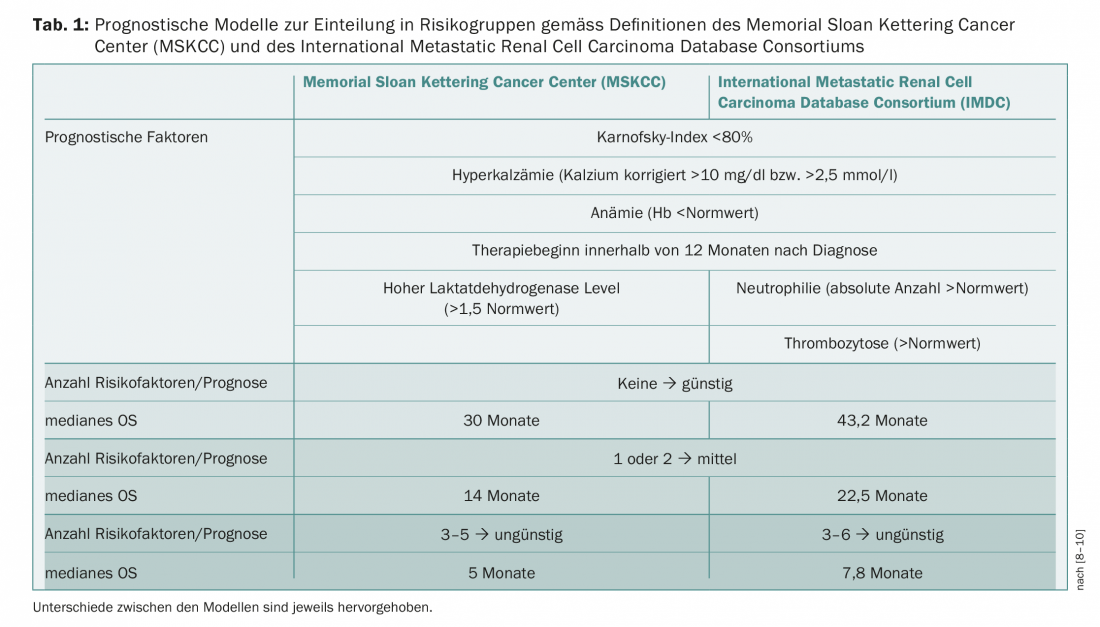
I modelli prognostici e la classificazione dei pazienti in diversi gruppi di rischio costituiscono una base importante per le decisioni terapeutiche. I criteri del Memorial Sloan Kettering Cancer Center (MSKCC) sono precedenti alla creazione di terapie mirate [8]. In alternativa, l’International Metastatic Renal Cell Carcinoma Database Consortium (IMDC) ha definito dei fattori come base per la valutazione del rischio [9,10]. I due sistemi differiscono solo in alcuni punti e dividono i pazienti in gruppi di rischio favorevoli, intermedi e sfavorevoli (Tab. 1) . Il trattamento del mRCC è stato in costante evoluzione sin dalla prima approvazione di una terapia mirata (sunitinib, 2006). All’inizio del 2018 sono state pubblicate le nuove linee guida dell’Associazione Europea di Urologia (EAU) che, sulla base dello studio CheckMate-214, elencano già la terapia di combinazione con nivolumab/ipilimumab nei pazienti con rischio intermedio/sfavorevole [11]. Nello studio, la combinazione di nivolumab e ipilimumab ha raggiunto un tasso di sopravvivenza a 1,5 anni del 75% rispetto al 60% con sunitinib dopo un follow-up mediano di 25,2 mesi (HR 0,63, p<0,001). La sopravvivenza mediana libera da progressione (PFS) è stata di 11,6 mesi nel gruppo nivolumab/ipilimumab e di 8,4 mesi nel gruppo sunitinib; tuttavia, questa differenza tra i bracci di trattamento non era statisticamente significativa (HR 0,82, p=0,03) [12]. Il tasso di risposta obiettiva è stato del 42% rispetto al 27% (p<0,001) e anche il tasso di remissioni complete è stato più alto con la combinazione di immunoterapia (9%) rispetto a sunitinib (1%). La terapia combinata ipilimumab/nivolumab è stata recentemente approvata in Svizzera per il trattamento del mRCC. Attualmente, l’Associazione svizzera per la ricerca clinica sul cancro (SAKK) sta conducendo uno studio di fase II con ipilimumab e nivolumab in prima o seconda linea di terapia (SAKK 07/17).
Di seguito, verrà discussa soprattutto la gestione della terapia con gli inibitori della tirosin-chinasi (TKI) mirati e anti-angiogenici e gli inibitori di mTOR. La Tabella 2 mostra una panoramica delle linee guida attuali, con un focus sulle sostanze approvate in Svizzera.

La nefrectomia come standard di cura nel mRCC
La nefrectomia è parte integrante della terapia del mRCC da quasi 20 anni, poiché è stato dimostrato che la chirurgia prima della terapia con interferone alfa (IFN-α) conferisce un beneficio in termini di sopravvivenza rispetto al solo trattamento con IFN-α [17,18]. Tuttavia, il ruolo della nefrectomia nel contesto delle terapie anti-angiogeniche mirate non è stato chiaro, anche se gli studi retrospettivi tendono a confermare il beneficio della procedura [19]. I dati sulla sequenza nefrectomia → sunitinib rispetto a sunitinib → nefrectomia (SURTIME) sono stati presentati all’ESMO 2017. Sebbene lo studio sia stato interrotto presto a causa del lungo reclutamento dei pazienti, può essere utilizzato come fonte di dati prospettici. Non è stata evidenziata alcuna differenza nella PFS mediana a 7 mesi tra i gruppi di trattamento (42,0% vs 42,9%, p>0,99), ma è stata evidenziata una tendenza verso una migliore sopravvivenza globale (OS) nel gruppo della chirurgia secondaria (HR 0,57, 95% CI 0,34-0,95, p=0,032) [20]. Con lo studio CARMENA, pubblicato di recente, sono disponibili dati prospettici che dimostrano la non inferiorità della sola terapia con sunitinib rispetto alla nefrectomia più sunitinib nei pazienti a rischio intermedio e sfavorevole [21]. Lo studio ha randomizzato 450 pazienti al trattamento con nefrectomia/sunitinib o sunitinib. I pazienti trattati con il solo sunitinib hanno mostrato una OS mediana più lunga rispetto al gruppo della nefrectomia (18,4 vs. 13,9 mesi, HR 0,89) e i criteri di non inferiorità del sunitinib sono stati soddisfatti di conseguenza [21]. Gli autori concludono che, sebbene la nefrectomia possa essere utile per il controllo dei sintomi (macroematuria, dolore renale), la terapia con un inibitore di VEGF senza nefrectomia non presenta svantaggi in termini di OS [21]. Se il rischio è basso, probabilmente la nefrectomia continuerà ad essere scelta per la maggior parte dei pazienti in futuro.
Scelta della terapia di prima linea
Sunitinib e pazopanib sono le terapie di prima linea più utilizzate per i pazienti con rischio favorevole e intermedio, rispettivamente [22]. I dati dello studio CheckMate-214 e l’approvazione di nivolumab/ipilimumab porteranno a una modifica dell’algoritmo terapeutico. Si attendono con interesse anche i dati dello studio IMmotion151 (atezolizumab e bevacizumab vs. sunitinib) sulla sopravvivenza globale . Tuttavia, la scelta della terapia di prima linea si basa anche sulle condizioni individuali di ciascun paziente e sulle eventuali comorbilità [22]. Sunitinib ha più che raddoppiato la PFS mediana (11 vs. 5 mesi, HR 0,539, p<0,001) e ha raggiunto una OS mediana di oltre due anni (26,4 vs. 21,8 mesi, HR 0,821, p=0,051) rispetto a IFN-α [23]. Nello studio real-world Expanded Access, è stato osservato che sunitinib ha anche una PFS mediana di 9,4 mesi e una OS mediana di 18,7 mesi [24]. Dopo oltre dieci anni di esperienza, sunitinib ha sostituito l’IFN-α come standard di cura nella terapia di prima linea [25].
Nello studio randomizzato, di fase III, di non inferiorità COMPARZ, pazopanib non era inferiore a sunitinib (9,5 mesi) con una PFS mediana di 8,4 mesi (HR 1,05). Anche la OS mediana era paragonabile tra le due terapie (pazopanib: 28,3 mesi, sunitinib 29,1 mesi, HR 0,92) e il tasso di risposta obiettiva era del 31% con pazopanib contro il 25% con sunitinib [26]. In uno studio randomizzato sulle preferenze dei pazienti (PICES), pazopanib ha ottenuto risultati statisticamente migliori rispetto a sunitinib [27]. Come altra opzione nella terapia di prima linea, è stato osservato un miglioramento di 3,3 mesi nella PFS mediana con la combinazione di bevacizumab con IFN-α rispetto a IFN-α (8,5 vs. 5,2 mesi, HR 0,71) [28]. Nei pazienti a rischio sfavorevole, è stato osservato anche un prolungamento significativo della OS mediana con temsirolimus rispetto a IFN-α (10,9 vs. 7,3 mesi, HR 0,73) [29].
Scelta della terapia di seconda linea e dei trattamenti di follow-up
Oltre alla durata della risposta alla terapia di prima linea, alla sintomatologia del paziente e alle comorbilità esistenti, anche le tossicità individuali precedenti influiscono sulla scelta della terapia di seconda linea [22,30]. I pazienti che hanno sperimentato gravi effetti collaterali o perdite di qualità di vita con la terapia precedente possono quindi trarre beneficio da un cambio di classe farmacologica [22]. Ad esempio, il diabete di tipo 2 scarsamente controllato può essere peggiorato dall’uso di un inibitore di mTOR, la malattia cardiovascolare può essere un fattore di rischio nel contesto delle terapie anti-VEGF e le malattie autoimmuni esistenti devono essere considerate nel contesto delle terapie basate sugli inibitori del checkpoint [31–33].
Nello studio AXIS di fase III, è stata raggiunta una PFS mediana significativamente più lunga (HR 0,66, p<0,0001) e una OS mediana con axitinib rispetto a sorafenib in seconda linea di terapia (20,1 mesi vs. 19,2 mesi, HR 0,97, p=0,37) [34]. Inoltre, rispetto a everolimus, sia cabozantinib nello studio METEOR di fase III (21,4 vs. 17,1 mesi, HR 0,70, p=0,0002) che nivolumab nello studio CheckMate-025 di fase III (25,0 vs. 19,6 mesi, HR 0,73, 98,5% CI 0,57-0,93, p=0,002) hanno portato a un miglioramento significativo della OS mediana. [35,36]. Tuttavia, non è stato dimostrato alcun beneficio in termini di PFS con nivolumab (4,6 vs. 4,4 mesi, HR 0,88, p=0,11) [36]. La combinazione di lenvatinib e everolimus ha determinato un prolungamento significativo della PFS mediana rispetto a everolimus (14,6 vs. 5,5 mesi, HR 0,40, p=0,0005), ma associato a tossicità [37,38].
Terapia e gestione degli effetti collaterali
Il successo del trattamento nel mRCC dipende dalla scelta della terapia, ma anche dalla gestione degli effetti collaterali.
Nello studio COMPARZ, sono stati osservati diversi profili di effetti collaterali con sunitinib e pazopanib, che possono influenzare la scelta individuale della sostanza [26]. L’affaticamento, la sindrome mano-piede e la mucosite orale sono aumentati nel braccio sunitinib e l’alterazione dei livelli degli enzimi epatici e la perdita di peso sono aumentati nel braccio pazopanib. La terapia dello studio è stata interrotta più spesso nel gruppo pazopanib che nel gruppo sunitinib a causa di effetti avversi [26].
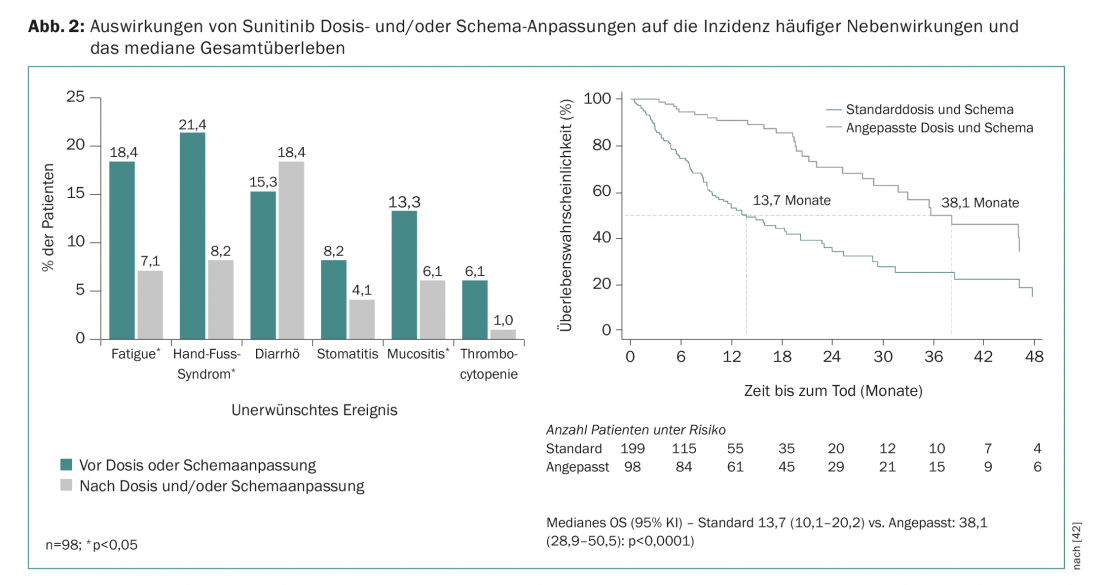
Le analisi farmacologiche retrospettive indicano che una maggiore esposizione a sunitinib è associata a migliori risultati clinici, ma anche a un tasso più elevato di eventi avversi [39]. È ormai noto da diversi studi che l’adeguamento del regime di trattamento con sunitinib da “4 settimane di terapia/2 settimane di riposo (4/2)” a “2 settimane di terapia/1 settimana di riposo (2/1)” può aiutare a ridurre gli effetti avversi più comuni senza compromettere l’efficacia della terapia [40,41]. Ciò è confermato anche dai dati del registro prospettico e reale STAR-TOR in Germania. Gli aggiustamenti della dose e/o del regime durante la terapia con sunitinib hanno portato a una riduzione degli eventi avversi comuni (tranne la diarrea) e a un miglioramento della OS mediana (Fig. 2) [42]. Anche gli aggiustamenti della dose sono spesso necessari e comuni durante il trattamento con pazopanib [43].
Prospettiva
Con l’attuale ampia gamma di opzioni terapeutiche nel mRCC e gli agenti aggiuntivi previsti, la questione della scelta e della sequenza terapeutica ottimale rimane una questione chiave. Ad esempio, la coorte EuroTARGET sta valutando diversi biomarcatori per la personalizzazione della terapia del mRCC, utilizzando i dati dei pazienti trattati con sunitinib, pazopanib o sorafenib [44]. In futuro, anche la gestione proattiva e personalizzata della terapia e degli effetti collaterali avrà un’influenza significativa sui risultati clinici.
Messaggi da portare a casa
- Nel rischio intermedio/sfavorevole, la nefrectomia palliativa primaria non ha mostrato un vantaggio rispetto alla terapia anti-VEGF primaria in termini di sopravvivenza globale. Se il rischio è favorevole, la nefrectomia citoriduttiva primaria rimane lo standard.
- Nella terapia di prima linea, sunitinib e pazopanib sono raccomandati per il rischio favorevole/intermedio, mentre temsirolimus può essere utilizzato per il rischio sfavorevole o l’istologia non cellulare.
- Nivolumab/ipilimumab può essere utilizzato se i costi sono approvati o nell’ambito dello studio SAKK 07/17 ed è ora approvato anche in Svizzera. Cabozantinib, invece, non è ancora approvato per la prima linea.
- Il trattamento di seconda linea dipende da vari fattori individuali, nonché dalla risposta e dalle tossicità della terapia di prima linea.
- Adattare il regime di trattamento con sunitinib da “4 settimane di terapia/2 settimane di pausa (4/2)” a “2 settimane di terapia/1 settimana di pausa (2/1)” può aiutare a migliorare la tollerabilità senza perdita di efficacia del trattamento.
Letteratura:
- Krebsliga Schweiz: Il cancro in Svizzera: figure importanti. Stato Ottobre. 2017 www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf
- Choueiri TK, Motzer RJ: Terapia sistemica per il carcinoma a cellule renali metastatico. New England Journal of Medicine 2017; 376(4): 354-366.
- Clark PE: Il ruolo di VHL nel carcinoma renale a cellule chiare e la sua relazione con la terapia mirata. Kidney international 2009; 76(9): 939-945.
- Nickerson ML, et al: Migliore identificazione delle alterazioni del gene von Hippel-Lindau nei tumori renali a cellule chiare. Ricerca clinica sul cancro 2008; 14(15): 4726-4734.
- Thomas GV, et al.: Il fattore di induzione dell’ipossia determina la sensibilità agli inibitori di mTOR nel cancro del rene. Medicina naturale 2006; 12(1): 122-127.
- Sathianathen NJ, et al: Lo stato attuale delle terapie basate sull’immunoterapia per il carcinoma a cellule renali metastatico. ImmunoTargets and Therapy 2017; 6: 83-93.
- Rini BI, Small EJ: Biologia e sviluppo clinico della terapia mirata al fattore di crescita dell’endotelio vascolare nel carcinoma a cellule renali. Journal of Clinical Oncology 2005; 23(5): 1028-1043.
- Motzer RJ, Bacik J, Murphy BA, Russo P Mazumdar M: Interferone-Alfa come trattamento comparativo per le sperimentazioni cliniche di nuove terapie contro il carcinoma renale avanzato. Journal of Clinical Oncology 2002; 20(1): 289-296.
- Heng DYC, et al: Convalida esterna e confronto con altri modelli del modello prognostico dell’International Metastatic Renal-Cell Carcinoma Database Consortium: uno studio basato sulla popolazione. Lancet. Oncologia 2013; 14(2): 141-148.
- Heng DYC, et al: Fattori prognostici per la sopravvivenza complessiva nei pazienti con carcinoma renale metastatico trattati con agenti mirati al fattore di crescita endoteliale vascolare: risultati di un ampio studio multicentrico. Journal of Clinical Oncology 2009; 27(34): 5794-5799.
- Powles T, et al: Raccomandazioni aggiornate delle Linee Guida dell’Associazione Europea di Urologia per il trattamento di prima linea del carcinoma renale a cellule chiare metastatico. Urologia europea 2017.
- Motzer RJ, et al: Nivolumab più ipilimumab rispetto a sunitinib nel carcinoma a cellule renali avanzato. New England Journal of Medicine 2018; 378(14): 1277-1290.
- Linea guida S3 Diagnostica, terapia e follow-up del carcinoma a cellule renali. Versione lunga 1.2 – aprile 2017, numero di registro AWMF: 043/017-OL.
- Escudier B, et al: Carcinoma a cellule renali: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up†. Annali di Oncologia 2016; 27(5): v58-v68.
- NCCN: National Comprehensive Cancer Network Linee guida di pratica clinica in oncologia – Cancro del rene Versione 3.2018. NCCN.org febbraio. 6 2018.
- www.swissmedicinfo.ch.
- Flanigan RC, et al: Nefrectomia seguita da interferone Alfa-2b rispetto all’interferone Alfa-2b da solo per il cancro a cellule renali metastatico. New England Journal of Medicine 2001; 345(23): 1655-1659.
- Mickisch GH, Garin A, et al: Nefrectomia radicale più immunoterapia basata sull’interferone alfa rispetto al solo interferone alfa nel carcinoma a cellule renali metastatico: uno studio randomizzato. Lancet 2001; 358(9286): 966-970.
- Culp SH: La nefrectomia citoriduttiva e il suo ruolo nell’attuale periodo di terapia mirata. Ther Adv Urol 2015; 7(5): 275-285.
- Bex A, et al: Nefrectomia citoriduttiva immediata rispetto a quella differita nei pazienti con carcinoma a cellule renali metastatico sincrono (mRCC) che ricevono sunitinib (EORTC 30073 SURTIME. Annali di Oncologia 2017; 28(5): v605-v649; doi: 10.1093/annonc/mdx440.
- Mejean A, et al: Sunitinib da solo o dopo la nefrectomia nel carcinoma a cellule renali metastatico. The New England journal of medicine 2018. doi: 10.1056/NEJMoa1803675
- Osorio JC, et al: Ottimizzazione degli approcci terapeutici nel carcinoma renale avanzato. Oncologia 2017; 31(12): 919-926, 928-930.
- Motzer RJ, et al: Sopravvivenza complessiva e risultati aggiornati per Sunitinib rispetto a Interferone Alfa nei pazienti con carcinoma a cellule renali metastatico. Journal of Clinical Oncology 2009; 27(22): 3584-3590.
- Gore ME, et al: Risultati finali del grande studio globale ad accesso allargato su sunitinib nel carcinoma a cellule renali metastatico. British journal of cancer 2015; 113(1): 12-19.
- Motzer RJ, et al: Sunitinib: dieci anni di uso clinico e studio di successo nel carcinoma a cellule renali avanzato. L’Oncologo 2017; 22(1): 41-52.
- Motzer RJ, et al: Pazopanib rispetto a sunitinib nel carcinoma a cellule renali metastatico. New England Journal of Medicine 2013; 369(8): 722-731.
- Escudier B, et al: Studio randomizzato, controllato, in doppio cieco, cross-over che valuta la preferenza terapeutica per Pazopanib rispetto a Sunitinib nei pazienti con carcinoma a cellule renali metastatico: Studio PISCES. Journal of Clinical Oncology 2014; 32(14): 1412-1418.
- Rini BI, et al: Bevacizumab più Interferone Alfa rispetto alla monoterapia con Interferone Alfa nei pazienti con carcinoma a cellule renali metastatico: CALGB 90206. Journal of Clinical Oncology 2008; 26(33): 5422-5428.
- Hudes G, et al: Temsirolimus, Interferone Alfa o entrambi per il carcinoma a cellule renali avanzato. New England Journal of Medicine 2007; 356(22): 2271-2281.
- Fischer S, et al: Sequenza di trattamento nel carcinoma a cellule renali localmente avanzato e metastatico. Andrologia e urologia traslazionale 2015; 4(3): 310-325.
- Johnson DB, et al: Terapia con inibitori del checkpoint immunitario nei pazienti con malattia autoimmune. Oncologia 2018; 32(4): 190-194.
- Morviducci L, et al.: Everolimus è una nuova molecola antitumorale: effetti collaterali metabolici come disturbi lipidici e iperglicemia. Ricerca sul diabete e pratica clinica 2018.
- Schmidinger M, et al.: Tossicità cardiaca di sunitinib e sorafenib nei pazienti con carcinoma a cellule renali metastatico. Journal of clinical oncology : rivista ufficiale della Società americana di oncologia clinica 2008; 26(32): 5204-5212.
- Rini BI, et al: Efficacia comparativa di axitinib rispetto a sorafenib nel carcinoma a cellule renali in fase avanzata (AXIS): uno studio randomizzato di fase 3. Lancet 2011; 378(9807): 1931-1939.
- Motzer RJ, et al: Follow-up a lungo termine della sopravvivenza globale per cabozantinib rispetto a everolimus nel carcinoma a cellule renali avanzato. British journal of cancer 2018; 118(9): 1176-1178.
- Motzer RJ, et al: Nivolumab rispetto a everolimus nel carcinoma a cellule renali avanzato. The New England journal of medicine 2015; 373(19): 1803-1813.
- Motzer RJ, et al: Lenvatinib, everolimus e la combinazione nei pazienti con carcinoma a cellule renali metastatico: uno studio randomizzato, di fase 2, in aperto, multicentrico. Lancet Oncol 2015; 16(15): 1473-1482.
- Rothermundt C, et al.: Trattamento di seconda linea per il carcinoma renale a cellule chiare metastatico: algoritmi di consenso degli esperti. World journal of urology 2017; 35(4): 641-648.
- Houk BE, et al.: Relazione tra l’esposizione a sunitinib e gli endpoint di efficacia e tollerabilità nei pazienti con cancro: risultati di una meta-analisi farmacocinetica/farmacodinamica. Chemioterapia e farmacologia del cancro 2009; 66(2): 357-371.
- Atkinson BJ, et al: Esiti clinici nei pazienti con carcinoma renale metastatico trattati con schemi alternativi di Sunitinib. Il Giornale di Urologia 2014; 191(3): 611-618.
- Najjar YG, et al: Un programma di 2 settimane di assunzione e 1 di sospensione di sunitinib è associato a una minore tossicità nel carcinoma a cellule renali metastatico. European Journal of Cancer 2014; 50(6): 1084-1089.
- Boegemann M, et al.: Modifica del trattamento con sunitinib nel carcinoma a cellule renali metastatico (mRCC) di prima linea (1L): Un’analisi del registro STAR-TOR. Journal of Clinical Oncology 2018; 36(6_suppl): 602-602.
- Iacovelli R, et al: Esito clinico dei pazienti che hanno ridotto sunitinib o pazopanib durante il trattamento di prima linea del carcinoma renale avanzato. Oncologia urologica 2017; 35(9): 541.e547-541.e513.
- van der Zanden LFM, et al.: Descrizione della coorte EuroTARGET: un progetto collaborativo europeo sulla terapia TArgeted nel carcinoma a cellule renali – biomarcatori genetici e correlati al tumore per la risposta e la tossicità. Oncologia urologica 2017; 35(8): 529.e529-529.e516.
InFo ONcOLOGIA & EMATOLOGIA 2018; 6(4): 17-22.











