La metaplasia intestinale, il cosiddetto epitelio di Barrette, può svilupparsi dal normale epitelio squamoso esofageo a causa di vari fattori. Questi possono svilupparsi in displasia di basso o alto grado, che a sua volta può essere associata a un pericoloso adenocarcinoma. Il seguente articolo illustra il decorso, i fattori di rischio e le possibilità e le necessità di sorveglianza. La terapia delle displasie di “alto grado” mediante resezione mucosa o ablazione con radiofrequenza mostra risultati molto buoni.
L’esofago di Barrett è definito (almeno alle nostre latitudini) come la presenza di epitelio cilindrico nell’esofago distale con metaplasia intestinale specializzata aggiuntiva (presenza di cellule goblet, Fig. 1). In altri Paesi (ad esempio, Inghilterra, Francia o Giappone), la sola evidenza istologica dell’epitelio cilindrico è sufficiente per la diagnosi di esofago di Barrett [1, 2].
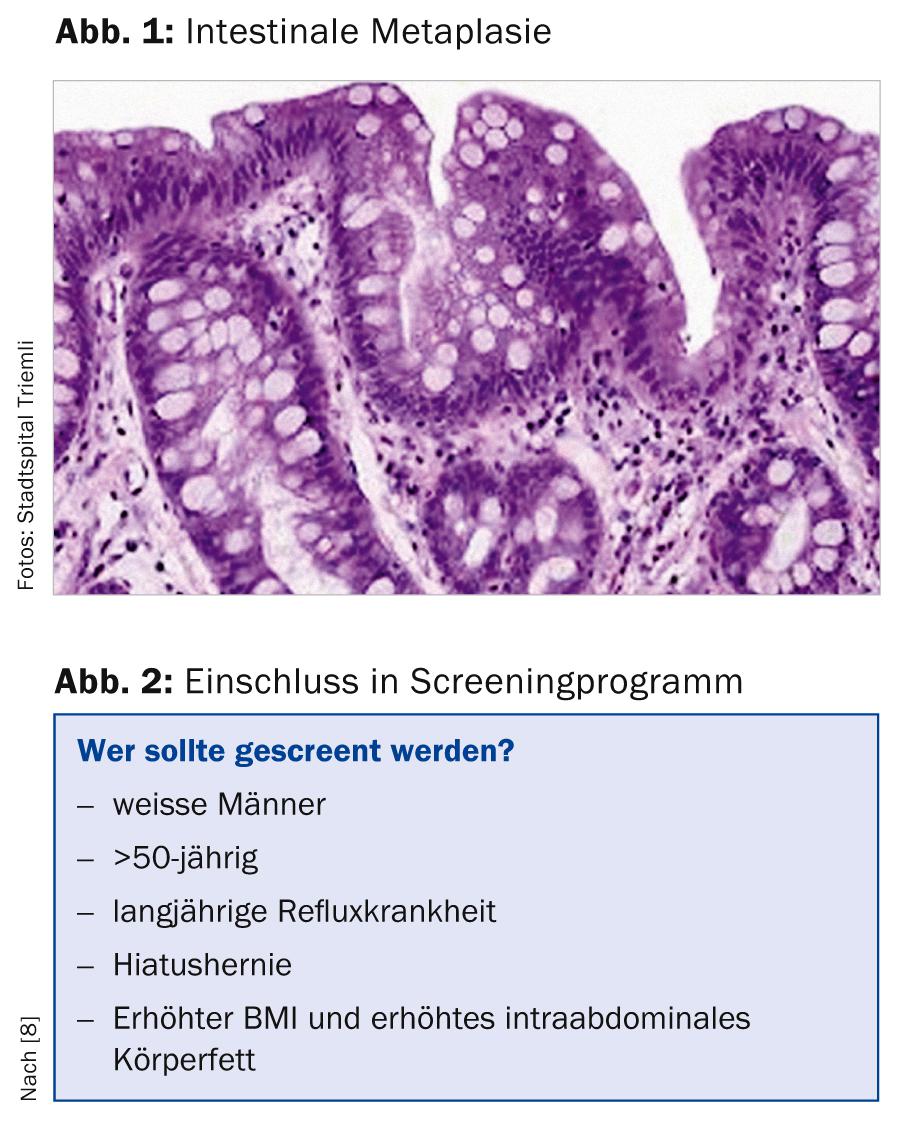
Distinguiamo un esofago di Barrett a segmento lungo (lingua epiteliale lunga almeno 3 cm) da un esofago di Barrett a segmento corto (lingua di Barrett più corta di 3 cm).
Corso
La metaplasia intestinale può svilupparsi dal normale epitelio squamoso esofageo a causa di vari fattori e si riscontra in circa il 5-20% di tutte le panendoscopie superiori. Da questo cosiddetto epitelio di Barrette può svilupparsi una displasia di “basso grado” o di “alto grado”, da cui può svilupparsi un adenocarcinoma. Nonostante le migliori opzioni di trattamento (radiochemioterapia neoadiuvante), l’adenocarcinoma dell’esofago – soprattutto se rilevato tardivamente – ha ancora una prognosi molto sfavorevole, con una sopravvivenza a 5 anni di poco inferiore al 20% [3, 4].
Fattori di rischio noti per lo sviluppo dell’esofago di Barrett
Conosciamo i seguenti fattori di rischio per lo sviluppo di un epitelio a barretta [5, 6]:
- Età
- Genere maschile
- Reclami per il reflusso
- Discendenza caucasica
- Il fumo
- Lunghezza dell’esofago di Barrett
- Obesità centrale
- Diabete di tipo 2.
Screening e sorveglianza: generale
Il rischio annuale di adenocarcinoma dell’esofago è stato probabilmente sovrastimato in modo significativo negli studi più vecchi e si attesta su un livello basso, tra lo 0,1 e lo 0,3% all’anno nei pazienti con esofago di Barrett non displasico, negli studi più recenti (e più grandi). Secondo uno studio di coorte condotto in Gran Bretagna, i pazienti con l’esofago di Barrett muoiono in oltre il 95% non per il carcinoma esofageo, ma soprattutto per malattie cardiovascolari, polmonari o altre patologie tumorali [7]. Per questo motivo, secondo l’American Gastroenterological Association (AGA), i pazienti con più fattori di rischio dovrebbero essere sottoposti a screening (Fig. 2) [8]. L’argomento a favore dello screening di questi pazienti è che l’esofago di Barrett è una condizione precancerosa che di solito si presenta in modo asintomatico. Inoltre, come descritto sopra, l’adenocarcinoma dell’esofago ha una prognosi sfavorevole, che può essere migliorata con una terapia precoce.
L’argomento principale contro lo screening è il fatto che la progressione naturale dall’esofago di Barrett al carcinoma è piccola. Inoltre, le endoscopie e le biopsie comportano alcuni rischi e costi (anche se modesti).
La sorveglianza, come lo screening, serve a ridurre la mortalità dell’adenocarcinoma esofageo. L’inclusione in un programma di sorveglianza è indicativa del fatto che la displasia di “alto grado” o il carcinoma precoce possono essere individuati il prima possibile e gli interventi precoci possono portare a una riduzione dei costi di follow-up e della mortalità. Inoltre, la sorveglianza spesso dà un senso di sicurezza sia al paziente che al medico.
Un argomento contro l’inclusione in un programma di sorveglianza è che la rilevazione endoscopica della displasia può essere relativamente difficile e le biopsie randomizzate possono portare a “errori di campionamento”. Inoltre, anche l’interpretazione istologica delle biopsie prelevate può essere difficile e, come già detto, le endoscopie comportano rischi potenziali e generano costi.
Screening e sorveglianza: linee guida
Esistono diverse linee guida internazionali per la gestione dei pazienti con esofago di Barrett. Di seguito, vorremmo discutere brevemente le linee guida dell’Associazione Americana di Gastroenterologia (ACG), alle quali ci atteniamo essenzialmente presso lo Stadtspital Triemli (Fig. 3) [9]:
I pazienti con esofago di Barrett senza displasia devono sottoporsi a una seconda gastroscopia entro un anno e a un follow-up ogni tre anni se la displasia non viene rilevata.
Se viene rilevata una displasia di “basso grado”, si raccomanda di ripetere la gastroscopia entro sei mesi e di far confermare la displasia da un secondo patologo. In seguito, si consigliano controlli annuali fino a quando la mucosa non sarà due volte priva di displasia.
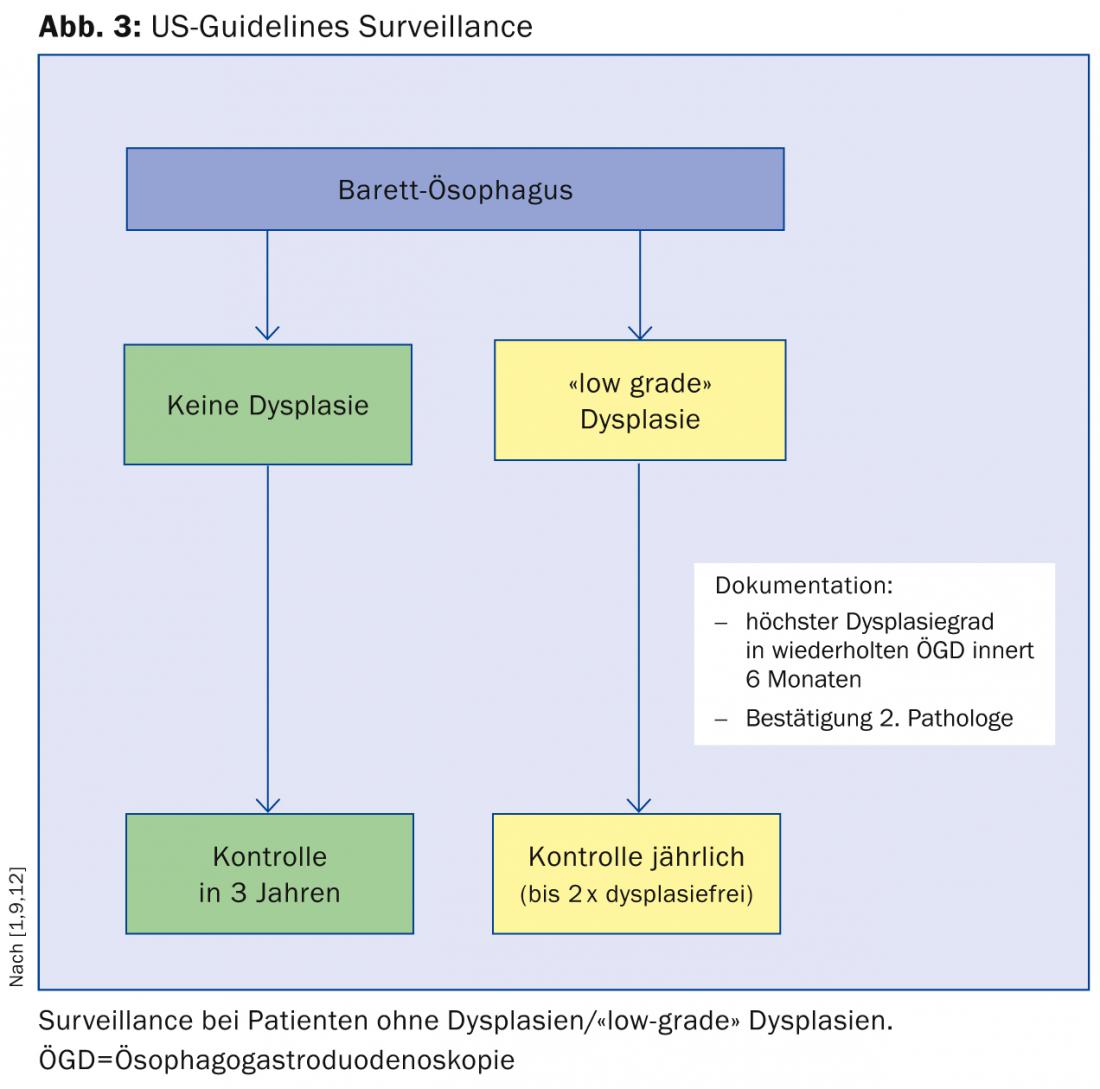
Se viene rilevata una displasia di “alto grado”, è necessaria anche la conferma da parte di un secondo istituto patologico. L’ulteriore procedura dipende poi dall’età del paziente, dall’esperienza del rispettivo centro e dalle comorbidità.
Terapie per l’esofago di Barrett e l’adenocarcinoma
Terapia con inibitore della pompa protonica: si raccomanda la terapia con un inibitore della pompa protonica (PPI, dosaggio 20-40 mg/d) come terapia a lungo termine. Questo nonostante il fatto che non esistano studi randomizzati controllati con placebo che dimostrino che la terapia con PPI porti a una regressione dell’epitelio metaplastico o a una riduzione dello sviluppo del carcinoma [8].
Terapie per le displasie di “alto grado”: le lesioni macroscopicamente visibili e di piccole dimensioni vengono trattate endoscopicamente mediante mucosectomia o ablazione con radiofrequenza (RFA). I pazienti con lesioni di grandi dimensioni dovrebbero essere discussi in modo interdisciplinare tra gastroenterologi e chirurghi. Tuttavia, secondo le raccomandazioni di un gruppo internazionale multidisciplinare di esperti, la resezione endoscopica è generalmente preferibile alla terapia chirurgica, poiché è associata a un tasso di complicanze più elevato [10].
Durante la mucosectomia, le aree di mucosa più grandi vengono aspirate in una cuffia che viene collegata alla punta dell’endoscopio. Le lesioni possono poi essere resecate con un’unità di taglio. Questo metodo consente non solo una terapia delle displasie di “alto grado” e dei carcinomi precoci, ma anche una stadiazione definitiva.
L’ablazione con radiofrequenza – il secondo metodo ampiamente utilizzato per l’ablazione dell’epitelio di Barrett – ablaziona la mucosa di Barrett attraverso l’uso di energia a radiofrequenza rilasciata da un palloncino.
Il risultato a lungo termine di questi metodi è molto buono.
Per esempio, in uno studio recente, tre anni dopo l’ablazione con radiofrequenza, il 98% dei pazienti è rimasto libero da displasia e il 91% dei pazienti non aveva evidenza di mucosa di Barrett [11].
CONCLUSIONE PER LA PRATICA
- L’epitelio della barretta può dare origine a displasia di “basso grado” o “alto grado” e, nel peggiore dei casi, a un pericoloso adenocarcinoma.
- Nei pazienti con esofago di Barrett senza displasia: una seconda gastroscopia (entro un anno) e un follow-up (ogni tre anni) se la displasia non viene rilevata.
- displasie di “basso grado”: ripetizione della gastroscopia entro sei mesi e conferma da parte di un secondo patologo. In seguito, controlli annuali fino a quando la mucosa è priva di displasia per due volte.
- displasia di “alto grado”: conferma anche da parte di un secondo istituto patologico. L’ulteriore procedura dipende dall’età del paziente, dall’esperienza del rispettivo centro e dalle comorbidità.
- Si consiglia la terapia con un IPP.
- La terapia delle displasie di “alto grado” mediante resezione mucosa o ablazione con radiofrequenza mostra risultati molto buoni.
- Sampliner RE, et al: Am J Gastroenterol 2002; 97: 1888-1895.
- Messmann H, et al: Z Gastroenterol 2005; 43: 184-190.
- Shaheen N, et al: Gastroenterologia 2005; 128: 1554-1566.
- Siegel R, et al: Statistiche sul cancro, 2012. Cancer J Clin 2012; 62: 10.
- Prasag G, et. al: Clin Gastroenterol Hepatol 2013; 11: 1108.
- Wani, et al: Clin Gastroent and hepatol 2011; 9: 220-227.
- Masoud S: Gastroenterologia 2013: 144: 1375.
- AGA Institute Medical Position Panel: Gastroenterologia 2011.
- Wang KK: AM J Gastroenterol 2008; 103: 788-797.
- Bennett, et al: Gastroenterologia 2012; 143: 336.
- Shaheen NJ: Gastroenterol 2011; 141: 460-468.
- Sharma P: NEJM 2009; 361: 2548-2556.
PRATICA GP 2014; 9(1): 23-25











