La scelta delle modalità di trattamento del tumore al polmone dipende da diversi fattori. La stadiazione precisa, la valutazione dell’operabilità e la conoscenza dei fattori prognostici, come il numero di stazioni linfonodali interessate e il grading, sono fondamentali. Il trattamento standard per gli stadi iniziali è la chirurgia primaria. Per i pazienti in stadi avanzati ma ancora operabili, la chemioterapia neoadiuvante può migliorare la resecabilità. Per aumentare i tassi di sopravvivenza al cancro al polmone, i programmi di screening dovrebbero essere condotti nei soggetti a rischio.
Il tumore al polmone, con un tasso di sopravvivenza attuale a 5 anni del 15,1%, rimane una forma di cancro con una mortalità molto elevata. Nonostante i finanziamenti massicci e i miglioramenti in tutte le modalità di trattamento disponibili – comprese le terapie anticorpali all’avanguardia – la mortalità è rimasta invariata per 30 anni [1]. La ragione di questo sviluppo insoddisfacente è il fatto che il cancro al polmone viene solitamente diagnosticato solo quando la malattia è già in fase avanzata.
Il cancro al polmone potrebbe certamente essere curato, soprattutto grazie alle opzioni di trattamento chirurgico, ma al momento della diagnosi il 75% dei pazienti colpiti non è più curabile. Questa posizione di partenza sfavorevole migliorerà per i pazienti solo se lo screening coerente del gruppo a rischio con la TAC a basso dosaggio sarà effettuato secondo un algoritmo definito con precisione e se questo screening sarà pagato anche dai fondi di assicurazione sanitaria. In tal caso, la prognosi potrebbe essere effettivamente migliorata, come è stato documentato in modo impressionante a livello scientifico [2], e la mortalità per cancro al polmone diminuirebbe in modo continuo e significativo. Il ruolo della chirurgia cambierà con l’emergere dei programmi di screening e con l’aumento dei metodi chirurgici minimamente invasivi e delle resezioni limitate [3].
Stabilizzazione
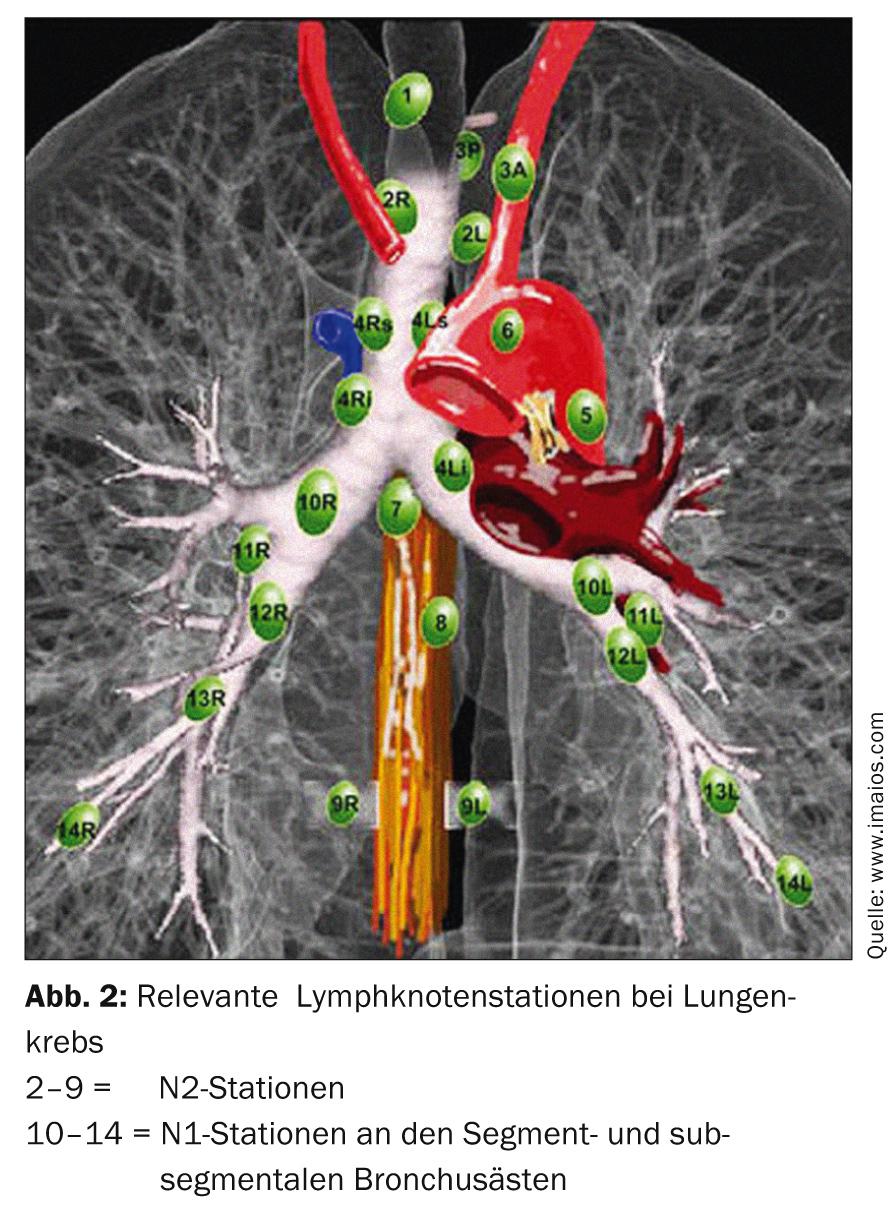
La stadiazione del carcinoma polmonare non a piccole cellule (NSCLC) viene effettuata secondo la classificazione TNM e la stadiazione clinica secondo l’AJCC [4]. La stadiazione viene eseguita dopo la stadiazione ed è molto importante per la selezione delle modalità terapeutiche durante la discussione obbligatoria nel consiglio interdisciplinare sul tumore. Una corretta stadiazione del NSCLC comprende la broncoscopia con biopsia e la TAC e la PET. La determinazione dell’esatto stadio linfonodale (stadio N) è molto importante per la pianificazione della terapia chirurgica. La PET ha un grande peso in questo caso, poiché fornisce risultati molto affidabili in termini di valore predittivo negativo (NPV). Tuttavia, i linfonodi positivi alla PET nel mediastino devono sempre essere documentati istologicamente (ad esempio, con l’ecografia endobronchiale, la biopsia transbronchiale o la mediastinoscopia), poiché la PET è insufficiente in termini di valore predittivo positivo (PPV). Questo vale anche per la sede del tumore primario nel parenchima polmonare. Se nessuna istologia transbronchiale o almeno una citologia a filo documenta una malignità, si raccomanda la puntura transtoracica o la resezione toracoscopica a cuneo per completare la stadiazione [5–7].
Operatività
La maggior parte dei pazienti con NSCLC sono fumatori attivi o ex fumatori con relative comorbidità polmonari e cardiache (BPCO, enfisema, ecc.). Una cosiddetta stadiazione funzionale è quindi una componente importante prima dell’indicazione di un intervento chirurgico. Gli esami chiave per questo sono il test di funzionalità polmonare, l’ergometria e, nei casi critici, la spiroergometria in combinazione con la scintigrafia di perfusione. Si raccomanda di seguire le linee guida ESMO [8]. Per scopi pratici, una buona linea guida è ancora il FEV1, che dovrebbe essere un minimo di circa 1 litro dopo l’operazione.
Fattori prognostici per l’indicazione
La pianificazione di un intervento chirurgico nel NSCLC è molto complessa e richiede una conoscenza dettagliata a causa dell’ampia gamma di aspetto del tumore. Esistono regole metodologiche chiare per l’indicazione e l’obiettivo è quello di fornire al paziente il trattamento più personalizzato o appropriato. per offrire una terapia chirurgica personalizzata. Mentre per gli stadi precoci (T1-2, N0, M0 o AJCC IA-IB) l’attenzione si concentra su metodi di trattamento minimamente invasivi e a risparmio di parenchima, compresa la linfoadenectomia di stadiazione, per gli stadi avanzati che possono ancora essere trattati chirurgicamente (T1-4, N1-2, M0 o AJCC IIA-IIIB) l’attenzione si concentra sull’ottimizzazione delle terapie multimodali oncologiche, radioterapiche e chirurgiche. Il chirurgo deve avere una conoscenza dettagliata dei fattori prognostici importanti ed essere in grado di adattare la terapia anche intraoperatoriamente, utilizzando la diagnostica rapida istopatologica il più frequentemente possibile. Secondo le conoscenze attuali, i seguenti fattori sono fattori prognostici indipendenti per il trattamento chirurgico del NSCLC, ponderati in base all’importanza [9–12]:
- Numero di stazioni linfonodali interessate
- Classificazione e differenziazione istologica
- Linfoinvasione nell’istologia definitiva
- Numero totale di linfonodi colpiti
- Risposta con la terapia neoadiuvante
- Sesso ed età del paziente
- Dimensione del tumore
Terapia chirurgica degli stadi iniziali
I tumori negli stadi T1-T2 senza coinvolgimento linfonodale sono definiti stadi precoci e hanno una prognosi corrispondentemente buona (Fig. 1) .
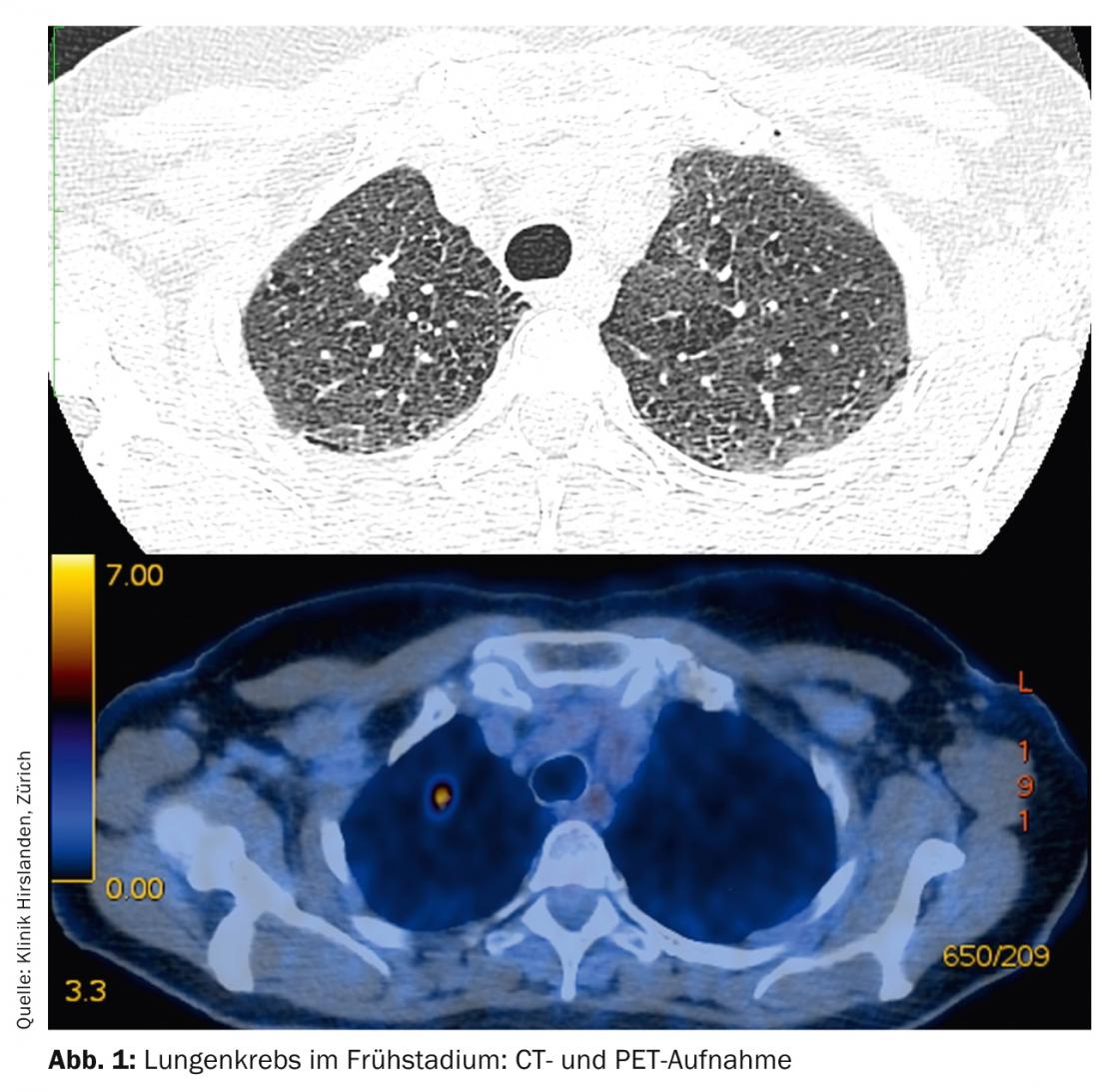
Il trattamento standard è la terapia chirurgica primaria. A seconda della posizione del tumore nel polmone, può essere necessaria una resezione segmentale o una lobectomia. La verifica dello stadio N0 mediante il campionamento sistematico dei linfonodi nel mediastino è obbligatoria (Fig. 2). In caso di cambiamento intraoperatorio dello stadio (coinvolgimento sorprendente N1 o N2), è necessario un adeguamento immediato della terapia chirurgica con linfadenectomia radicale e lobectomia completa. Anche l’età e il performance status del paziente devono essere inclusi come criteri essenziali in questa decisione. Se un paziente è stato sottoposto a resezione segmentaria e si scopre nel post-operatorio che ci sono molti fattori di rischio prognostico (linfangioinvasione, coinvolgimento linfonodale subsegmentale, scarso grading, adenocarcinoma negli uomini, ecc.), è necessaria una lobectomia di completamento nel senso di un secondo intervento e la chemioterapia additiva deve essere discussa nella commissione tumori [13].
Terapia chirurgica degli stadi avanzati
Tutti gli stadi T con coinvolgimento N1 o N2 sono stadi avanzati ma ancora operabili (IIA-IIIB). Ci sono morfologie molto diverse in questo gruppo di pazienti e la pianificazione del trattamento chirurgico è di conseguenza complessa. Ci sono due domande cruciali per definire il percorso dei concetti terapeutici disponibili:
- C’è una grande massa tumorale o una massa linfonodale al centro o nei linfonodi? vicino alla divisione del bronco principale o vicino ad altri organi mediastinici (aorta, cuore)?
- Sono interessate diverse stazioni linfonodali N2? E se sì, quali in relazione al lobo colpito dal tumore?
Se a una di queste domande si deve rispondere “sì”, si pone la questione del pretrattamento neoadiuvante. Se a entrambe le domande si può rispondere negativamente, il paziente viene trattato principalmente con un intervento chirurgico. L’obiettivo del pre-trattamento neoadiuvante è quello di migliorare la resecabilità e di ottenere pazienti con una prognosi intatta. Dopo tre cicli di chemioterapia (ad esempio con cisplatino e docetaxel), si effettua la ristadiazione. Se la risposta è buona, il passo successivo è l’intervento chirurgico. Se non c’è risposta o addirittura progressione della malattia, il paziente non si qualifica per la terapia chirurgica; continuerà a ricevere la chemioterapia o la radioterapia con intento palliativo [14,15].
Caso di studio 1: stadio IIIA, non esteso (non voluminoso), T3 N1
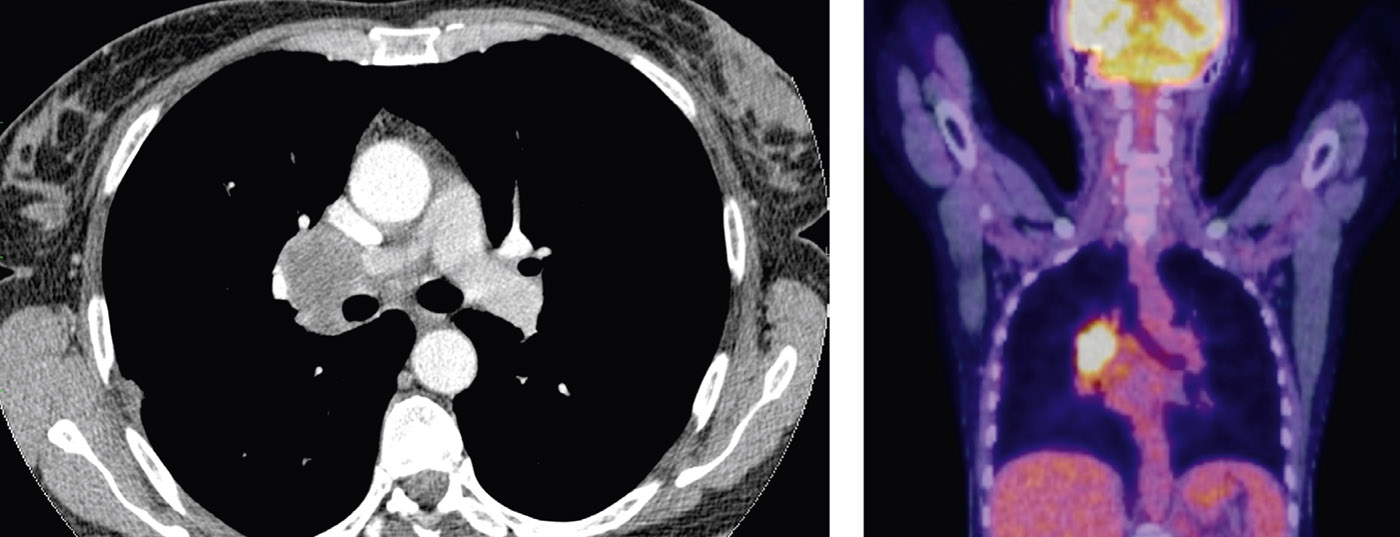
Nella paziente colpita, la diagnostica per immagini mostra un adenocarcinoma che origina dalla lingula, con coinvolgimento linfonodale N1 e due tumori nel lobo (T3) (Fig. 3).

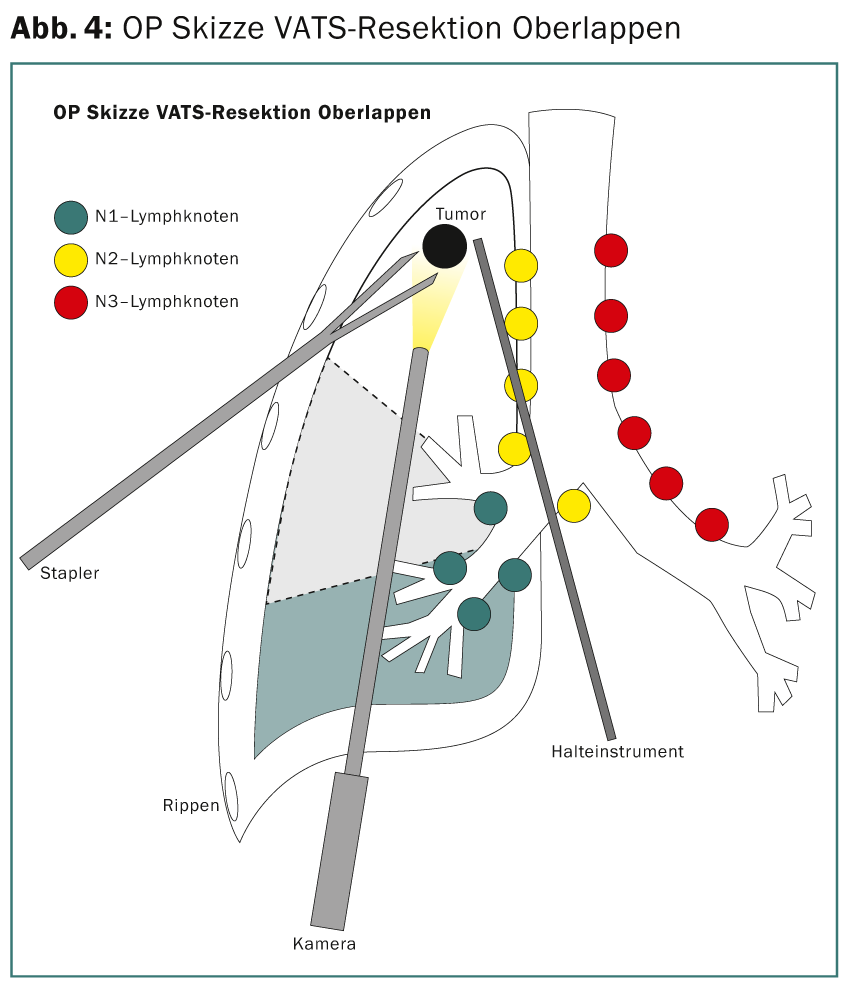
La stadiazione preoperatoria con PET ed ecografia endobrachiale (EBUS) delle stazioni N2 non rivela il tumore. Pertanto, il paziente si qualifica per la terapia chirurgica diretta. Viene eseguita una resezione toracoscopica del lobo superiore (lobectomia minimamente invasiva VATS [VATS thoracic surgery]) (Fig. 4) con ampia linfoadenectomia mediastinica. Intraoperatoriamente, la resezione R0 è confermata da una rapida diagnosi istopatologica dei margini di resezione e dei linfonodi N2. Lo stadio tumorale definitivo TNM della patologia è pT3, pN1 (3 su 34), L1, V1, Pn0, R0. A causa della situazione dei linfonodi, si raccomanda la chemioterapia adiuvante.
Caso di studio 2: stadio IIIA, esteso (ingombrante), T2 N2
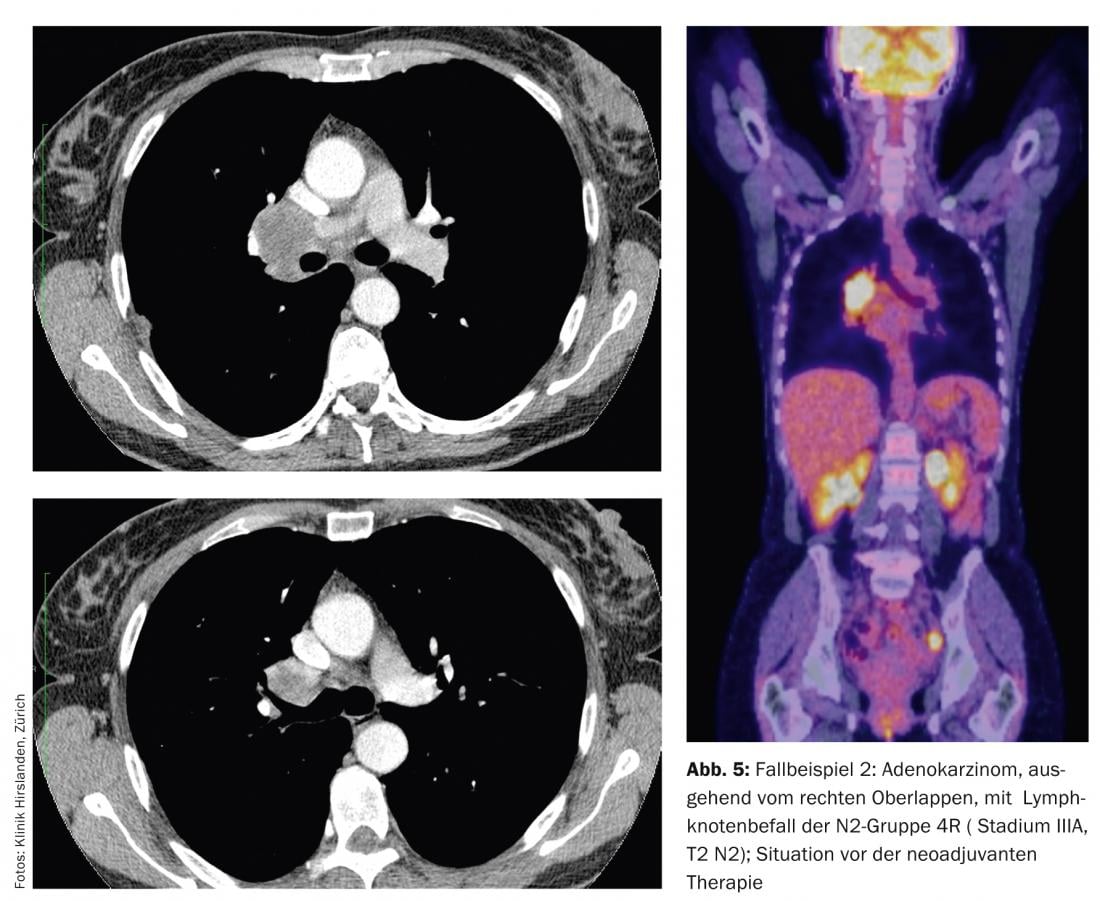
La diagnostica per immagini mostra un adenocarcinoma che origina dal lobo superiore destro con coinvolgimento linfonodale di N2 gruppo 4R (Fig. 5).
Questa infestazione è molto voluminosa e si estende fino o oltre la carina principale. La chirurgia radicale primaria non può essere eseguita in quest’area. Il tumore primario non è voluminoso ed è di circa 5 cm nello stadio T2. La stadiazione preoperatoria con PET ed EBUS delle stazioni N2 non rivela il rilevamento del tumore in altre stazioni N2 o N3 controlaterali. Tuttavia, questo paziente è candidato a un pretrattamento neoadiuvante per ridurre i risultati estesi e selezionare il paziente per la chirurgia. Dopo tre cicli di chemioterapia, una nuova TAC mostra un’ottima risposta (stadiazione inferiore) e nessuna nuova manifestazione tumorale nel senso di nuovi ingrandimenti linfonodali, focolai rotondi o metastasi (Fig. 6).

Pertanto, il paziente si qualifica ora per la terapia chirurgica secondaria. La resezione aperta del lobo superiore con resezione in blocco del bronco principale e ricostruzione broncoplastica (Fig. 7) determina una resezione R0 con conferma intraoperatoria mediante una rapida diagnosi istopatologica dei margini di incisione e dei linfonodi mediastinici radicalmente liberati. Lo stadio tumorale definitivo TNM della patologia è ypT1a, ypN0 (0 su 29), L0, V0, Pn0, R0 (“y” indica lo stato dopo il pretrattamento neoadiuvante). A causa dell’estensione peribronchiale principalmente molto estesa, in questo caso si consiglia di consolidare la radioterapia del mediastino per completare il concetto di terapia multimodale.

Prospettive
Il trattamento degli stadi avanzati del NSCLC è una sfida interdisciplinare e chirurgica. La prognosi media di sopravvivenza a 5 anni per i pazienti affetti è compresa tra il 23 e un massimo del 55%. La probabilità di sopravvivenza è davvero buona per i tumori in fase iniziale. La coorte dell’International Early Lung Cancer Action Program (IELCAP) mostra curve di sopravvivenza per i pazienti sottoposti a screening con stadi precoci superiori al 90% (sopravvivenza a 10 anni!). Attualmente, la prognosi complessiva per il tumore al polmone è solo del 15,1% di sopravvivenza a 5 anni per tutti gli stadi, incluso. inutilizzabile. Tutti gli sforzi per migliorare questo dato devono essere concentrati su una migliore prevenzione tra i giovani e su uno screening coerente tra i gruppi a rischio (fumatori attivi o ex fumatori, età superiore ai 50 anni, più di 20 pacchetti di sigarette). In questo modo, l’attuale situazione di povertà, con solo il 15,1% di sopravvivenza a 5 anni, potrà essere migliorata in modo significativo.
Messaggi da portare a casa
- Solo un quarto dei pazienti con cancro al polmone può essere sottoposto a terapia chirurgica e quindi a una potenziale cura.
- Lo screening del gruppo a rischio è necessario per individuare le fasi iniziali; un programma di screening con TAC a basso dosaggio riduce significativamente la mortalità.
- Il gruppo a rischio è costituito da fumatori attivi o ex fumatori di età superiore ai 50 anni con più di 20 anni di pacchetto.
- La profonda conoscenza dei fattori prognostici individuali e generali determina il concetto di terapia su misura, soprattutto per i casi che richiedono un trattamento chirurgico.
Prof. Dr. med. Othmar Schöb
Letteratura:
- Ferlay J, et al: Eur J of Cancer 2013; 49: 1374-1403.
- Il team di ricerca dello studio nazionale sullo screening polmonare: Riduzione della mortalità per cancro al polmone con lo screening tomografico computerizzato a basso dosaggio. N Engl J Med 2011; 365: 395-409.
- Altorki NK, et al: J Thor Cardiovasc Surg 2014; 147(2): 754-764.
- Comitato congiunto americano sul cancro. 7ª edizione.
- Sahiner I, et al: Quant Imaging Med Surg 2014; 4(3): 195-206.
- Shingyoji M, et al: Ann Thorac Surg 2014, Aug 19. pii: S0003-4975(14)01277-6. doi: 10.1016/j.athoracsur.2014. 05.078. [Epub ahead of print].
- Teran MD, et al: J Thorac Dis 2014; 6(3): 230-236.
- Vansteenkiste J, et al: Ann Onc 2014; 25: 1462-1474.
- Riquet M, et al: Ann Thorac Surg 2014; 98: 224-231.
- Ichinose J, et al: Chest 2014; 146;(3); 644-649.
- Kuo SW, et al: J Thorac Cardiovesc Surg 2014; 148(4): 1200-1207.
- Ito M, et al: Lungcan 2014; 85: 270-275.
- Mediratta N, et al: Cardio-Thoracic Surgery 2014; 46: 267-273.
- Jaklitsch MT, et al: J Surg Oncol 2006: 94(7): 599-606.
- Trodella L, et al: Ann Oncol 2014; 15: 389-398.
InFo ONCOLOGIA & EMATOLOGIA 2015; 3(1): 13-17