La radiochemioterapia combinata con citotossici classici e inibitori specifici delle strutture molecolari bersaglio aumenta l’ampiezza terapeutica e fa parte della routine clinica in molte entità tumorali. I citotossici classici aumentano il danno al DNA quantitativamente e qualitativamente in combinazione con le radiazioni ionizzanti; gli inibitori specifici dei bersagli molecolari aumentano l’efficienza del danno al DNA provocato dalle radiazioni. Sia le cascate di trasduzione del segnale specifiche delle cellule tumorali che l’ambiente tumorale (ipossia, sistema immunitario) sono bersagli interessanti per un moderno trattamento combinato.
La radioterapia clinica è cambiata negli ultimi 100 anni, passando da un’applicazione sperimentale dei raggi X a una modalità terapeutica complessa, tecnologicamente molto sofisticata e ampiamente applicata. Probabilmente i progressi tecnologici più importanti che hanno plasmato lo sviluppo della radioterapia sono stati l’introduzione della TAC e della risonanza magnetica, che consentono una precisa localizzazione tridimensionale del tumore, e l’ulteriore sviluppo della tecnologia degli acceleratori lineari, che oggi consentono un’irradiazione precisa del tumore vero e proprio, con la contemporanea riduzione del volume di irradiazione e quindi il risparmio dei tessuti sani. Questo sviluppo ha portato alla tecnologia IMRT (Intensity-Modulated Radiation Therapy) e SBRT (Stereotactic Body Radiation Therapy) utilizzata oggi nella radioterapia clinica. Nonostante questi progressi tecnici, tuttavia, difficilmente in futuro sarà possibile un’escalation illimitata della dose senza ulteriori tossicità importanti per i tessuti normali [1].
Radiochemioterapia combinata
Parallelamente a queste conquiste tecnologiche, sono stati compiuti enormi progressi nel campo della comprensione biologica degli effetti delle radiazioni, che oggi si manifestano nella clinica nel campo della radiochemioterapia combinata. Mentre la combinazione con i chemioterapici classici mira ad aumentare il danno al DNA nella cellula tumorale, le moderne classi di sostanze sono progettate per aumentare l’efficienza del danno al DNA indotto dalle radiazioni e il programma di stress nella cellula tumorale e nel milieu tumorale, che alla fine porta alla morte del tumore.
Oggi comprendiamo l’effetto delle radiazioni in diverse entità tumorali non solo a livello di danno al DNA, ma riconosciamo che la diversa sensibilità alle radiazioni nel tumore e nel tessuto normale è dovuta a una complessa rete di cascate di trasduzione del segnale intra- e intercellulare. Queste scoperte hanno portato allo sviluppo di nuove strategie per superare la resistenza alle radiazioni, sia intrinseca che acquisita, nell’ambito della radiochemioterapia combinata con radiosensibilizzatori. Queste strategie includono sia sostanze a piccole molecole che inibiscono in modo specifico le cascate di segnalazione guidate dagli oncogeni, sia moderni modulatori dei checkpoint immunitari, con l’obiettivo di aumentare l’ampiezza terapeutica nel contesto della radiochemioterapia combinata [2,3].
Attualmente, oltre il 50% di tutti i pazienti con un tumore solido viene trattato con la sola radioterapia o come parte di una terapia combinata con chirurgia e/o chemioterapia. Attualmente, il 40% di tutti i pazienti oncologici per i quali è possibile ottenere una cura riceve anche la radioterapia come parte di una terapia combinata.
Sebbene il carcinoma a cellule squamose della testa e del collo (avanzato) colpisca solo una piccola percentuale di tutti i pazienti oncologici, lo sviluppo della radiochemioterapia combinata può essere illustrato molto bene da questa entità tumorale. A livello di ricerca preclinica, negli ultimi 20 anni sono state testate innumerevoli combinazioni di radioterapia con inibitori di piccole molecole di varie strutture bersaglio. Tuttavia, finora solo poche strategie sono state implementate con successo nella clinica.
Ipossia tumorale
L’ipossia, dovuta principalmente alla vascolarizzazione non strutturata del tumore, è uno dei principali meccanismi di resistenza alle radiazioni nell’HNSCC. Una meta-analisi di livello 1a, basata sull’evidenza, del 2011, mostra chiaramente che varie strategie di modifica dell’ipossia (somministrazione di ossigeno iperbarico, respirazione di carbogeni in combinazione con nicotinamide e radiosensibilizzatori, ecc. È quindi ancora più sorprendente che tali strategie di modifica dell’ipossia non siano entrate nella routine clinica fino ad oggi – tranne che in Danimarca con il nimorazolo.
Il nimorazolo appartiene alla classe dei cosiddetti mimetici dell’ossigeno (misonidazolo, etanidazolo, pimonidazolo), che sono stati testati clinicamente per decenni come prototipi di radiosensibilizzatori dell’ipossia. Tuttavia, la maggior parte di questi derivati nitroimidazolici provoca una grave neurotossicità a dosi elevate e, pertanto, vengono utilizzati clinicamente solo come marcatori diagnostici dell’ipossia tumorale. Tuttavia, sembra che il nimorazolo stia entrando nella routine clinica, in parte grazie all’esperienza acquisita negli studi clinici con i cosiddetti “prodromi dell’ipossia” (tirapazamine, evofosfamide) [5,6]. Questi studi dimostrano che la caratterizzazione dello stato di ipossia e la stratificazione appropriata devono essere intraprese quando la radiochemioterapia combinata viene somministrata con radiosensibilizzatori ipossici. In generale, ci sono grandi sforzi per determinare sia lo stato di ipossia prima dell’inizio del trattamento, sia la dinamica dell’ipossia tumorale sotto la radioterapia in modo predittivo mediante la PET dell’ipossia (ad esempio con misonidazolo marcato con F18). Allo stesso tempo, è stata identificata anche una cosiddetta firma di espressione di 15 geni per la classificazione dell’ipossia. Questa firma caratterizza i tumori come più o meno ipossici e integrerà la determinazione diretta convenzionale della pressione parziale dell’ossigeno nel tumore per quanto riguarda la caratterizzazione dell’ipossia. Ad esempio, uno studio prospettico multicentrico di fase III dell’EORTC (EORTC-1219) sta attualmente studiando l’effetto del nimorazolo in combinazione con la radiochemioterapia a base di cisplatino nell’HNSCC localmente avanzato, HPV/p16-negativo. Si determinerà anche se questa firma a 15 geni è adatta come classificatore predittivo. È in preparazione un altro grande studio di fase III sul nimorazolo (DAHANCA30).
Il recettore EGF come bersaglio terapeutico
Diversi studi randomizzati e di routine clinica hanno dimostrato da oltre 15 anni che la somministrazione contemporanea di cisplatino in combinazione con la radioterapia aumenta sia il tempo libero da progressione che la sopravvivenza globale rispetto alla sola radioterapia. Meccanicamente, questo effetto si basa prevalentemente sulla modifica combinata del DNA da parte del cisplatino e dei radicali reattivi dell’ossigeno generati dalle radiazioni, che insieme portano a un danno complesso del DNA. Allo stesso tempo, però, questa combinazione comporta anche gravi effetti collaterali acuti e cronici [7]. Questo ha stimolato un’intensa ricerca di terapie alternative, che ha portato alla combinazione della radioterapia con l’anticorpo monoclonale specifico per l’EGFR, il cetuximab (Erbitux®).
La sovraespressione di EGFR (recettore del fattore di crescita epidermico) è un fattore prognostico forte e indipendente nell’HNSCC. Il cetuximab si lega con elevata affinità al suo dominio extracellulare, bloccando così il legame dei ligandi che attivano il recettore. Il cetuximab in combinazione con la radioterapia è stato testato clinicamente nel noto studio di Bonn rispetto alla sola radioterapia ed è stato caratterizzato da un miglioramento della sopravvivenza libera da progressione e della sopravvivenza globale (49 vs 29 mesi), nonché da una notevole riduzione delle tossicità dei tessuti normali [8].
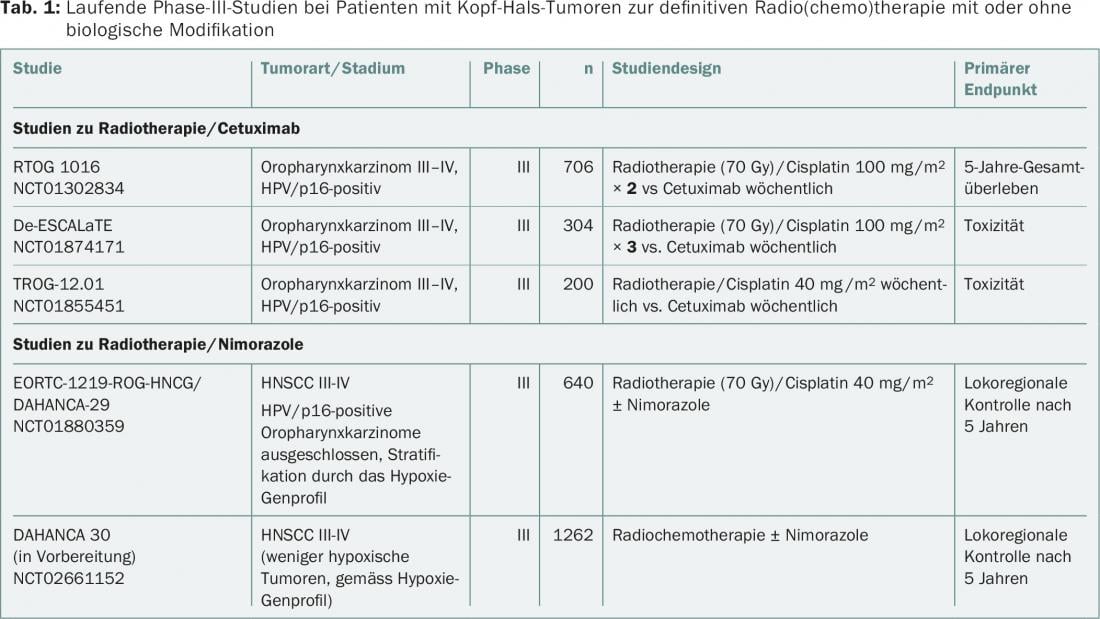
Ad oggi, non è stato documentato un confronto diretto tra le due forme di combinazione (cisplatino/radioterapia vs cetuximab/radioterapia). In termini di de-escalation del trattamento, tre studi randomizzati di fase III stanno attualmente studiando il valore della radioterapia/cetuximab rispetto alla radioterapia/cisplatino nel carcinoma orofaringeo HPV/p16-positivo (RTOG 1016, De-ESCALaTE, TROG-12.01) (tab. 1). In parte a causa del numero schiacciante di studi sulla combinazione cisplatino/radioterapia – rispetto agli studi sulla combinazione cetuximab/radioterapia – il cisplatino rimane lo standard di cura in combinazione con la radioterapia. Il cetuximab/radioterapia viene oggi utilizzato principalmente per i pazienti affetti da HNSCC in situazioni ad alto rischio, ad esempio intolleranza al cisplatino o cattive condizioni generali. È interessante notare che la tripla combinazione di cetuximab/cisplatino/radioterapia non ha migliorato la sopravvivenza libera da progressione o la sopravvivenza globale in uno studio randomizzato [9].
Anche se diversi aspetti dello studio di Bonn sono stati criticati in passato, esso rappresenta una pietra miliare nello sviluppo della radiochemioterapia combinata. A livello preclinico e clinico, è stato possibile dimostrare per la prima volta che l’inibizione di una struttura bersaglio molecolarmente definita (EGFR) nella cellula tumorale porta alla radiosensibilizzazione. La ricerca sui meccanismi d’azione di questa forma combinata ha anche dimostrato che vengono superati i classici meccanismi di resistenza alla radioterapia clinicamente rilevanti (ripopolamento del tumore, capacità di riparazione intrinseca, elevata soglia di apoptosi). È interessante notare che il cetuximab può anche controllare i processi immunomodulatori che influenzano anche la risposta complessiva.
Immunoterapia
L’intensa ricerca preclinica e clinica si concentra oggi sui processi immunologici rilevanti dal punto di vista radioterapeutico. La radioterapia è stata a lungo caratterizzata come immunosoppressiva, in quanto le cellule ematopoietiche sono particolarmente radiosensibili. Tuttavia, è stato dimostrato che l’irradiazione del tumore ha anche un effetto immunostimolante.
Le radiazioni ionizzanti determinano l’attivazione delle cellule natural killer, l’infiltrazione di cellule T CD8-positive, l’aumento della presentazione dell’antigene nelle cellule dendritiche e la produzione di citochine immunostimolanti nel tumore. Tuttavia, la nostra comprensione di questi processi indotti dalle radiazioni è solo rudimentale [10]. Ad esempio, vediamo modelli di reazione completamente diversi dopo l’irradiazione frazionata a basse dosi e l’irradiazione con dosi singole elevate – questo a sua volta rende molto interessante la ricerca radiobiologica e traslazionale.
L’attenzione è rivolta alla ricerca sulla morte cellulare immunogenica indotta dalle radiazioni o sull’attivazione del cosiddetto effetto abscopico da parte della radioterapia. Questo si riferisce a un effetto sistemico dell’irradiazione sul tessuto tumorale nei siti non irradiati, che è mediato da processi immunologici. C’è un grande interesse nel potenziare l’effetto abscopico, clinicamente raro, nel contesto della radiochemioterapia combinata con immunomodulatori. Esistono anche protocolli di radiochemioterapia combinata con inibitori del checkpoint immunitario per l’HNSCC. Tuttavia, ci sono ancora molti punti interrogativi e non sono stati completati studi clinici conclusivi in questa promettente area di applicazione.
Diversi studi di fase I/II su pazienti con HNSCC per la radiochemioterapia in combinazione con l’immunoterapia sono attualmente registrati sul sito web dell’NCI (https://clinicaltrials.gov) e sono in preparazione studi randomizzati di fase III.
Conclusione
La radioterapia moderna è una forma di terapia oncologica ad alta tecnologia, in cui ogni paziente riceve un piano terapeutico individuale basato sui parametri clinici (tra cui entità del tumore, volume, posizione). Gli agenti chemioterapici classici aumentano l’efficacia della radioterapia. Nel contesto della “medicina personalizzata”, l’ampiezza terapeutica di questa forma di terapia individuale può essere ulteriormente migliorata con sostanze molecolarmente definite e specifiche. L’obiettivo è superare il profilo di radioresistenza, che si basa sul background genetico individuale del tumore.
Letteratura:
- Baumann M, et al: La radioterapia oncologica nell’era della medicina di precisione. Nat Rev Cancer 2016; 16(4): 234-249.
- Begg AC, et al: Strategie per migliorare la radioterapia con farmaci mirati. Nat Rev Cancer 2011; 11(4): 239-253.
- Morris ZS, et al: Interazione della radioterapia con agenti a bersaglio molecolare. J Clin Oncol 2014; 32(26): 2886-2893.
- Overgaard J: Modifica ipossica della radioterapia nel carcinoma a cellule squamose della testa e del collo – una revisione sistematica e una meta-analisi. Radiother Oncol 2011; 100(1): 22-32.
- Ahn GO, et al.: Colpire i tumori con le citotossine attivate dall’ipossia. Front Biosci 2007; 12: 3483-3501.
- Brown JM, et al: Sfruttare l’ipossia tumorale nel trattamento del cancro. Nat Rev Cancer 2004; 4(6): 437-447.
- Pignon JP, et al.: Meta-analisi della chemioterapia nel cancro della testa e del collo (MACH-NC): un aggiornamento su 93 studi randomizzati e 17.346 pazienti. Radiother Oncol 2009; 92(1): 4-14.
- Bonner JA, et al: Radioterapia più cetuximab per il tumore della testa e del collo locoregionale avanzato: dati di sopravvivenza a 5 anni da uno studio randomizzato di fase 3 e relazione tra l’eruzione cutanea indotta da cetuximab e la sopravvivenza. Lancet Oncol 2010; 11(1): 21-28.
- Ang KK, et al: Studio randomizzato di fase III di radiazione accelerata concomitante più cisplatino con o senza cetuximab per il carcinoma della testa e del collo in stadio da III a IV: RTOG 0522. J Clin Oncol 2014; 32(27): 2940-2950.
- Salama AK, et al: Irradiazione e immunoterapia: dal concetto alla clinica. Cancro 2016; 122(11): 1659-1671.
InFo ONcOLOGIA & EMATOLOGIA 2016; 4(7-8): 12-15.