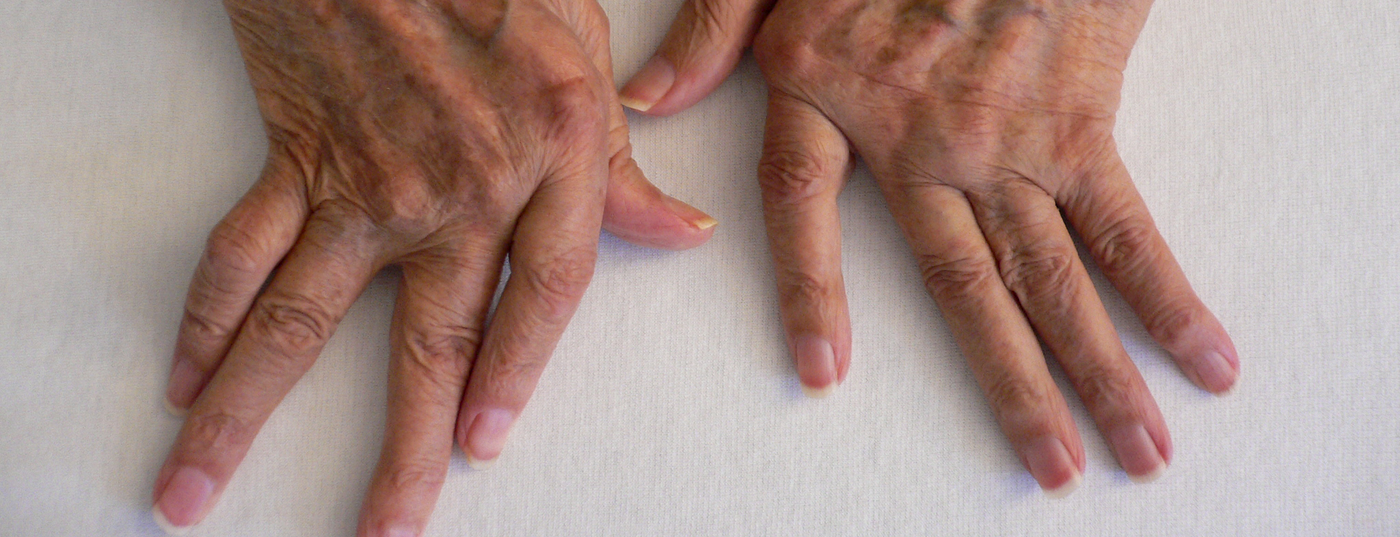
Nell’artrite reumatoide, il sistema immunitario attacca la membrana sinoviale della sinovia. Se non viene trattata, c’è il rischio di una graduale distruzione dell’articolazione. I DMARD sono quindi utilizzati per i cicli gravi. Le analisi omiche dei singoli tipi di cellule forniscono nuove conoscenze sul processo della malattia. Tra le altre cose, l’attenzione è rivolta alla ricerca sull’attività delle cellule T e sui diversi tipi di macrofagi tissutali come base per nuove strategie di trattamento. Le scoperte attuali e i risultati dello studio sono stati presentati in occasione della conferenza annuale della Società tedesca di reumatologia (DGRh).
Per una comprensione differenziata della malattia e delle opzioni terapeutiche che ne derivano, la ricerca sui complessi eventi molecolari che si verificano a livello cellulare è molto istruttiva. I progressi delle tecnologie high-throughput (“omiche”) hanno reso possibili le osservazioni a livello genomico, trascrittomico e regolatorio di varie molecole biologiche (riquadro). L’ulteriore sviluppo di approcci terapeutici contro l’artrite reumatoide ha tratto grande beneficio dai risultati della ricerca di base degli ultimi decenni. “I reumatologi possono ora influenzare bene il decorso della malattia iniettando o infondendo vari anticorpi biologici, da Abatacept a Rituximab”, spiega il portavoce del gruppo di lavoro della Rete di Competenza sul Reumatismo, Prof. Ulf Wagner, MD, dell’Ospedale Universitario di Lipsia [1]. Più recentemente, sono stati aggiunti farmaci sintetici come il baricitinib o il tofacitinib, che possono essere assunti in compresse. “I nuovi farmaci rendono il trattamento più sopportabile per molti pazienti”, afferma l’esperto.

Sviluppare ulteriormente il principio terapeutico della modulazione dell’attività delle cellule T.
L’attivazione delle cellule T autoreattive è di importanza patogenetica centrale nelle malattie autoimmuni come l’artrite reumatoide. Sono coinvolte nella cascata infiammatoria, influenzando altre cellule immunitarie e producendo una serie di citochine proinfiammatorie. Sulla base di queste scoperte, sono stati sviluppati diversi concetti per il blocco terapeutico delle cellule T. Queste mirano a eliminare in gran parte le cellule T dal processo patologico o a influenzare la loro funzione in modo tale da rallentare i loro effetti patogeni. Abatacept (Orencia®) è un modulatore dell’attività delle cellule T che viene utilizzato terapeuticamente da qualche tempo. Il meccanismo d’azione consiste nel bloccare in modo specifico la via di segnalazione CD28-CD80/CD86 [2,3]. Il CD28 è una delle molecole costimolatorie più importanti, espressa da circa la metà delle cellule T. Il CD28 ha due ligandi, il CD80 e il CD86, che sono espressi sulla superficie di varie cellule presentanti l’antigene in modo dipendente dall’attivazione. Inoltre, l’antigene 4 associato ai linfociti T citotossici (CTLA-4) è espresso anche sulle cellule T in modo dipendente dall’attivazione e si lega anche a CD80 e CD86. Tuttavia, a differenza del CD28, il CTLA-4 rallenta l’attivazione delle cellule T attraverso l’inibizione della proliferazione e della produzione di citochine e può quindi essere considerato un antagonista del CD28.
La modulazione delle cellule T dannose è anche il fulcro di una nuova strategia di trattamento attualmente in fase di ricerca. “Attualmente riteniamo che all’inizio della malattia ci sia una perdita di auto-tolleranza, che normalmente impedisce alle cellule T di attaccare le cellule dell’organismo nella membrana sinoviale”, afferma il Prof. Ulf Wagner, MD [1]. “I linfociti T iniziano ad attaccare le cellule sinoviali e inducono i linfociti B a produrre anticorpi, di cui il fattore reumatoide è l’esempio più noto”. Secondo l’esperto, gli studi omici mostrano che il metabolismo delle cellule T cambia completamente nel corso della malattia. Ad esempio, la fornitura di energia passa dalla glicolisi alla via del pentoso fosfato. “Questi processi metabolici alterati possono fornire possibilità completamente nuove per influenzare terapeuticamente le malattie autoimmuni infiammatorie croniche”, spiega il Prof. Wagner. “Il nostro obiettivo dovrebbe essere quello di trasformare le cellule T ‘cattive’ in cellule T ‘buone’ e fermare il processo della malattia proprio all’inizio”. Il futuro mostrerà se questo approccio terapeutico si affermerà e porterà al lancio sul mercato di sostanze attive corrispondenti.
I macrofagi tissutali come parte della cascata infiammatoria
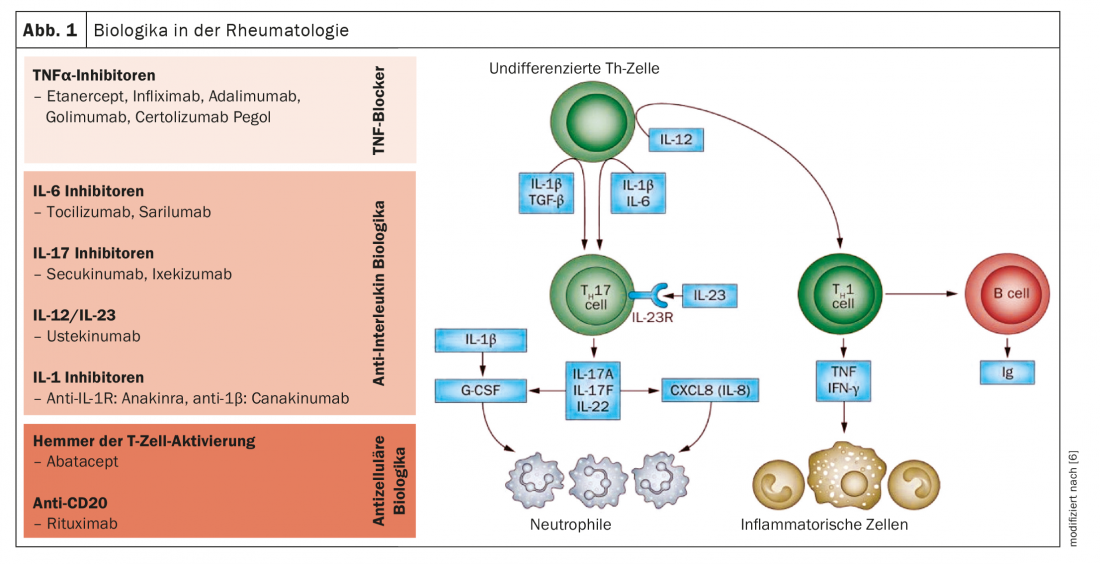
Gli anticorpi biologici e i farmaci sintetici approvati finora bloccano le citochine o i loro recettori, che vengono rilasciati dalle cellule del sistema immunitario nell’ambito dei processi infiammatori (Fig. 1 e 2). La ricerca di base si è nel frattempo rivolta alle diverse cellule infiammatorie che producono queste citochine. I metodi omici più recenti, come il sequenziamento dell’RNA di una singola cellula, il profilo dei ribosomi o la spettrometria di massa, consentono di conoscere per la prima volta le singole cellule. “Le indagini mostrano quali gruppi di cellule si comportano in modo diverso nei pazienti reumatici rispetto alle persone sane e quali sono quindi probabilmente coinvolti nel processo della malattia”, spiega il Prof. Wagner [1]. Combinando diverse tecnologie omiche, si può ottenere un quadro più completo dell’espressione genica, della quantità di proteine o di vari processi intracellulari. Uno degli attori centrali dell’artrite reumatoide sono i macrofagi tissutali, che sono presenti anche nella membrana sinoviale delle persone sane. “La ricerca vuole chiarire cosa fa sì che queste cellule rilascino le citochine infiammatorie e come si possa prevenire”, dice l’esperto.
Macrofagi tissutali MerTK-negativi e CD206-negativi come target
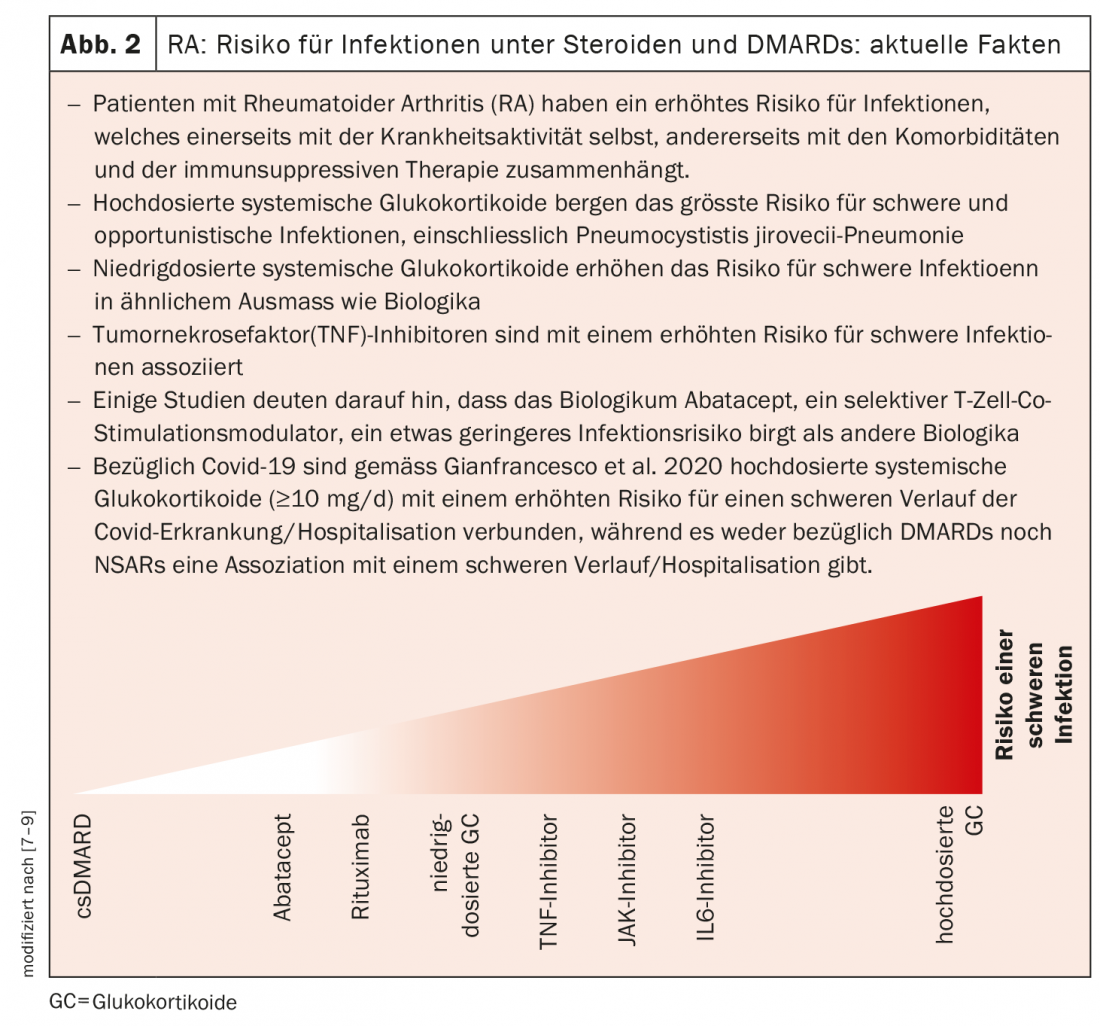
I ricercatori di base hanno scoperto, ad esempio, che esistono due gruppi di macrofagi tissutali che si distinguono per i marcatori di superficie MerTK e CD206. Un recente studio pubblicato su Nature Medicine ha rilevato che i macrofagi tissutali MerTK-negativi e CD206-negativi producono una serie di citochine pro-infiammatorie e allarmine, promuovendo le risposte infiammatorie nella membrana sinoviale [4]. Al contrario, i macrofagi tissutali MerTK-positivi e CD206-positivi sembrano inibire le risposte infiammatorie. Queste cellule si trovano soprattutto nei pazienti la cui infiammazione si è completamente attenuata. Il Prof. Wagner spiega: “L’idea di un approccio terapeutico sarebbe quella di utilizzare farmaci per mettere i macrofagi tissutali in uno stato di quiescenza permanente e quindi fermare la malattia a lungo termine”.
Congresso: Conferenza annuale della DGRh
Letteratura:
- “Artrite reumatoide: l’analisi di singole cellule consente nuove conoscenze sul processo della malattia – si prevedono nuovi approcci terapeutici”, Congresso tedesco di reumatologia, 16.09.2021
- Swissmedicinfo: Orencia®, www.swissmedicinfo.ch (ultimo accesso 18.11.2021)
- Graninger W, Emminger W, Scheinecker C: J Med Drug Rev 2013; 3: 44-60.
- Alivernini S, et al: Nat Med 2020; 26(8): 1295-1306.
- Rosenstiel P, Franke A, Schreiber S: Prevedere e trattare individualmente l’infiammazione cronica. www.systembiologie.de (ultima chiamata 18.11.2021)
- Mihai C: Workshop sul reumatismo, Carmen-Marina Mihai, MD, 23.09.2021; www.usz.ch/app/uploads/2021/09/CMihai_NW-Biologika_RheumaWorkshop_Sept21.pdf (ultimo accesso 18.11.2021)
- Tamborrini G: Rischio di infezione con DMARD e steroidi, Weekly 2021, www.rheuma-schweiz.ch (ultimo accesso 18.11.2021).
- Riley TR, et al: Rischio di infezioni con glucocorticoidi e DMARD nei pazienti con artrite reumatoide, RMD Open 2021: online.
- Gianfrancesco M, et al: Ann Rheum Dis 2020; 79: 859-866.
InFo PAIN & GERIATURE 2021; 3(2): 30-31
PRATICA GP 2021; 16(12): 20-22