L’uso di oncologici e immunoterapici mirati ha rivoluzionato il trattamento del cancro della pelle nera negli ultimi anni. Tuttavia, la sequenza terapeutica ottimale rimane ancora oggi poco chiara. Uno studio ha ora analizzato la questione se lo stato di mutazione BRAF V600E/K abbia un impatto sul successo dell’immunoterapia nel melanoma maligno avanzato.
Circa il 40% di tutti i melanomi metastatici presenta una mutazione BRAF, con la mutazione BRAF V600E/K attivante che è di gran lunga la più comune [1]. Questa alterazione genetica può essere di beneficio terapeutico e serve come bersaglio per vari trattamenti mirati. Ad esempio, vemurafenib ed encorafenib sono inibitori BRAF specifici per la mutazione, molto apprezzati nella terapia del melanoma. La combinazione con gli inibitori di MEK, come trametinib, può aumentare ulteriormente l’efficacia di queste sostanze e portare a una minore resistenza secondaria. Come BRAF, MEK è un componente della via di segnalazione MAPK, che è importante nella patogenesi e la cui attivazione incontrollata porta a una crescita cellulare eccessiva nel melanoma BRAF-mutato [2]. Oltre agli agenti mirati per l’inibizione di BRAF e MEK, gli immunoterapici sono utilizzati anche nel trattamento del tumore della pelle nera metastatico [3]. Con la moltitudine di opzioni, si pone anche la questione della sequenza terapeutica ottimale per massimizzare l’efficacia e la tollerabilità. I dati attuali suggeriscono che la risposta alla terapia di prima linea è migliore rispetto a tutti i trattamenti successivi, indipendentemente dal fatto che si utilizzino principalmente inibitori del checkpoint o BRAF/MEK [4].
Valutazione dell’immunoterapia dopo una terapia mirata
Ulteriori prove sulla potenziale interazione tra terapie mirate e inibitori del checkpoint nel trattamento del melanoma maligno sono ora fornite da uno studio recentemente pubblicato su JAMA Oncology. Gli autori hanno studiato l’influenza dello stato di mutazione BRAF e del precedente trattamento di inibizione BRAF/MEK sull’immunoterapia con l’inibitore PD-1 pembrolizumab. Per farlo, hanno analizzato i dati dei tre studi clinici randomizzati KEYNOTE-001, KEYNOTE-002 e KEYNOTE-006. L’analisi ha incluso 1558 pazienti adulti con melanoma avanzato di cui era noto lo stato di mutazione BRAFV600E/K e che hanno ricevuto pembrolizumab. 1124 pazienti presentavano un BRAF wild type (WT) e 434 pazienti avevano una mutazione BRAF, che era stata mirata in 271 casi. Gli endpoint primari dell’analisi retrospettiva erano il tasso di risposta obiettiva (ORR) al pembrolizumab, nonché i tassi di PFS e OS dopo quattro anni di immunoterapia. (Tab.1). Da un lato, gli esiti sono stati confrontati nei pazienti con stato BRAF WT e BRAF mutato; dall’altro, gli autori hanno anche valutato gli effetti della terapia con inibitore BRAF con o senza inibizione MEK aggiuntiva nel sottogruppo di pazienti il cui tumore presentava una mutazione BRAF.
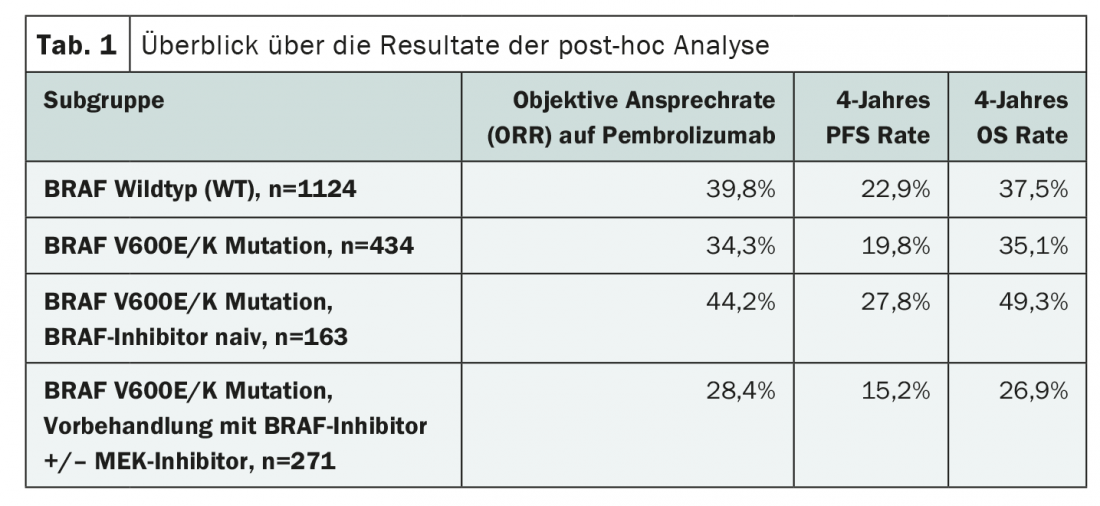
Confrontando i tumori BRAF WT e BRAF mutati, sono stati osservati risultati leggermente migliori in quelli senza mutazione (Tab. 1). Tuttavia, la maggior parte dei pazienti con mutazione BRAF aveva ricevuto una precedente terapia con inibitori BRAF/MEK. Inoltre, erano in media più anziani e più spesso avevano già subito un trattamento con ipilimumab.
Il confronto dei sottogruppi con e senza trattamento con BRAF inibitore ha suggerito che un corrispondente pre-trattamento era un prerequisito insufficiente per l’immunoterapia (Tab. 1). Tuttavia, nell’indagine più dettagliata, è emerso che i pazienti che erano stati pretrattati con una terapia mirata presentavano generalmente condizioni peggiori. Per esempio, c’era un numero maggiore di tumori PD-L1 negativi e di metastasi cerebrali. Tuttavia, un certo effetto è rimasto in varie analisi di sottogruppo, che, secondo gli autori, potrebbe essere dovuto a debolezze nella selezione dei pazienti dello studio.
Per quanto riguarda la sicurezza, né lo stato di mutazione né il pre-trattamento con inibitori BRAF sembravano avere un ruolo. Le reazioni avverse ai farmaci sono state distribuite in modo uniforme tra tutti i pazienti. Gli autori concludono che l’uso di pembrolizumab può fornire un beneficio clinico in tutti i sottogruppi studiati e che la sicurezza è garantita anche con il pre-trattamento. Per confermare queste affermazioni, per dimostrare eventualmente un effetto significativo della terapia con BRAF inibitore sulle linee di trattamento successive, o addirittura per poter consigliare una sequenza terapeutica, probabilmente è ancora necessaria molta ricerca, anche nell’ambito di studi prospettici. Sebbene sia già stato fatto molto con lo sviluppo di diverse nuove sostanze che hanno già migliorato in modo duraturo la prognosi nel melanoma maligno, ulteriori pietre miliari nella gestione del tumore della pelle nera potrebbero essere raggiunte con il loro uso ottimale e il trattamento specifico per sottogruppo.
Fonte: Puzanov, et al: Associazione dello stato di mutazione BRAF V600E/K e della precedente inibizione BRAF/MEK con i risultati di Pembrolizumab nel melanoma avanzato: analisi congiunta di 3 studi clinici. JAMA Oncol 2020; 6(8): 1256-1264.
Letteratura:
- Long GV, et al: Associazioni prognostiche e clinicopatologiche di BRAF oncogenico nel melanoma metastatico. J Clin Oncol 2011; 29(10): 1239-1246.
- Knispel S, et al: Melanoma maligno: opzioni per i pazienti in fase avanzata. Dtsch Arztebl International 2018; 115(20-21): 4-9.
- National Comprehensive Cancer Network: Linee guida di pratica clinica NCCN: melanoma cutaneo (versione 4.2020). www.nccn.org/professionals/physician_gls/pdf/cutaneous_melanoma.pdf.
- Johnson DB, et al: Trattamento sequenziale nel melanoma mutante BRAFV600: Anti-PD-1 prima e dopo l’inibizione di BRAF. J Immunother 2017; 40(1): 31-35.
InFo ONCOLOGIA ED EMATOLOGIA 2020; 8(6): 30