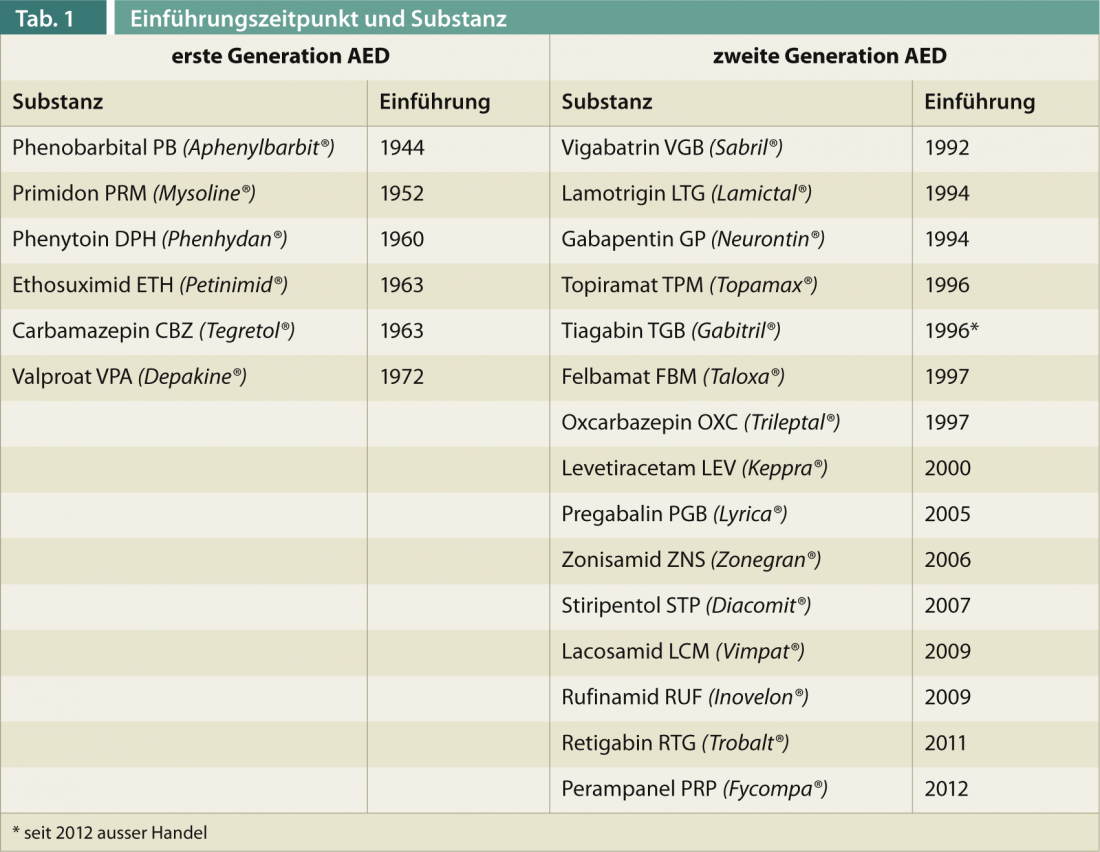
I farmaci antiepilettici di prima generazione (AED) (Tab. 1) – il valproato è stato autorizzato per l’ultima volta in Svizzera nel 1972 – sono caratterizzati da una farmacocinetica complessa. In particolare, l’induzione e l’inibizione degli enzimi epatici, soprattutto del tipo citocromo P, determina interazioni farmacologiche potenzialmente rilevanti, con il rischio di perdita di efficacia e di sovradosaggi indesiderati in caso di cambio di farmaci. Inoltre, lo spettro degli effetti collaterali, soprattutto in termini di effetti cronici (osteoporosi, polineuropatia, atrofia cerebellare, ecc.), è talvolta grave. Gli AED di seconda generazione sono stati utilizzati nella farmacoterapia dell’epilessia a partire dagli anni Novanta. Si differenziano dai suddetti principalmente per un minor numero di effetti collaterali e una migliore farmacocinetica, ma non per un’efficacia significativamente migliore. Contrariamente alle speranze iniziali, questi farmaci, come i vecchi AED, non hanno un effetto antiepilettico, cioè non hanno un effetto comprovato sull’epilessia come malattia e continuano ad agire solo in modo sintomatico per prevenire le crisi.
I farmaci approvati negli ultimi cinque-dieci anni si caratterizzano in particolare per il loro effetto specifico su sindromi epilettiche speciali, nel senso di farmaci orfani (RUF e FBM agiscono sulla sindrome di Lennox-Gastaut, STP sulla sindrome di Dravet). Secondo gli autori, tuttavia, non devono essere classificati come farmaci di terza generazione perché, in base alle scoperte fatte finora, non differiscono in modo rilevante dai farmaci di seconda generazione, né in termini di spettro d’azione, né di effetti collaterali, né di interazione. Il loro impiego nelle epilessie resistenti alla terapia, dopo il fallimento di altri farmaci aggiuntivi, può essere utile, poiché in alcuni casi sono presenti altri meccanismi d’azione.
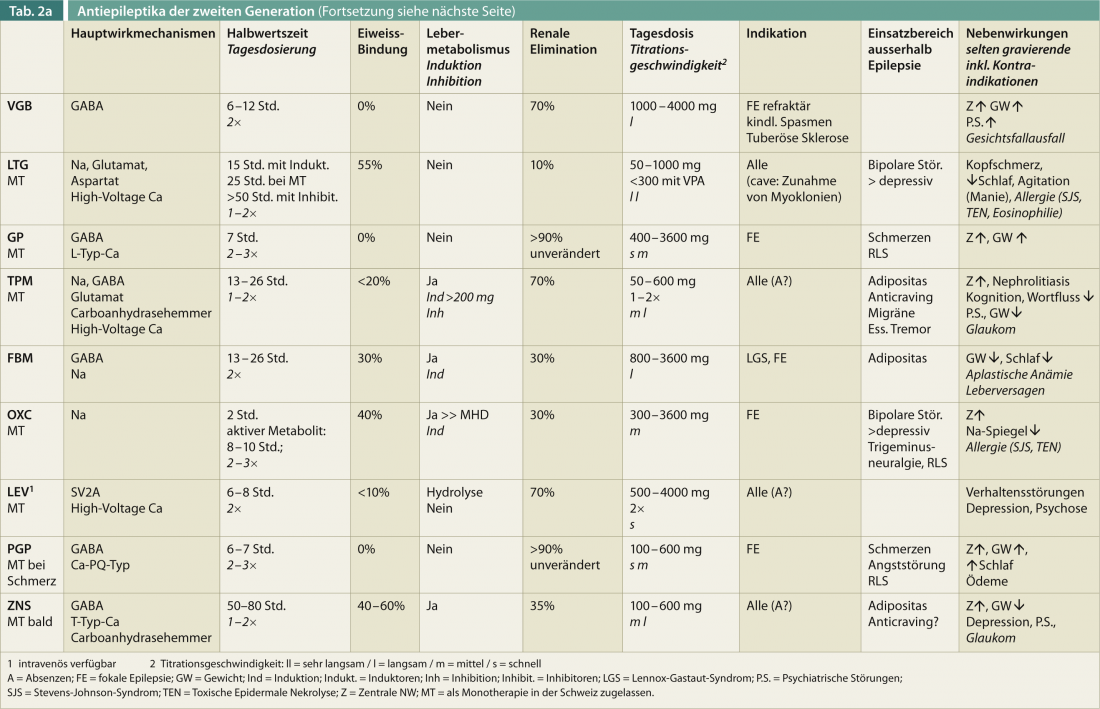
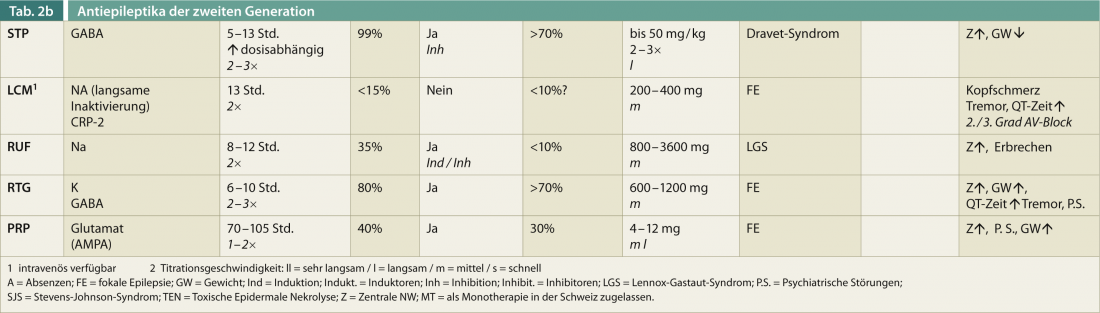
Una panoramica delle caratteristiche rilevanti per la terapia degli AED di seconda generazione (senza pretese di completezza) dovrebbe aiutare a orientarsi rapidamente (Tab. 2). L’età, il sesso, la comedicazione e l’effetto positivo su altre patologie sono fattori essenziali per la scelta ottimale di un farmaco antiepilettico.
Nel seguente articolo, le benzodiazepine che attaccano il recettore GABA-A, come il clonazepam (Rivotril®), il clobazam (Urbanyl®), il lorazepam (Temesta®) e il midazolam (off-label in Svizzera, ad esempio come spray nasale) non vengono discusse. Oltre alla sedazione – soprattutto all’inizio – mostrano più spesso lo sviluppo della tolleranza, a volte anche la perdita dell’effetto. Sono indicati principalmente come farmaci di emergenza e per episodi di crisi prevedibili (infezioni, mestruazioni, ecc.), nonché quando si cambia o si introduce un DAE.
Meccanismi d’azione vecchi e nuovi dei farmaci anticonvulsivi
I meccanismi d’azione tipici noti dei farmaci antiepilettici sono il blocco dei canali del sodio veloci voltaggio-dipendenti e di vari canali del calcio, il potenziamento dell’effetto inibitorio del GABA attraverso l’inibizione della degradazione e della ricaptazione o l’attacco diretto ai recettori del GABA e la riduzione dell’azione sinaptica del glutammato. L’effetto degli AED di seconda generazione si basa in parte sugli stessi obiettivi farmacodinamici, ma ci sono anche delle differenze. Quindi, il PRP riduce il rilascio del neurotrasmettitore attivante glutammato; a differenza dei farmaci più vecchi, qui viene descritto un nuovo sito d’azione con una farmacodinamica non competitiva sui recettori. La LCM modula i canali Na cellulari, ma un sottotipo specifico che mostra tempi di apertura dei canali più lunghi. Nuovi meccanismi d’azione, ad esempio nella LEV, sono la modulazione di una proteina vescicolare (SV2) o CRP2 nella LCM. In genere, è favorevole alla combinazione di AED con meccanismi d’azione diversi. Le combinazioni di AED con lo stesso meccanismo d’azione, in particolare i bloccanti dei canali del sodio, possono portare a un aumento delle intossicazioni. Nelle epilessie generalizzate, bisogna ricordare che i tipi di crisi specifici possono aumentare e persino verificarsi con effetti sul GABA e sul canale del sodio. Una terapia combinata farmacodinamicamente sinergica ed efficace è quella di VPA e LTG, anche se in questo caso è necessario tenere conto di considerazioni farmacocinetiche (vedere sotto).
Poiché le crisi epilettiche sono sempre più comprese come una “disfunzione di rete”, in futuro sarà necessario rivalutare gli obiettivi e le modalità d’azione dei farmaci DAE.
La farmacocinetica di solito è meno problematica
In linea di principio, gli AED di seconda generazione mostrano una minore interazione con i sistemi enzimatici e i farmaci concomitanti. Pertanto, il legame proteico è solitamente inferiore e la frazione di AED libera, non legata alle proteine, può svolgere un ruolo, soprattutto con le sostanze più vecchie come il DPH; se necessario, deve essere determinata nei singoli casi. Occorre tenere presente che gli AED con una debole induzione enzimatica, come OXC, RUF, FBM e TPM (solo a partire da una dose superiore a 200 mg) possono anche indebolire l’effetto della contraccezione ormonale. Inoltre, i livelli di lamotrigina possono diminuire in modo significativo, cioè di oltre il 50%, in caso di contraccezione ormonale con estrogeni e durante la gravidanza. I controlli a specchio sono essenziali in questo caso.
Gli effetti inibitori dei farmaci VPA concomitanti devono essere presi in considerazione anche con i nuovi AED, per cui i livelli di LTG possono aumentare in modo significativo, oltre al noto aumento dell’epossido di carbamazepina (metabolita della CBZ). Sono possibili lievi aumenti anche per LEV, PRP, RUF, RTG e FBM. Per altri farmaci, come TPM e CNS, l’impatto non è chiaro. Si deve tenere conto che le intossicazioni e la diminuzione dell’effetto antiepilettico possono verificarsi anche con gli AED di seconda generazione, se si cambia un farmaco concomitante che inibisce o induce un enzima. Soprattutto nel caso degli induttori enzimatici, gli effetti possono ancora manifestarsi con latenze di diverse settimane. Inoltre, va notato che lo stato stazionario viene solitamente raggiunto dopo cinque emivite in caso di modifiche della dose.
Quasi tutti gli AED hanno un meccanismo di assorbimento lineare, vale a dire che l’aumento della dose di farmaco provoca un aumento della concentrazione sierica del farmaco nel sangue di un fattore pari alla quantità della dose. Le eccezioni sono l’aumento esponenziale di DPH, l’assorbimento non lineare ridotto di VPA a dosi più elevate e l’assorbimento saturabile di GP e CNS a dosi più elevate. Il PRP viene assorbito con un leggero ritardo rispetto all’assunzione di cibo, vale a dire che il rapporto temporale tra l’assunzione di cibo e l’assunzione del farmaco dovrebbe essere sempre lo stesso.
Gli AED vengono solitamente assunti 2× al giorno; GP, RTG e l’OXC non ritardato devono essere suddivisi in tre dosi giornaliere. Sono possibili monoterapie CNS, PRP e in parte a basso dosaggio con LTG e TPM come dosi singole. Per quanto riguarda le dosi giornaliere, occorre ricordare che la dose totale (soprattutto per LTG) e il numero di dosi devono essere determinati in base alla combinazione con inibitori o induttori enzimatici.
Gli effetti collaterali sono solitamente meno gravi
Oltre il 20% dei pazienti interrompe la terapia antiepilettica a causa degli effetti collaterali, che sono più spesso di natura centrale (affaticamento, atassia dell’andatura, visione doppia). La titolazione più rapida è di solito leggermente migliore con il LEV che con il VPA. Circa un terzo dei pazienti rimane refrattario alla terapia a causa dei ripetuti effetti collaterali del DAE. In sintesi, quasi il 90% sperimenta un qualche tipo di effetto collaterale, che può essere più o meno grave. Nella tabella 2 sono presentati gli effetti collaterali rilevanti degli AED di seconda generazione, senza pretendere di essere completi.
I nuovi AED sembrano avere un rischio di teratogenicità relativamente basso (solo fino a 12 settimane di gravidanza). Tuttavia, il numero complessivo di casi è piuttosto basso in questo senso, con il maggior numero di dati disponibili per LEV – il profilo migliore in questo senso – e LTG. Il VPA e le politerapie presentano la più alta teratogenicità. Il valproato può anche tendere ad avere un effetto negativo sullo sviluppo cognitivo dei figli delle madri che assumono valproato.
DAE ed età
Per la terapia dell’epilessia negli anziani, si deve considerare che il levetiracetam è il più adatto grazie al suo profilo farmacologico e alle poche interazioni, anche per i suoi effetti collaterali centrali e il deterioramento cognitivo relativamente bassi. Inoltre, l’uso di gabapentin e lamotrigina è utile, soprattutto quando sono presenti disturbi comportamentali o comorbilità psichiatriche che possono essere accentuate dalla LEV. Con la LTG, si deve tenere conto del tempo di insorgenza lento, per cui può essere utile l’aggiunta di una benzodiazepina (ad esempio, clobazam).
Indicazioni del DAE
Le indicazioni per gli AED sono definite sulla base degli studi disponibili per le epilessie focali e generalizzate, nonché per le sindromi speciali e sono concesse dalle autorità competenti. Occorre tenere presente che alcuni farmaci che agiscono principalmente per le crisi focali – come VGB, GP, PGB, LCM – possono teoricamente peggiorare le epilessie generalizzate. L’accentuazione della mioclonia nelle epilessie generalizzate è possibile sotto LTG.
Secondo diverse linee guida, la VPA, seguita da TPM e LTG, sono la prima scelta per le epilessie generalizzate idiopatiche. In parte, le esperienze positive vengono fatte anche con LEV e CNS. L’uso del VPA – sebbene sia l’agente più potente nelle epilessie generalizzate idiopatiche con crisi tonico-cloniche generalizzate, assenze (paragonabili all’ETH) e crisi miocloniche – deve sempre essere messo in discussione in modo critico nelle donne con potenziale fertile (vedere sotto).
Per le crisi focali, anche con generalizzazione secondaria, non ci sono differenze di efficacia così significative tra gli AED. LTG o LEV sono raccomandati come agenti di prima linea per le epilessie focali. È inoltre possibile utilizzare OXC, TPM, VPA, GP, PGB e CNS. Invece di reintrodurre la CBZ – in Svizzera, si raccomanda il test genetico HLA-B*15:02 a causa della potenza allergenica (positivo in circa il 10-15% negli asiatici; <2% nella popolazione bianca) – si dovrebbe utilizzare anche l’OXC per l’incidenza leggermente superiore di iponatriemia.
Il gran numero di AED è stato studiato sistematicamente anche per quanto riguarda il loro effetto sulle malattie concomitanti. Queste comorbidità devono sempre essere prese in considerazione al momento della scelta dell’AED (Tabella 2) e contribuiscono in modo significativo alla decisione terapeutica.
Regolazione individuale dei farmaci a livello centrale
Con più di 20 AED disponibili, va notato che la scelta individuale del farmaco ottimale è diventata ancora più importante. Pertanto, oltre al tipo di epilessia , si devono sempre prendere in considerazione l’età, la situazione medica e sociale e le comorbidità dei nostri pazienti. La conoscenza degli effetti collaterali in termini negativi e degli effetti concomitanti in termini positivi dovrebbe integrare le considerazioni farmacocinetiche. I pazienti con un’elevata frequenza di crisi all’esordio dell’epilessia e un’eziologia sintomatica hanno un rischio maggiore di non poter essere controllati con i farmaci. Nei casi di resistenza alla terapia, la chirurgia dell’epilessia deve essere presa in considerazione dopo due anni di terapia infruttuosa con due farmaci antiepilettici. Complessivamente, tuttavia, quasi due terzi dei pazienti (50% con il primo AED e 9% con il secondo) diventano liberi da crisi con pochi effetti collaterali acuti e a lungo termine.
Dr. med. Klaus Meyer
Martinus Hauf, MD
Letteratura:
- Brodie MJ, Barry SJ, et al: Western Infirmary, Glasgow. Commento in Neurologia 2012 15 maggio; 78(20): 1542-1543.
- Glauser T, Ben-Menachem E, et al: Revisione aggiornata delle evidenze ILAE sull’efficacia e l’efficienza dei farmaci antiepilettici come monoterapia iniziale per le crisi e le sindromi epilettiche. Epilepsia 2013; 54(3): 551-563.
- Marson AG, Al-Kharusi AM, et al: Lo studio SANAD sull’efficacia di carbamazepina, gabapentin, lamotrigina, oxcarbazepina o topiramato per il trattamento dell’epilessia parziale: uno studio randomizzato controllato non in cieco. Lancet 2007; 369(9566): 1000-1015.
- Marson AG, Al-Kharusi AM, et al: Lo studio SANAD sull’efficacia del valproato, della lamotrigina o del topiramato per l’epilessia generalizzata e non classificabile: uno studio randomizzato controllato non in cieco. Lancet 2007; 369(9566): 1016-1026.
- Costa J, Fareleira F, et al: Comparabilità clinica dei nuovi farmaci antiepilettici nell’epilessia parziale refrattaria: revisione sistematica e meta-analisi. Epilepsia 2011; 52(7): 1280-1291.
- Perucca E, Tomson T: Il trattamento farmacologico dell’epilessia negli adulti. Lancet Neurol 2011; 10: 446-456.