L’innesto di bypass aorto-coronarico (CABG) con macchina cuore-polmone è il gold standard della rivascolarizzazione miocardica. I risultati della chirurgia off-pump e dell’intervento percutaneo (PCI) devono essere misurati rispetto a questo. I tassi di apertura del bypass dopo il CABG dipendono da molteplici fattori. L’algoritmo per la selezione dell’innesto (innesto toracico interno, radiale o venoso) sta diventando più complesso con l’aumento dell’evidenza clinica. Il concetto moderno di chirurgia coronarica comprende la circolazione extracorporea minimizzata (Mini-ECC o MECC). Le modifiche dell’intervento CABG classico migliorano i risultati clinici (“miglioramento del gold standard”). La moderna chirurgia coronarica può essere eseguita in regime elettivo con una mortalità molto bassa (<1%).
Nella malattia coronarica stabile (CAD), la rivascolarizzazione miocardica mediante innesto di bypass aorto-coronarico (CABG) è il gold standard della terapia. Un’ampia meta-analisi pubblicata di recente, che riassume 100 studi randomizzati che hanno coinvolto quasi 100.000 pazienti, dimostra chiaramente che il CABG riduce significativamente il rischio di morte, infarto miocardico e rivascolarizzazione ripetuta rispetto al trattamento farmacologico. Al contrario, l’evidenza di un beneficio in termini di sopravvivenza dopo un intervento percutaneo (PCI) si riscontra solo quando si utilizzano gli stent a rilascio di farmaco di nuova generazione [1].
La procedura di PCI è diventata molto più efficace negli ultimi decenni, prima con l’introduzione degli stent e poi con gli stent a rilascio di farmaco, il miglioramento della tecnica (peri-)procedurale e l’intensificazione dell’inibizione dell’aggregazione piastrinica. Gli studi comparativi tra le opzioni di trattamento (CABG vs. PCI) rendono ora possibile una scelta basata sull’evidenza, che viene differenziata nelle attuali linee guida per la rivascolarizzazione miocardica (Tab. 1) [2]. Una panoramica di questo è stata già presentata in due articoli nell’ultimo numero di questa rivista [3,4].

La PCI viene misurata rispetto al gold standard del CABG. Il numero di vasi interessati e la complessità delle stenosi coronariche sono criteri importanti per la decisione terapeutica. Vale quanto segue: più complessa è la CHD, più vantaggi offre il CABG rispetto al PCI.
Lo studio SYNTAX
Lo studio SYNTAX è stato fondamentale a questo proposito, in quanto ha differenziato i vantaggi e gli svantaggi delle opzioni di trattamento nei pazienti con malattia coronarica a tre vasi e/o stenosi del tronco principale. Nell’analisi a 5 anni, l’endpoint primario combinato (mortalità per tutte le cause, infarto miocardico, reintervento coronarico e ictus) è stato raggiunto significativamente più spesso dopo PCI che dopo CABG (37,3% vs. 26,9%; p<0,0001) [5]. Se considerata singolarmente, la mortalità cardiaca a cinque anni era significativamente più alta dopo la PCI (9,0% vs. 5,3%; p=0,003). Il tasso di infarto miocardico è stato significativamente più alto dopo PCI (9,7%) rispetto a CABG (3,8%; p<0,001), e i reinterventi coronarici sono stati necessari circa il doppio dopo PCI rispetto a CABG (25,9% vs. 13,7%; p<0,001). Dopo un anno, c’era una differenza significativa nel tasso di ictus a favore della PCI (0,6% vs. 2,2%; p=0,003) – una complicazione che la cardiochirurgia deve fare ogni sforzo per prevenire! -Anche se questa differenza non era più significativa nelle cifre cumulative dopo cinque anni (2,4% vs. 3,7%; p=0,09).
Per descrivere più precisamente la coorte di pazienti, che comprendeva più di 1800 pazienti nello studio SYNTAX, è stato sviluppato un punteggio per la complessità delle stenosi coronariche, il cosiddetto punteggio SYNTAX. I pazienti con un punteggio SYNTAX intermedio e alto hanno mostrato chiari vantaggi del CABG rispetto al PCI. La differenza nei pazienti con punteggi SYNTAX bassi e stenosi meno complesse non era significativa, rendendo la PCI un’alternativa di trattamento accettabile in questo gruppo di pazienti. In sintesi, dopo cinque anni dallo studio SYNTAX, si può affermare che in toto l’obiettivo di non inferiorità della PCI rispetto al CABG non è stato raggiunto [5].
Osservando i gruppi di pazienti dello studio SYNTAX e di altri grandi studi comparativi come FREEDOM, BEST, PRECOMBAT, ecc. (le dichiarazioni essenziali di questi studi sono raccolte in [3]), che hanno mostrato i vantaggi del CABG rispetto alla PCI nel gruppo di pazienti con malattia coronarica multivessuale, è sorprendente che questi risultati siano stati raggiunti nonostante alcuni aspetti della moderna chirurgia di bypass coronarico non siano stati applicati in modo coerente (ad esempio, solo un numero limitato di rivascolarizzazioni arteriose). La chirurgia coronarica è in fase di sviluppo e i buoni risultati comprovati (come per la PCI) vengono costantemente migliorati dalle modifiche. Poiché questi cambiamenti sono meno conosciuti, verranno qui descritti alcuni principi di un moderno concetto di chirurgia coronarica.
Scelta del materiale d’innesto
Convenzionalmente, il CABG utilizza l’arteria toracica interna sinistra (IMA) come materiale d’innesto, che è il condotto ideale per bypassare il ramo interventricolare anteriore (RIVA). Inoltre, vengono utilizzati segmenti della vena grande safena per eseguire una rivascolarizzazione completa di altri vasi coronarici interessati. Il bypass IMA sul RIVA è chiaramente superiore ad altri innesti di bypass arterioso e venoso. In confronto, studi più ampi per gli innesti venosi mostrano tassi di apertura significativamente inferiori, pari a circa il 75% dopo dieci anni, mentre i bypass IMA hanno tassi di apertura di >90% per lo stesso periodo di osservazione. Il vantaggio di sopravvivenza del CABG rispetto al trattamento farmacologico e anche al PCI è particolarmente associato all’alto tasso di apertura dell’innesto IMA sulla RIVA.
L’utilizzo di entrambe le arterie mammarie interne (BIMA) mostra un ulteriore vantaggio terapeutico in diversi studi [6]. Va notato, tuttavia, che in presenza di ulteriori fattori di rischio (ad esempio, obesità, diabete mellito, malattie polmonari, immunosoppressione), l’incidenza delle complicanze della ferita sternale dovute a disturbi microcircolatori può essere aumentata. Tuttavia, con un’adeguata selezione dei pazienti e una tecnica di preparazione adattata (la cosiddetta tecnica scheletrica), il numero di complicanze della ferita sternale dovrebbe aumentare solo in modo insignificante.
L’arteria radiale (RA) della mano non dominante viene utilizzata come innesto arterioso alternativo per il bypass in un massimo del 50% dei pazienti. Un prerequisito per l’asportazione è l’esecuzione del test di Allen, in cui è stato dimostrato un arco palmare aperto e un’alimentazione sufficiente della mano solo attraverso l’arteria ulnare. La RA come innesto di bypass ha dimostrato in diversi studi di essere superiore ai bypass venosi, con tassi di apertura più elevati e anche un vantaggio in termini di sopravvivenza. La RA è un’arteria di tipo muscolare e può essere soggetta a vasospasmo. Per questo motivo, la terapia farmacologica con nitrati o calcio antagonisti viene spesso somministrata dopo l’uso di una RA. Tuttavia, gli studi morfologici indicano che questo è necessario solo per il periodo iniziale (settimane) dopo il CABG, poiché dopo l’integrazione nella circolazione coronarica, si verifica un rimodellamento della parete del vaso verso il tipo di arteria elastica [6].
Sebbene la rivascolarizzazione arteriosa pura sia oggi generalmente raccomandata, gli algoritmi per la selezione dell’innesto sono molto più complessi rispetto a 10-15 anni fa, a causa della crescente evidenza di altri fattori che influenzano il tasso di apertura del bypass. (Fig. 1). È stato chiaramente dimostrato che i tassi di apertura del bypass dipendono anche in modo significativo dalle caratteristiche del vaso target coronarico, con il grado di stenosi a monte, le dimensioni e la natura a valle del vaso target e il territorio miocardico corrispondente come fattori importanti. Naturalmente, anche la precisione chirurgica del passaggio dell’anastomosi tra l’innesto di bypass e l’innesto coronarico non deve essere trascurata. Con una stenosi solo marginale dell’arteria coronaria, l’apertura di un bypass è più limitata dal flusso competitivo in RA rispetto all’utilizzo di un innesto venoso – sempre a seconda del territorio di alimentazione del miocardio (cioè se il bypass è verso la RIVA, il ramus circumflexus o l’arteria coronaria destra). Per il bypass IMA-RIVA, la recente analisi di oltre 1500 coronarografie di controllo in uno studio più ampio (PREVENT) mostra che il fallimento dell’innesto (stenosi ≥75% o occlusione) è associato solo a stenosi di grado moderato della RIVA e anche al posizionamento di un innesto venoso su un ramo laterale (ramo diagonale) della RIVA [7].
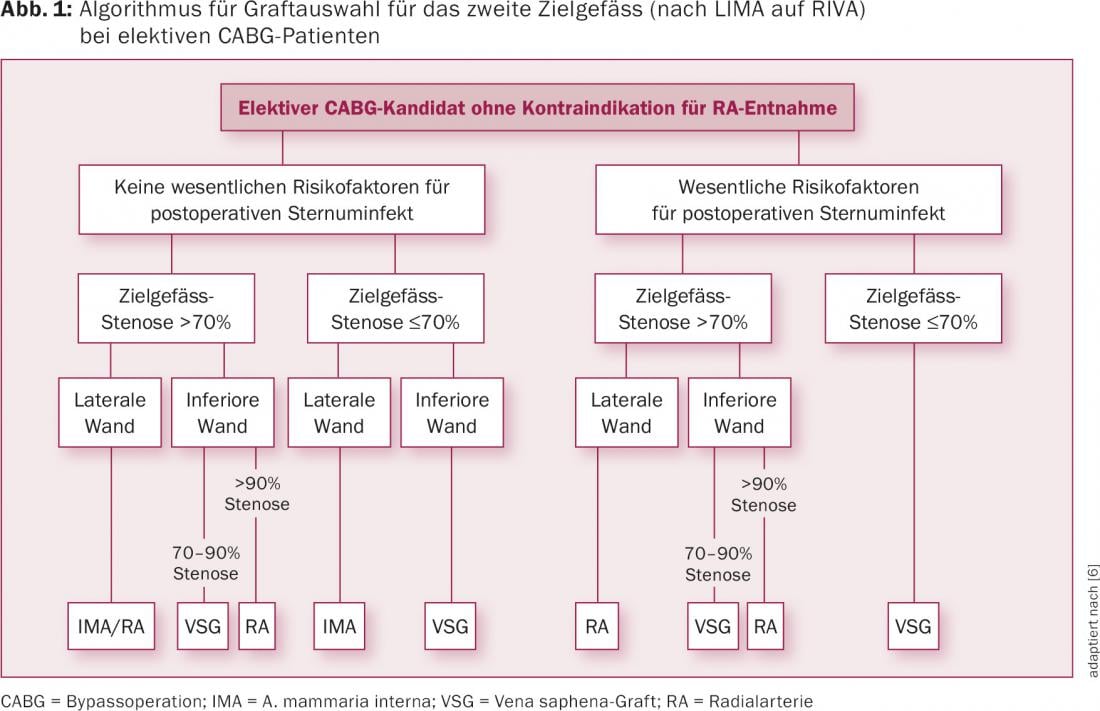
Oggi, la scelta del materiale dell’innesto, così come la decisione di base su quali vasi coronarici debbano essere trattati, è chiaramente individuale ed è meglio farla in una riunione di équipe per la pianificazione chirurgica. I principi approssimativi di “IMA su RIVA, il resto con innesti venosi” e “collegare tutto” non corrispondono più a un concetto moderno e differenziato di chirurgia coronarica. Va notato anche che con i risultati significativamente migliorati della PCI, le procedure di terapia combinata (le cosiddette procedure ibride) sono sempre più utilizzate. Si tratta di una procedura molto utile, ad esempio in caso di re-CABG, dove non è raro decidere di rivascolarizzare i vasi principali più accessibili (RIVA e RCA) con CABG e l’RCX con PCI.
Fuori dal circuito di pompaggio?
Il CABG viene ancora eseguito nella maggior parte dei casi in tutto il mondo con l’uso della macchina cuore-polmone (HLM) in combinazione con l’immobilizzazione (cardioplegia) del cuore. I vantaggi di un cuore immobilizzato e di un campo chirurgico privo di sangue, con la possibilità di un’anastomosi controllata e sicura tra l’innesto di bypass e il vaso coronarico, si scontrano con gli effetti collaterali dell’HLM. Questi includono, ad esempio, le reazioni infiammatorie sistemiche associate alla superficie estranea, l’emodiluizione in corrispondenza dell’HLM e le complicazioni emorragiche dovute alla necessità di anticoagulazione durante la procedura chirurgica – fattori che possono tutti contribuire in modo rilevante alla morbilità e alla mortalità del paziente.
Nelle procedure off-pump, di solito si fa una distinzione tra MIDCAB (“bypass coronarico diretto minimamente invasivo”) per la rivascolarizzazione della sola RIVA mediante accesso attraverso una mini-toracotomia anteriore e OPCAB (“bypass coronarico off-pump”) per la rivascolarizzazione nella malattia coronarica multivessuale, dove l’accesso in questo caso avviene tramite sternotomia mediana come nel CABG convenzionale con HLM. Purtroppo, i benefici clinici sperati con l’introduzione delle procedure off-pump non hanno potuto essere confermati. I dati attuali indicano che, anche nei centri con esperienza in questa opzione chirurgica, non ci sono vantaggi significativi rispetto al CABG convenzionale in termini di infarto miocardico o mortalità [8,9]. Entrambe le procedure ottengono buoni risultati clinici, ma la scelta del metodo di rivascolarizzazione chirurgica viene fatta individualmente e dipende dai fattori del paziente (comorbidità, aspettativa di vita) e dall’esperienza del chirurgo o del paziente. dell’équipe chirurgica [9]. In questo contesto, ha senso ottimizzare ulteriormente il gold standard della terapia (CABG con HLM).
Mini-ECC
Con la modifica della HLM convenzionale alla cosiddetta circolazione extracorporea minimizzata (Mini-ECC o MECC), gli effetti negativi della HLM possono essere ridotti. Grazie a un sistema di bypass chiuso e all’eliminazione del serbatoio venoso, nonché all’integrazione di un sistema di aspirazione a infrarossi o in combinazione con un CellSaver, il MECC ha una superficie estranea significativamente inferiore e un volume di adescamento più basso (600 anziché 1500 ml) con un ematocrito intraoperatorio corrispondentemente più elevato rispetto all’HLM convenzionale. (Figg. 2 e 3). L’attivazione del contatto o del complemento è quindi minore e la reazione infiammatoria asettica, che in singoli casi porta eccessivamente alla sindrome postcardiotomica, è misuratamente ridotta. L’azionamento della pompa centrifuga e il dispositivo di aspirazione modificato comportano complessivamente meno danni ai componenti del sangue. Questa impostazione è completata da una soluzione cardioplegica a basso volume di nuova concezione (Cardioplexol) [10,11].


Con questa impostazione, che utilizziamo all’Inselspital da oltre dodici anni e ora anche alla Hirslanden Klinik Aarau, abbiamo già eseguito più di 4000 CABG. Il tasso di mortalità per gli interventi chirurgici elettivi può quindi essere ridotto a molto meno dell’1%. Nei dati sulla qualità pubblicati dall’Ufficio federale della sanità pubblica e dall’IQM (Initiative for Quality Medicine), il tasso di mortalità per CABG senza infarto miocardico precedente presso l’Inselspital era dello 0,4% nel 2014. Al contrario, il tasso di mortalità è dell’1,8% in media per tutti gli ospedali partecipanti nella regione DACH (Germania, Austria e Svizzera) [12].
Un’altra modifica da considerare in un concetto moderno di chirurgia coronarica è rappresentata dai circuiti HLM rivestiti biocompatibili (rivestimenti di eparina, ecc.). In termini di miglioramento della qualità intraoperatoria, va menzionata anche la misurazione di routine dei flussi di bypass [13]. Inoltre, i concetti di trattamento standardizzati e ottimizzati nel contesto perioperatorio dai colleghi dell’anestesiologia e della medicina intensiva contribuiscono in modo significativo a migliorare il successo del trattamento dopo il CABG.
Letteratura:
- Windecker S, et al: Rivascolarizzazione rispetto al trattamento medico nei pazienti con malattia coronarica stabile: meta-analisi di rete. BMJ 2014; 348: g3859.
- Windecker S, et al: Linee guida ESC/EACTS 2014 sulla rivascolarizzazione miocardica: la Task Force sulla rivascolarizzazione miocardica della Società Europea di Cardiologia (ESC) e dell’Associazione Europea di Chirurgia Cardio-Toracica (EACTS). Eur Heart J 2014; 35(37): 2541-2619.
- Widder JD, Bauersachs J: PCI dopo lo studio SYNTAX. Un motivo per modificare le indicazioni? Cardiovasc 2015; 14(6): 4-8.
- Wichmann C, Eckstein F: Malattia coronarica stabile. Quali sono le indicazioni per l’intervento percutaneo? Cardiovasc 2015; 14(6): 9-12.
- Mohr FW, et al: Intervento chirurgico di bypass aorto-coronarico rispetto all’intervento coronarico percutaneo nei pazienti con malattia a tre vasi e malattia coronarica principale sinistra: follow-up di 5 anni dello studio clinico randomizzato SYNTAX. Lancet 2013; 381(9867): 629-638.
- Gaudino M, et al: La scelta dei condotti nella chirurgia di bypass aorto-coronarico. J Am Coll Cardiol 2015; 66(15): 1729-1737.
- Harskamp RE, et al: Frequenza e predittori del fallimento dell’innesto dell’arteria mammaria interna e dei successivi esiti clinici: Spunti dallo studio PREVENT IV. Circolazione 2016; 133: 131-136.
- Diegeler A, et al: Innesto di bypass aorto-coronarico off-pump rispetto a quello on-pump nei pazienti anziani. N Engl J Med 2013; 368: 1189-1198.
- Deppe AC, et al: Evidenze attuali dell’innesto di bypass aorto-coronarico off-pump rispetto a quello on-pump: una revisione sistematica con meta-analisi di oltre 16.900 pazienti esaminati in studi controllati randomizzati. Eur J Cardiothorac Surg 2015 Aug 13 [Epub ahead of print].
- Jenni H, et al.: Sistema di autotrasfusione o dispositivo di aspirazione automatico integrato nella circolazione extracorporea minimizzata: influenza sulla coagulazione e sulla risposta infiammatoria. Eur J Cardiothorac Surg 2011; 39: e139-143.
- Immer FF, et al: La circolazione extracorporea minima è una tecnica promettente per l’innesto di bypass coronarico. Ann Thorac Surg 2007 Nov; 84(5): 1515-1520.
- IQM: Risultati di qualità dell’Ospedale Universitario Inselspital di Berna. http://www.initiative-qualitaetsmedizin.de/qr/applet/d6b545dfe651a105ca48c5972168bfca33f04e9a/
- Lehnert P, et al: La misurazione del flusso transitorio come predittore del fallimento dell’innesto di bypass coronarico a un anno di follow-up angiografico. J Card Surg 2015; 30: 47-52.
CARDIOVASC 2016; 15(1): 8-12










