La polineuropatia diabetica (dPNP) è la neuropatia più comune nei Paesi occidentali. Ma chi li riceve e come si riconoscono? Questa domanda è particolarmente importante perché ancora il 40% dei pazienti con dPNP dolorosa non viene trattato. Le possibilità di diagnosi e terapia sono state il tema del Congresso tedesco sul dolore.
La dPNP somatosensoriale si sviluppa quasi sempre in parallelo alla retinopatia o alla nefropatia. Pertanto, bisogna sempre tenere d’occhio gli occhi e i reni durante la diagnostica, ha spiegato il Prof. Dr. Frank Birklein della Clinica e del Policlinico di Neurologia dell’Ospedale Universitario di Mainz (D) a titolo di introduzione. L’unica eccezione è la neuropatia a piccole fibre (SFN), che può precedere il diabete. Il 50% dei diabetici sviluppa PNP elettrofisiologico e nel 16% di questi pazienti il PNP è doloroso. Un quarto di tutti i diabetici ha una PNP clinica. Il 40% delle dPNP dolorose non sono trattate.
Dal punto di vista fisiopatologico, nella dPNP si verificano cambiamenti nel metabolismo, soprattutto nel metabolismo del diabete. Importante è il percorso dei polioli e i prodotti finali della glicazione avanzata (AGE), che si accumulano e danneggiano i neuroni e soprattutto gli assoni. Inoltre, si verificano cambiamenti nei canali ionici, soprattutto quelli del potassio e del sodio, e compaiono difetti mitocondriali, che alla fine portano i neuroni a ricevere troppa poca energia. Non bisogna dimenticare che si verificano anche cambiamenti strutturali, soprattutto nei vasi. Dal punto di vista vascolare, questo è caratterizzato dal fatto che le vene e le arterie sono morfologicamente poco evidenti nelle neuropatie di controllo, mentre nei diabetici l’arteria è ridotta di dimensioni e si “arrotola”, cioè c’è un’arteriolopatia, le vene sono parzialmente congestionate. Un nervo diabetico, in definitiva, ha troppo poco ossigeno ed è ipossico.
Diagnostica
Il primo passo nella diagnosi dovrebbe essere la misurazione delle velocità di conduzione nervosa (NLG) – effettuata da soli o da un collega neurologo di fiducia, come dice il Prof. Birklein: “Ritengo sempre i valori normali da uno studio, quelli patologici, invece, non sono sempre corretti, perché il paziente non è stato riscaldato correttamente, per esempio. Le estremità fredde provocano un rallentamento della velocità di conduzione nervosa”. Il programma di misurazione NLG comprende due nervi, motorio e sensibile, nell’arto superiore. Il Prof. Birklein raccomanda almeno l’ulnare, poiché il mediano è spesso affetto da sindrome del tunnel carpale (CTS) e si possono verificare diagnosi errate se non se ne è consapevoli. “E i pazienti diabetici hanno molto spesso la STC”. Nelle estremità inferiori, due nervi motori (tibiale, peroneo) e il surale devono essere trattati in modo sensibile. L’esperto ha ricordato alla platea che la velocità di conduzione nervosa di un paziente diabetico difficilmente cambia nell’arco di un periodo fino a cinque anni e di solito rimane a un livello costante e ridotto. La situazione è diversa per le ampiezze dei potenziali d’azione della somma motoria, che possono essere stimolati, ad esempio, quando si misura il peroneo. qui diventa sempre meno nel corso di 2 anni. Ciò significa che gli assoni si rompono durante la dPNP. “Non si tratta di una neuronopatia, ma di un’assonopatia da morte”, ha spiegato il neurologo. Le fibre nervose più lunghe vengono colpite per prime e gli assoni muoiono. Di conseguenza, l’ampiezza diventa sempre più piccola.
Se l’NLG è normale, il paziente non ha la PNP. Di norma, anche i risultati neurologici sono normali, ma la persona colpita continua a provare un dolore bruciante (sfPNP nella fase iniziale). In questo caso, è sufficiente determinare le soglie di freddo e di caldo secondo il protocollo QST* per diagnosticare la sfPNP. Il medico esaminerà la perdita della sensazione di freddo e di caldo. Il freddo corrisponde a una funzione delta, quindi i nocicettori a conduzione rapida appartengono alla stessa classe di fibre, mentre il caldo corrisponde alla classe C, quindi ai nocicettori a conduzione lenta. La soglia del freddo delle persone sane al piede inizia a 32°C – una riduzione di 4°C viene percepita da un soggetto sano, nei pazienti questo avviene solo a partire da 12°C. Alla soglia del caldo, cioè misurata a partire da 32°C dopo temperature più calde, le persone sane hanno bisogno di circa 6°C di differenza al piede per sentire qualcosa, i pazienti con PNP o diabete di conseguenza di più. Anche questo dato rimane costante su due anni, con un leggero aumento.
(* Test sensoriale quantitativo)
Se la misurazione delle soglie del caldo e del freddo non è d’aiuto, lo standard nella diagnosi di sfPNP è la biopsia cutanea, offerta da molti laboratori di neuropatologia.
Prevenzione
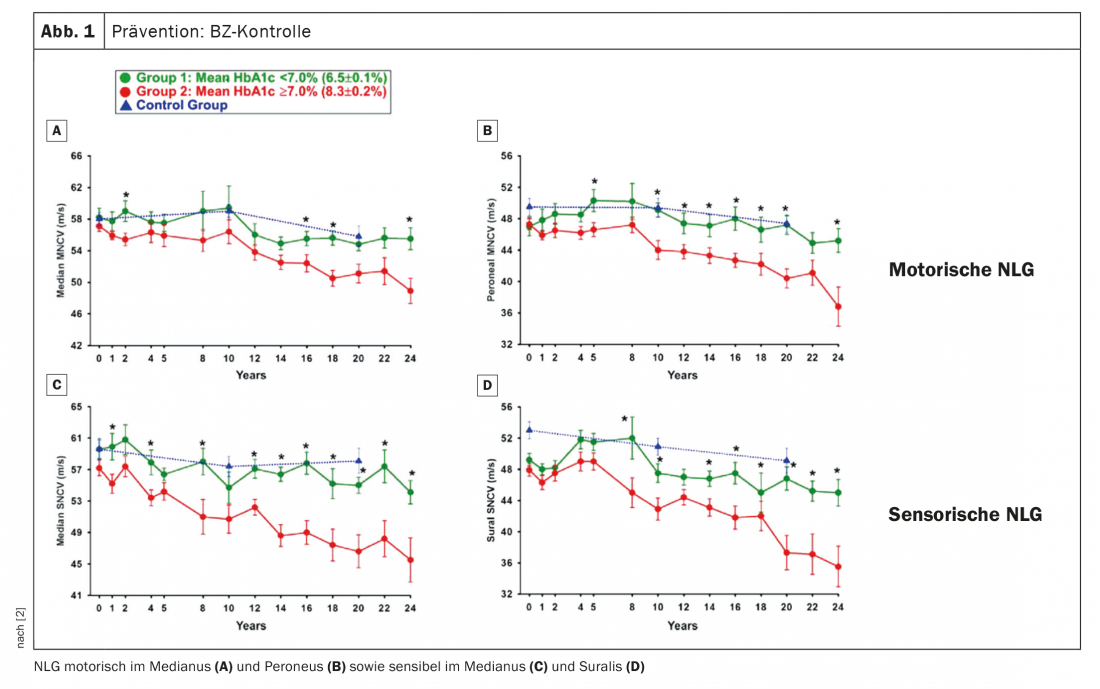
Come si può prevenire l’insorgenza o la progressione della dPNP? Prima di tutto, ovviamente, il controllo della glicemia (BG) è ovvio per questo. Il Prof. Birklein ha fatto riferimento a un lavoro in cui sono state misurate le velocità di conduzione nervosa per oltre 20 anni (Fig. 1). Si può notare che l’NLG dei controlli sani diminuisce leggermente in un periodo di due decenni, ma questo è abbastanza normale. I pazienti con un’HbA1c ≥7, cioè con un setting BG convenzionale, sono stati confrontati con i pazienti con un setting BG intensificato. Quello che si vede è che i pazienti con un controllo intensificato della glicemia nel diabete di tipo 1 hanno un decorso che è previsto anche nelle persone sane. “Se il diabete è ben controllato, non si avrà la PNP per molti anni”, è stata la conclusione dell’esperto. D’altra parte, se la regolazione è peggiore, si sviluppa il PNP. Conclusione: il controllo della glicemia è essenziale, soprattutto per i giovani che sviluppano il diabete. Si raccomanda anche di intensificare il reclutamento, non da ultimo per questo motivo.
Con il diabete di tipo 2, la situazione è un po’ diversa. In questo caso, sono soprattutto i fattori di rischio cardiovascolare a dover essere presi in considerazione: Ipertensione, fumo, BMI, trigliceridi e, naturalmente, HbA1c. “Le persone non pensano ai fattori cardiovascolari nella PNP, ma pensano ai cambiamenti vascolari nel nervo periferico”, ha avvertito il Prof. Birklein.
Il 15% dei pazienti con dPNP ha dolore
Ma perché il 15% dei pazienti con dPNP ha dolore? Prima di tutto, non bisogna dimenticare una cosa, dice l’esperto: Non tutti i pazienti che hanno il diabete e un dPNP devono avere anche un dolore neuropatico. I pazienti con diabete e neuropatia avanzata possono anche sviluppare gonartrosi o sinovite, ad esempio, che sono responsabili del dolore. Queste possibilità devono essere sempre tenute presenti.
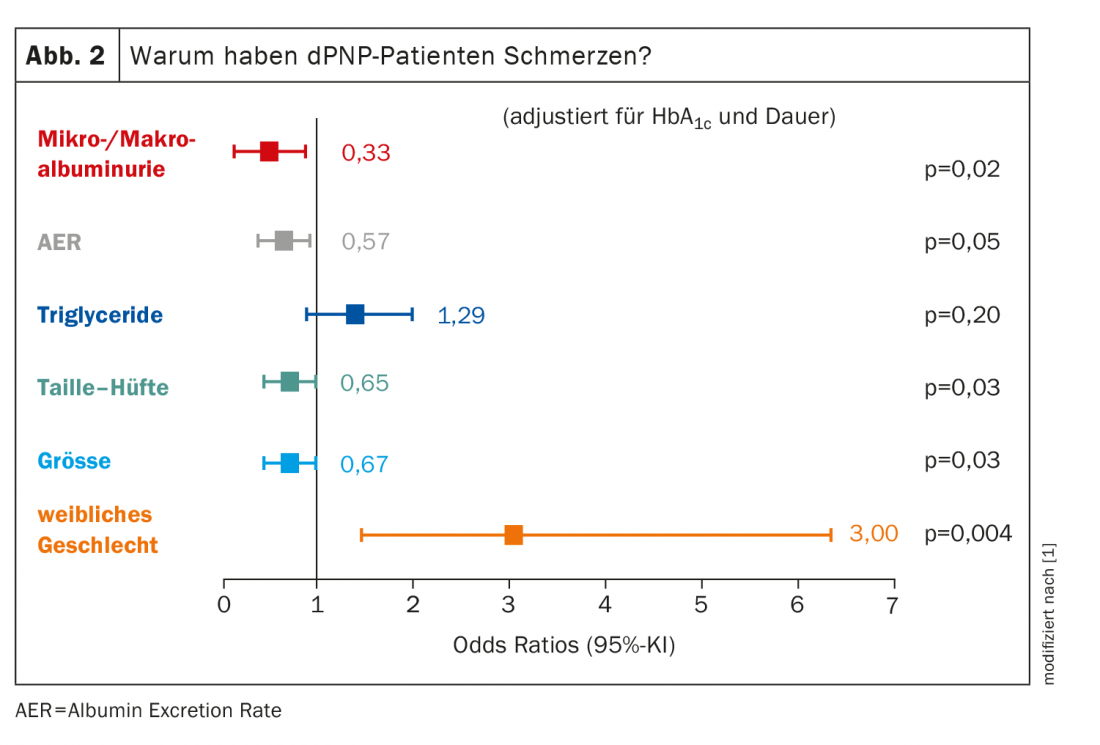
Per quanto riguarda il gruppo di pazienti con dPNP dolorosa, la cui causa è in realtà una polineuropatia, sono soprattutto le donne a esserne colpite: Il sesso femminile ha un rapporto di probabilità di 3,00 per il PNP doloroso. Tutti gli altri fattori incidono in misura significativamente minore (Fig. 2). Le dimensioni del corpo giocano un ruolo, il che può sembrare sorprendente all’inizio. Ma: più lunghi sono gli assoni, più è probabile che si verifichi un danno. “Dobbiamo sempre ricordare che il metabolismo dell’intero assone viene effettuato nel neurone – più precisamente nel ganglio della radice posteriore, per quanto riguarda le fibre del dolore – e deve essere trasportato fino alle terminazioni nervose. E più sono grandi, più è probabile che qualcosa vada storto lungo il percorso”. Più assoni sono danneggiati, più dolorosa è la dPNP.
Quindi, da dove viene il dolore neuropatico? Quando si verifica un danno all’assone, il neurone diventa elettricamente instabile e spontaneamente attivo, ha spiegato il medico del dolore. Questo avviene attraverso i canali del sodio (Na+). Se i canali del sodio vengono bloccati, un neurone danneggiato che è stato assotomizzato torna ad essere completamente silenzioso. L’attivazione dei canali del sodio funziona probabilmente attraverso il metilgliossale. Il glucosio viene convertito in metilgliossale nel plasma. La gliossalasi – un enzima che è il passo limitante in questo caso – fa sì che il metilgliossale venga convertito in lattato. Se la gliossalasi non funziona bene, alla fine si accumula metilgliossale. Le misurazioni del metilgliossale nel plasma hanno dimostrato che i pazienti con diabete senza dolore hanno una quantità maggiore di metilgliossale – perché naturalmente hanno anche più glucosio rispetto alle persone sane. Tuttavia, i pazienti con dolore hanno una quantità significativamente maggiore di metilgliossale nel sangue rispetto ai pazienti non doloranti.
Terapia di dPNP
Per quanto riguarda il trattamento dei pazienti con polineuropatia diabetica, il Prof. Birklein ha elencato una serie di opzioni farmacologiche che sono considerate agenti di prima scelta:
- Anticonvulsivanti (bloccanti dei canali Ca – gabapentin, pregabalin)
- Antidepressivi triciclici
- Inibitori della ricaptazione della serotonina-norepinefrina (SSNRI) (duloxetina)
- Cerotto alla capsaicina
- Cerotto di lidocaina
Secondo l’attuale linea guida S2, in casi individuali si possono prendere in considerazione anche carbamazepina, oxcarbazepina, lamotrigina, venlafaxina e cannabinoidi. Il Prof. Birklein non è molto convinto delle opzioni di gesso, “si dovrebbe ingessare metà della gamba di alcuni pazienti, e questo non è molto bello”. Come alternativa, ha ricordato alle persone le opzioni non farmacologiche – sapendo bene che molti malati alla fine preferiscono prendere pillole piuttosto che fare esercizio. Se né i farmaci né l’esercizio fisico portano al successo desiderato, c’è anche l’elettrostimolazione del midollo spinale (SCS), che ha funzionato bene negli studi con i pazienti affetti da PNP.
– Congresso tedesco sul dolore 2020, Mannheim (D) e online
Fonti:
- Polineuropatia diabetica: dal banco al letto del paziente. Nuovi dati sulla fisiopatologia, la diagnostica e la terapia. Congresso tedesco sul dolore Mannheim, 22.10.2020
- Ziegler D, et al: BMJ Open 2015; 5: e006559; doi: 10.1136/bmjopen-2014-006559
InFo PAIN & GERIATURE 2020; 2(2): 24-25 (pubblicato il 9.12.20, prima della stampa).