Il trattamento interventistico del rigurgito mitralico è diventato sempre più importante negli ultimi anni, con importanti progressi nella tecnologia dei cateteri e nella diagnostica per immagini che ci permettono di trattare pazienti che fino a poco tempo fa non avevano opzioni per una terapia mirata del rigurgito mitralico. Questi progressi continueranno nel prossimo futuro, con una varietà di nuovi approcci e tecniche interventistiche attualmente in fase di sperimentazione preclinica. Questo articolo si propone di fornire una panoramica sullo stato attuale del trattamento con catetere del rigurgito mitralico e di fornire una prospettiva sugli sviluppi attuali e sulle possibilità future.
L’insufficienza della valvola mitrale è, insieme alla stenosi della valvola aortica, la condizione valvolare più comune nella pratica clinica. La prevalenza della malattia aumenta con l’età del paziente, dallo 0,5% nel gruppo sotto i 45 anni a oltre il 9% nei pazienti sopra i 75 anni. Le due forme di rigurgito mitralico, quella primaria e quella secondaria, hanno pato-meccanismi fondamentalmente diversi, il che si riflette nella comorbilità e nel profilo di rischio dei gruppi di pazienti, da un lato, e ha un’influenza decisiva sulle ulteriori decisioni terapeutiche, dall’altro. Il rigurgito mitralico primario o strutturale è caratterizzato da un difetto nell’apparato valvolare, cioè i lembi della valvola o le corde, con conseguente chiusura incompleta della valvola in sistole. Le cause principali sono processi degenerativi, post-infiammatori, post-reumatici o idiopatici che modificano direttamente la struttura della valvola e quindi portano, ad esempio, al prolasso di un lembo valvolare o alla rottura di un filo tendineo. Il rigurgito mitralico secondario o funzionale è dovuto a cambiamenti geometrici nell’apparato di ritenzione della valvola e nell’anulus della valvola in presenza di dilatazione ventricolare sinistra o disfunzione della pompa. La malattia miocardica sottostante causa la dilatazione dell’anulus e lo spostamento dei muscoli papillari, rendendo impossibile la chiusura completa della valvola. La valvola mitrale stessa è strutturalmente poco appariscente. La causa è solitamente una cardiomiopatia ischemica o dilatativa e i pazienti sono caratterizzati da un profilo di comorbilità marcato, con la presenza di altre patologie cardiache come l’insufficienza cardiaca sinistra, l’insufficienza cardiaca destra, l’ipertensione polmonare, la malattia coronarica e le aritmie atriali e ventricolari. I pazienti con difetti valvolari secondari presentano quindi in genere un quadro clinico generale molto più complesso rispetto ai pazienti con difetti valvolari mitralici primari.
Approcci terapeutici
Il trattamento standard per il rigurgito primario della valvola mitrale è la riparazione chirurgica della valvola mitrale, data l’operabilità, che è indicata nei pazienti sintomatici e in quelli asintomatici con ridotta funzione di pompa del ventricolo sinistro [1]. Rispetto alla terapia farmacologica conservativa, questa può migliorare non solo i sintomi, ma anche la prognosi dei pazienti con un difetto primario. Tuttavia, in caso di funzione della pompa gravemente ridotta e di presenza di comorbidità rilevanti o di età del paziente molto elevata, i rischi per l’intervento chirurgico aumentano, tanto che nella pratica clinica circa il 50% di tutti i pazienti con insufficienza della valvola mitrale sintomatica non viene operato [2]. Nei pazienti con insufficienza secondaria, che, come descritto, hanno generalmente un rischio chirurgico elevato a priori, questa percentuale è significativamente più alta e si aggira intorno al 90%. Queste cifre riflettono in definitiva anche le raccomandazioni delle linee guida [1], che, in caso di rigurgito mitralico secondario, considerano l’intervento chirurgico nell’area della valvola mitrale come indicato solo se la rivascolarizzazione chirurgica è contemporaneamente necessaria in caso di malattia coronarica esistente, a causa dei rischi chirurgici. Poiché la patologia principale di questi pazienti è localizzata nell’area del miocardio, ha senso concentrarsi sul sollievo del miocardio o sul ripristino della gittata cardiaca attraverso una terapia farmacologica ottimale, integrata – se indicato – dalla terapia di risincronizzazione cardiaca o dall’uso del supporto circolatorio meccanico, fino al trapianto di cuore.
Tuttavia, molti pazienti non possono usufruire di queste opzioni aggiuntive nella vita quotidiana, per cui il concetto terapeutico consiste solitamente nel controllo dei sintomi con i farmaci. La presenza di rigurgito della valvola mitrale è un fattore predittivo indipendente di morbilità e mortalità per i pazienti con difetti valvolari sia primari che secondari, per cui gli approcci terapeutici mirati sono importanti e necessari anche a questo proposito.
C’è quindi la necessità di metodi delicati e poco invasivi per trattare il rigurgito mitralico, giustificando il crescente utilizzo di tecniche basate su cateteri e stimolando la ricerca e lo sviluppo in questo settore.
MitraClip
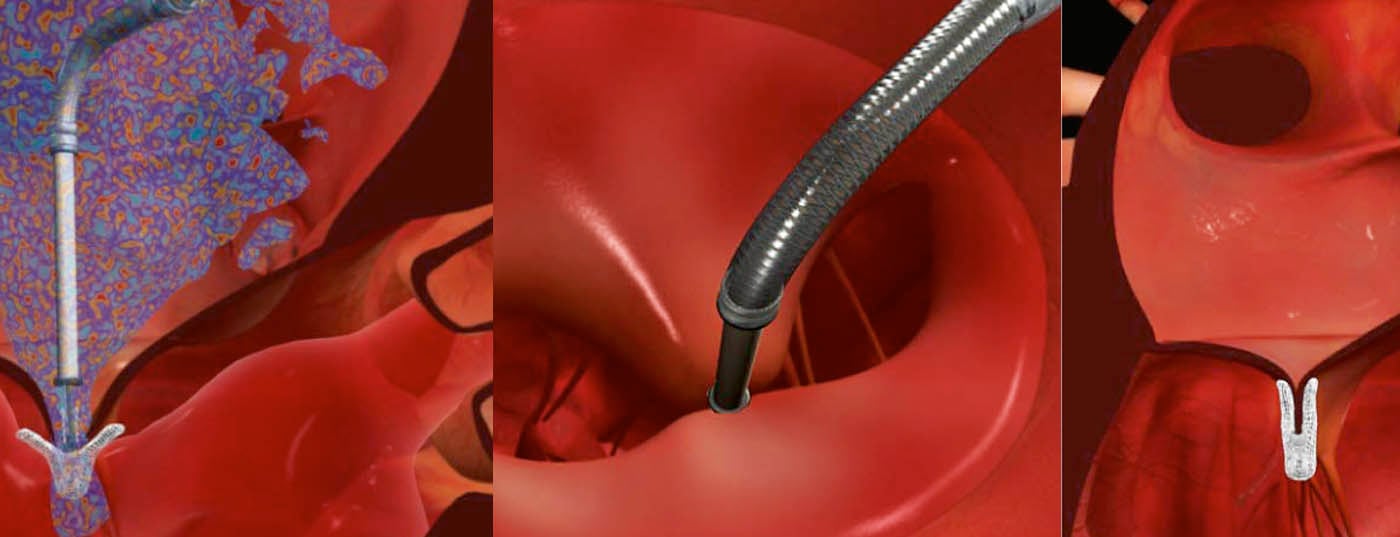
Dal suo lancio sul mercato nel 2008, la procedura MitraClip (Fig. 1) è una tecnica interventistica per il trattamento del rigurgito primario e secondario della valvola mitrale che sta diventando sempre più diffusa.

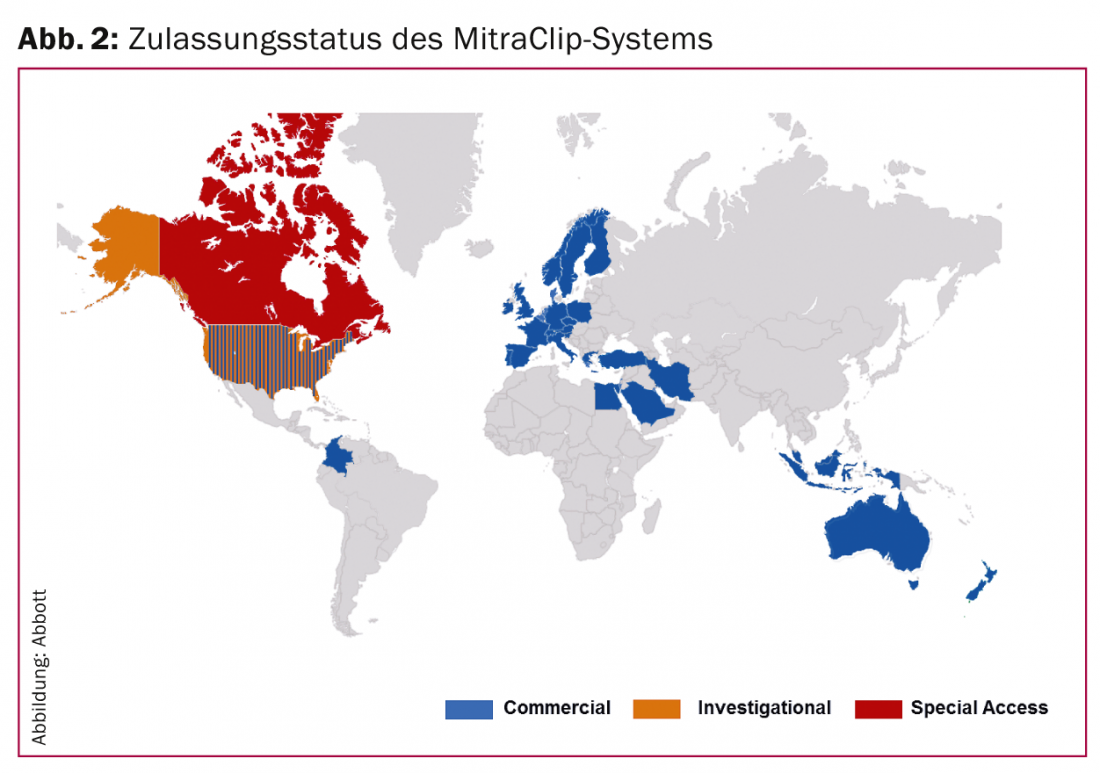
Alla fine di gennaio 2014, oltre 12.000 pazienti erano stati trattati con questa tecnica in più di 300 centri in tutto il mondo (Fig. 2) .
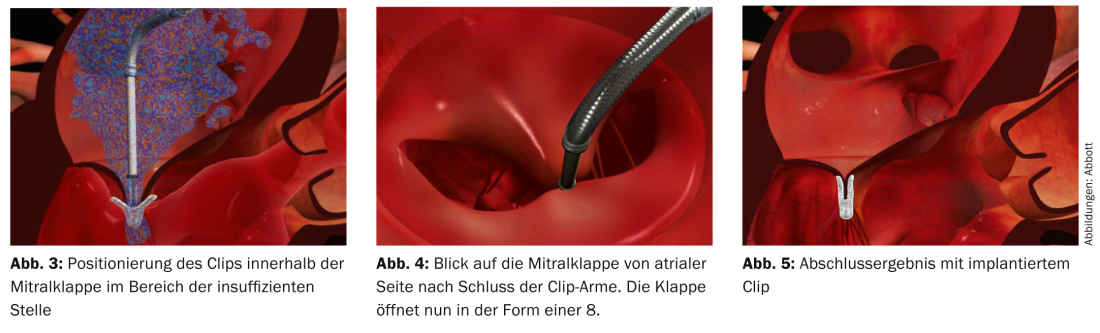
La clip viene avanzata attraverso la vena femorale e dopo la puntura trans-settale fino alla valvola mitrale e viene posizionata con guida ecografica nell’area dell’insufficienza (Fig. 3-5). I foglietti mitralici anteriori e posteriori sono quindi collegati in modo permanente in questo punto, il che consente di ripristinare la chiusura completa della valvola.
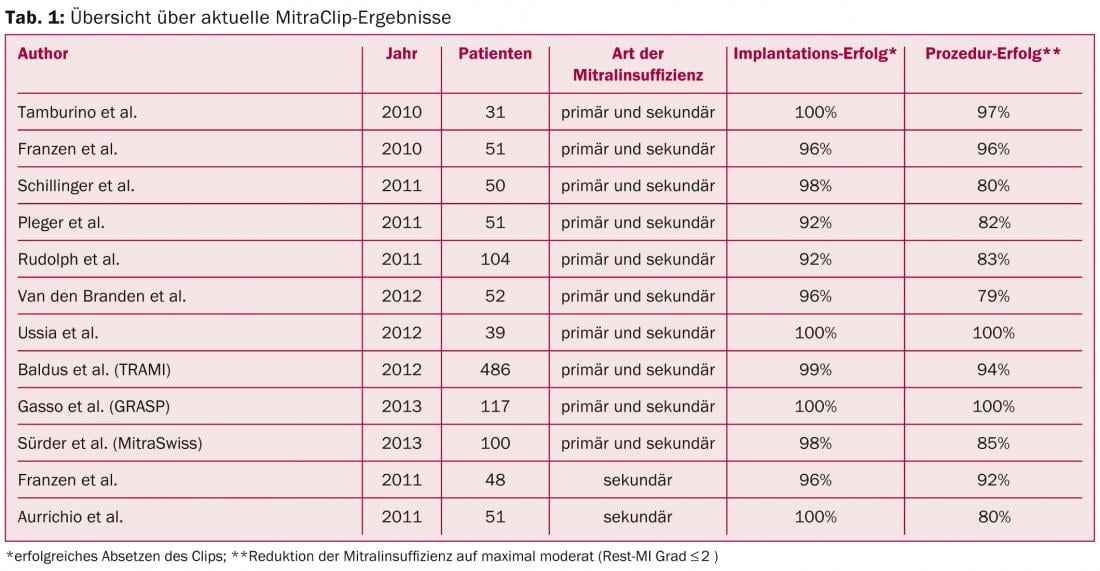
Lo studio EVEREST II, pubblicato nel 2011, ha analizzato la sicurezza e l’efficacia di questa tecnica in un confronto randomizzato con la terapia chirurgica standard in una popolazione di pazienti operabili, compresi i difetti primari e secondari [3]. Lo studio ha dimostrato che la procedura della clip consente una riduzione significativa dell’insufficienza. L’entità assoluta della riduzione non è così elevata come con l’intervento chirurgico, ma i pazienti hanno tratto gli stessi benefici clinici, senza alcuna differenza significativa tra i due bracci di trattamento. Questi risultati sono stati confermati anche nel decorso a lungo termine, come dimostrano i dati a 4 anni pubblicati di recente in questo studio [4]. Questi risultati positivi si riflettono anche in altre esperienze pubblicate, come il registro europeo post-approvazione ACCESS, il registro svizzero MitraSwiss, il registro tedesco TRAMI o il registro italiano GRASP, con tassi di successo dell’impianto del 95 – 100% e una riduzione del rigurgito mitralico a un massimo di lieve o moderato nell’80 – 100% dei casi (Tab. 1).
In particolare, i gruppi clinici ad alto rischio, come i pazienti con insufficienza cardiaca grave, i non rispondenti alla CRT e i pazienti non operabili con difetto valvolare primario, possono beneficiare della procedura in presenza di un grave rigurgito mitralico sintomatico. Soprattutto per i pazienti con insufficienza cardiaca con concomitante rigurgito mitralico, è disponibile una nuova alternativa terapeutica, che può essere utilizzata per alleviare i sintomi e potenzialmente avere un effetto prognostico. Questo è l’obiettivo di due studi randomizzati in corso, lo studio europeo RESHAPE e lo studio americano COAPT, che confrontano MitraClip più terapia farmacologica ottimale rispetto alla sola terapia farmacologica in questo gruppo di pazienti con un disegno simile, con l’endpoint della mortalità e della riospedalizzazione dopo dodici mesi. Tuttavia, diverse pubblicazioni di studi più piccoli a braccio singolo suggeriscono già che l’impianto di una MitraClip può portare a un miglioramento sintomatico in questi pazienti.
Nel 2012, sulla base di questi dati positivi, la procedura MitraClip è stata inclusa nelle Linee Guida Europee sulla Cardiopatia Valvolare e nelle Linee Guida Europee sulla Terapia dello Scompenso Cardiaco [1, 5], con una raccomandazione per l’uso nei pazienti chirurgici ad alto rischio. Con la tecnica MitraClip, oggi disponiamo di un modo sicuro e semplice per ridurre in modo affidabile il rigurgito mitralico sintomatico nei pazienti chirurgici ad alto rischio, che è associato a un miglioramento clinico in oltre l’80% dei pazienti.
Una limitazione di questa terapia è l’attuale mancanza di dati a lungo termine. L’esperienza precedente con la tecnica chirurgica del punto Alfieri, che viene imitata a livello interventistico dalla procedura MitraClip, mostra una recidiva dell’insufficienza nel tempo in una percentuale rilevante di pazienti (ad esempio a causa della progressione della dilatazione dell’anulus e dello spostamento del muscolo papillare), per cui questa tecnica non svolge un ruolo significativo nella pratica chirurgica quotidiana. Un altro fattore ancora da osservare è la persistenza immediata post-intervento di un moderato rigurgito mitralico dopo MitraClip in circa un terzo dei pazienti. Sebbene sia possibile ottenere una riduzione di almeno un grado di gravità in quasi tutti i pazienti, sono necessari ulteriori studi per determinare in che misura un’insufficienza residua moderata influisca sul decorso a lungo termine e se, o in quali pazienti, una riduzione completa dell’insufficienza non debba essere l’obiettivo terapeutico. Entrambe le limitazioni menzionate dimostrano che, nonostante i buoni e promettenti risultati nel decorso acuto e a medio termine, c’è ancora bisogno di ulteriori ricerche prima di proporre questa tecnica, ad esempio, ai pazienti con un rischio chirurgico inferiore. Inoltre, questo crea spazio per concetti alternativi come l’annuloplastica valvolare percutanea e la sostituzione valvolare percutanea.
Annuloplastica interventistica della valvola mitrale
L’annuloplastica mitralica chirurgica, cioè la cucitura di un anello semiaperto o completo nell’anulus mitralico per ripristinare la chiusura della valvola riducendo l’area dell’anulus, è il trattamento chirurgico standard per i pazienti con rigurgito mitralico. Diversi approcci interventistici cercano di imitare questo concetto in modo minimamente invasivo con un catetere. Qui si fa una distinzione di base tra due opzioni, l’annuloplastica indiretta e diretta con catetere.
Nelle procedure indirette, l’obiettivo della tecnica non è l’anulus mitralico, ma le strutture vicine, come il seno coronarico, che è facilmente accessibile con mezzi interventistici. Lo svantaggio di queste procedure, di cui solo il sistema Carillon ha ottenuto l’approvazione clinica fino ad oggi, è da un lato il rischio di occlusione coronarica, poiché in alcuni casi le arterie coronarie si incrociano sotto il seno coronarico, e dall’altro la non infrequente mancanza di un decorso anatomico anulus-parallelo del seno coronarico. I sistemi inseriti in questo punto esercitano quindi solo un’influenza limitata sulla valvola mitrale e possono addirittura avere effetti potenzialmente dannosi.
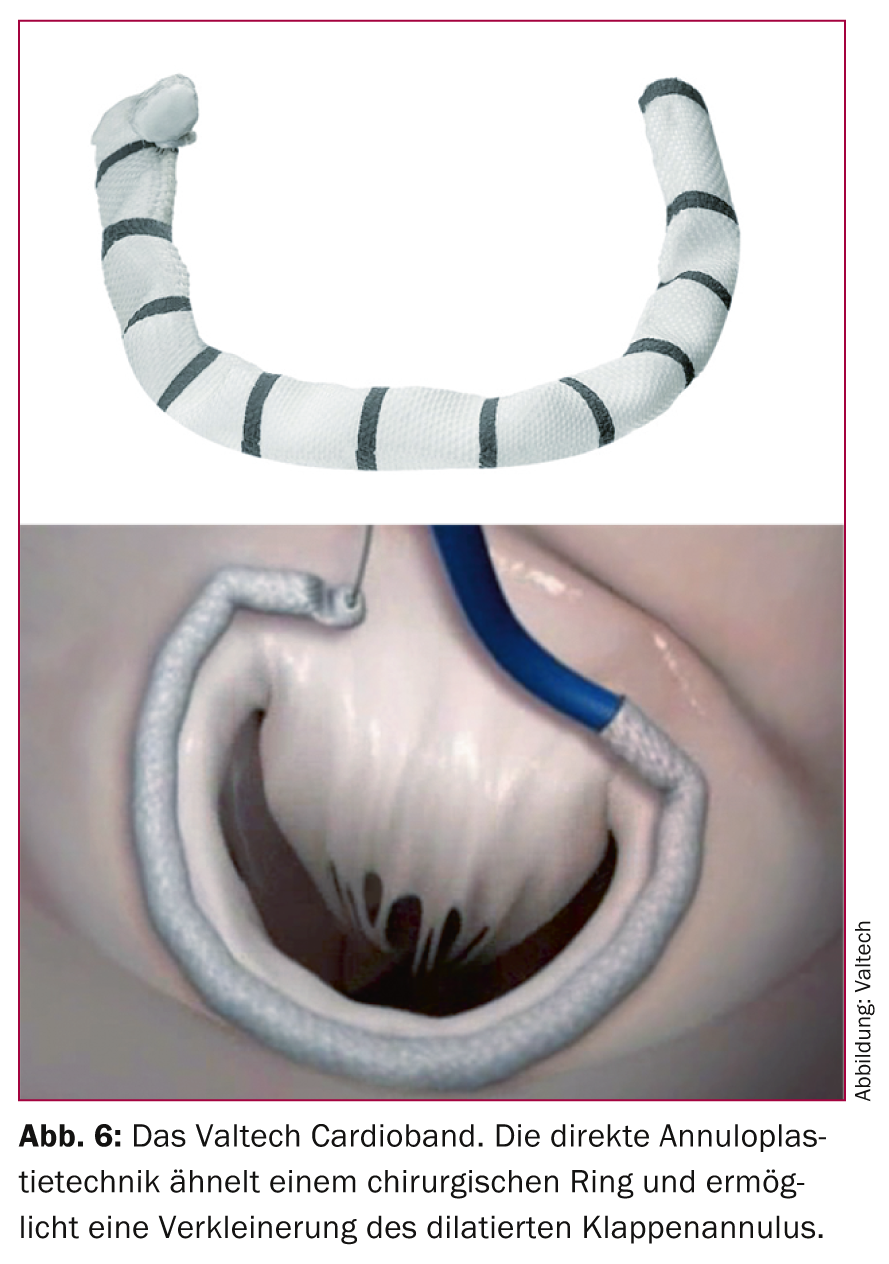
Più promettenti, tuttavia, sono le tecniche di annuloplastica mitralica diretta, che mirano direttamente all’anulus mitralico. Attualmente sono in corso di valutazione clinica diversi sistemi, tra cui il sistema Mitralign, la procedura Guided Delivery Systems (GDS) e il Valtech Cardioband. In particolare, il Valtech Cardio Band (Fig. 6), che come la MitraClip può essere impiantato attraverso un accesso venoso femorale, si avvicina molto all’impianto di un anello chirurgico. Finora, al momento in cui scriviamo, un totale di 15 pazienti sono stati trattati con questa tecnica in quattro centri europei, con una riduzione dell’insufficienza di successo in 14 casi. Per valutare il potenziale di questi approcci, occorre vedere i risultati degli studi attualmente in corso. Tuttavia, la vicinanza concettuale al gold standard chirurgico è certamente un vantaggio rilevante che distingue queste procedure.
Sostituzione interventistica della valvola mitrale
A differenza della sostituzione percutanea della valvola aortica, lo sviluppo della sostituzione della valvola mitrale tramite catetere è ancora agli inizi. A causa della complessità anatomica dell’apparato valvolare mitralico, l’ancoraggio e la sigillatura delle protesi valvolari impiantate pongono in particolare un problema tecnico. Inoltre, la ricostruzione chirurgica della valvola mitrale ha tassi di sopravvivenza significativamente migliori rispetto alla sostituzione chirurgica della valvola, soprattutto nei pazienti con difetti valvolari primari, motivo per cui la ricostruzione è favorita anche nelle linee guida. Concettualmente, questo è fondamentalmente uno svantaggio per lo sviluppo di tecniche di sostituzione mitralica interventistica. Tuttavia, soprattutto nell’area delle insufficienze secondarie, la differenza tra le due procedure non è molto pronunciata, in particolare quando si utilizzano le moderne tecniche di sostituzione. Insieme ai limiti delle tecniche mitraliche interventistiche esistenti, questo è il razionale per lo sviluppo di procedure di sostituzione percutanea. Il sistema CardiaQ è stato utilizzato per la prima volta nel 2012 per l’impianto percutaneo di una protesi della valvola mitrale per trattare una valvola mitrale nativa insufficiente. Diverse aziende stanno attualmente perseguendo questo concetto e si prevede l’avvio di diversi studi first-in-man nel corso dell’anno. È certamente troppo presto per valutare queste tecniche nel dettaglio. Potenzialmente, però, questa classe di tecniche interventistiche avrà un ruolo anche nei pazienti ad alto rischio per la chirurgia tradizionale, ai quali non può essere offerta una tecnica ricostruttiva interventistica con una qualche promessa di successo.
Conclusioni
Le tecniche interventistiche per il trattamento del rigurgito della valvola mitrale stanno diventando sempre più importanti. Il sistema MitraClip consente di ridurre in modo sicuro il rigurgito mitralico nei pazienti con rigurgito primario e secondario che non sono adatti all’intervento chirurgico a causa del loro profilo di rischio. In particolare, i pazienti con insufficienza cardiaca hanno a disposizione un’opzione nuova e meno invasiva, che amplia in modo significativo lo spettro terapeutico esistente di farmaci ottimali, terapia di risincronizzazione cardiaca, uso di sistemi di supporto meccanico e trapianto di cuore in casi selezionati. Nuove tecniche interventistiche, come l’annuloplastica diretta della valvola e la sostituzione percutanea della valvola mitrale, si affermeranno nei prossimi anni e contribuiranno a risolvere i limiti delle attuali procedure interventistiche.
Letteratura:
- Vahanian A, et al: Task Force congiunta sulla gestione della cardiopatia valvolare della Società Europea di Cardiologia (ESC); Associazione Europea di Chirurgia Cardio-Toracica (EACTS): Linee guida sulla gestione della cardiopatia valvolare (versione 2012). Eur Heart J 2012 Oct; 33(19): 2451-2496.
- Mirabel M, et al: Quali sono le caratteristiche dei pazienti con rigurgito mitralico grave, sintomatico, a cui viene negato l’intervento chirurgico? Eur Heart J 2007 Jun; 28(11): 1358-1365.
- Feldman T, et al: EVEREST II Investigators: riparazione percutanea o chirurgia per il rigurgito mitralico. N Engl J Med 2011 Apr 14; 364(15): 1395-1406.
- Mauri L, et al: EVEREST II Investigators: risultati a 4 anni di uno studio randomizzato controllato sulla riparazione percutanea rispetto alla chirurgia per il rigurgito mitralico. J Am Coll Cardiol 2013 Jul 23; 62(4): 317-328.
- McMurray JJ, et al: Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology, Bax JJ, et al: ESC Committee for Practice Guidelines: ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Sviluppato in collaborazione con la Heart Failure Association (HFA) dell’ESC. Eur J Heart Fail 2012 Aug; 14(8): 803-869.
CARDIOVASC 2014; 13(2): 25-30