Un livello di glucosio nel sangue non adeguatamente regolato può provocare disturbi del sistema nervoso somatico e/o autonomo – e più rapidamente di quanto si pensi!
I disturbi del sistema nervoso somatico e/o autonomo sono una conseguenza frequente dei livelli di glucosio nel sangue non adeguatamente controllati. È stato possibile dimostrare una correlazione diretta tra il livello di glucosio nel sangue, la durata dell’iperglicemia e lo sviluppo della neuropatia. Pertanto, può verificarsi anche in tutte le forme di diabete mellito. A causa del metabolismo disturbato nella cellula nervosa, i prodotti metabolici glicati vengono immagazzinati nel tessuto nervoso. I cambiamenti microvascolari nei capillari nervosi, con la chiusura del lume e l’ispessimento delle pareti dei vasi, comportano una mancanza di ossigeno, per cui si verifica una graduale perdita di funzionalità. Quando viene diagnosticato il diabete di tipo 2, i danni ai nervi periferici sono già presenti nel 12% delle persone affette. L’incidenza aumenta linearmente nel tempo e ha una media del 30%.
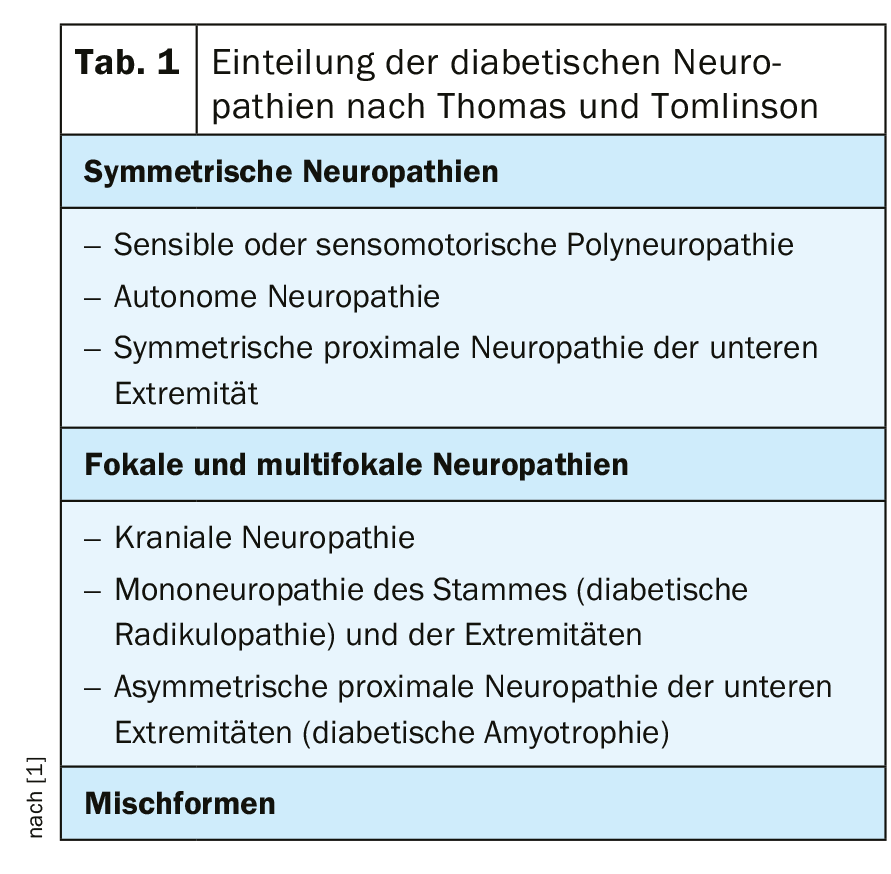
Le neuropatie diabetiche possono essere suddivise in neuropatie diabetiche sensomotorie e autonomiche. La loro manifestazione è classificata in base a criteri clinici (Tab. 1) [1].
La neuropatia diabetica più comune è la polineuropatia simmetrica distale cronica (DSPN), che rappresenta circa il 30% [1]. È definita come la presenza di sintomi e/o segni di disfunzione dei nervi periferici nelle persone con diabete, dopo aver escluso altre cause. Il rischio aumenta con l’aumento di altri fattori di rischio, indicatori e comorbidità (riquadro). Tuttavia, fino alla metà di tutte le malattie possono essere asintomatiche, che spesso non vengono riconosciute e aumentano il rischio di ulcere, per esempio. Tuttavia, anche la qualità della vita può essere gravemente compromessa dal dolore neuropatico. Questo accade fino al 25% di tutte le persone colpite. Si distinguono quattro manifestazioni cliniche:
- Neuropatia subclinica (asintomatica): nessun disturbo o reperto clinico, i test neurofisiologici quantitativi (vibratometria, termoestesia quantitativa, elettroneurografia) sono patologici.
- Neuropatia dolorosa cronica (comune): Sintomi dolorosi a riposo (simmetrici e in aumento di notte): Dolore bruciante, lancinante o trafittivo, parestesia, disestesia, intorpidimento, formicolio sgradevole, disturbi del sonno; perdita di sensibilità di qualità variabile, riduzione dei riflessi muscolari su entrambi i lati.
- Neuropatia dolorosa acuta (rara): Il dolore simmetrico agli arti inferiori e possibilmente anche al tronco sono in primo piano; eventualmente iperestesia aggiuntiva; disturbi sensoriali agli arti inferiori o risultati di esami neurologici normali; può essere associato all’inizio o all’intensificazione della terapia insulinica (“neurite da insulina”).
- Neuropatia indolore (comune): Assenza di sintomi o intorpidimento e/o parestesia; sensibilità ridotta o assente, riflessi muscolari assenti (soprattutto il riflesso del tendine d’Achille), instabilità dell’andatura, lesioni o ulcere non notate.

Diagnosi precoce della polineuropatia
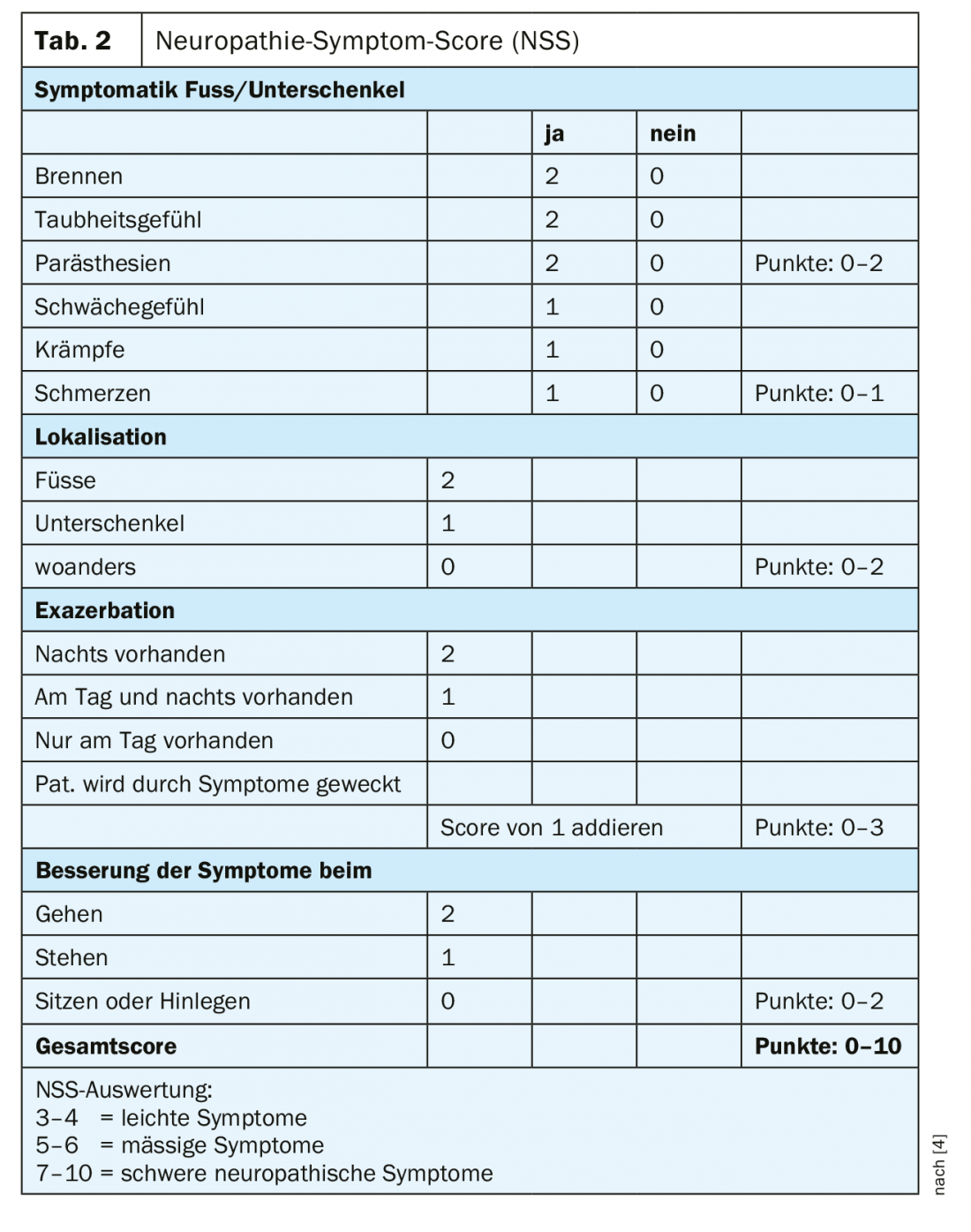
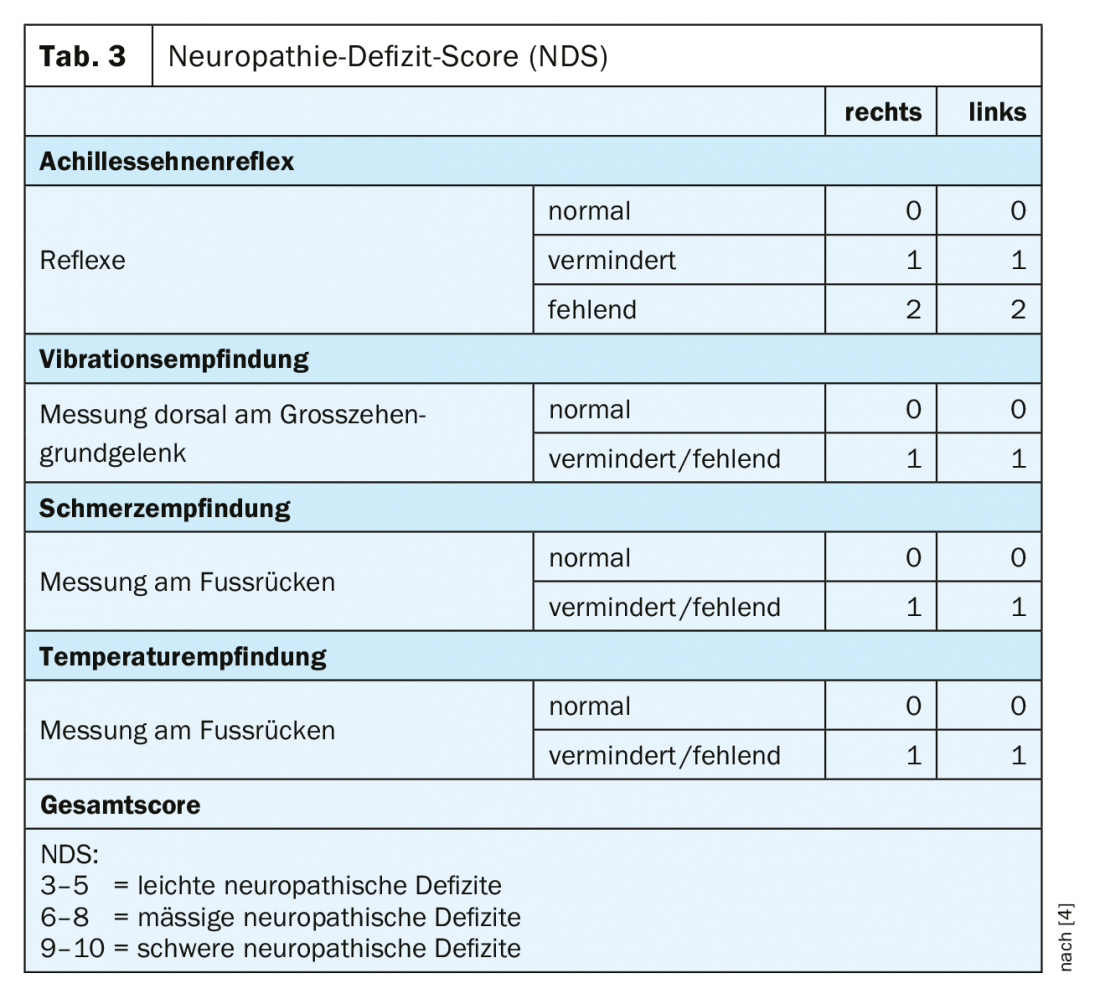
In pratica, la polineuropatia diabetica viene riconosciuta troppo tardi. Anche nelle forme dolorose, quasi il 60% delle persone colpite ritiene di non soffrire di un disturbo del sistema nervoso [3]. Questo rende la diagnosi precoce ancora più importante. Lo screening della polineuropatia diabetica sensomotoria deve includere un’anamnesi con dati personali di base, informazioni specifiche sul diabete e la registrazione dei fattori di rischio, oltre ai sintomi neuropatici plus e minus. Inoltre, devono essere eseguiti un’ispezione e un esame clinico, uno screening delle complicazioni del piede e della malattia arteriosa periferica, nonché semplici esami neurologici. Il Neuropathy Symptom Score (NSS) può essere utilizzato per la diagnosi clinica di base (Tabella 2) [4]. Per valutare la gravità della neuropatia, si può utilizzare il Neuropathy Deficit Score (NDS) (Tabella 3) [4]. Un esame in merito a una possibile neuropatia dovrebbe essere effettuato nei pazienti con diabete di tipo 2 al momento della diagnosi e ripetuto annualmente in seguito, nei pazienti con diabete di tipo 1 al più tardi cinque anni dopo la diagnosi.
Uno studio delle fibre nervose intraepidermiche nei pazienti con diabete di tipo 2 ha dimostrato che la polineuropatia non è affatto solo una malattia concomitante delle ultime fasi della malattia [5,6]. Si è potuto dimostrare che – nonostante un buon controllo del glucosio nel sangue con un valore medio di Hba1c di 6,5 – una diminuzione delle fibre nervose intraepidermiche di circa il 20% si è verificata già molto presto. Uno sviluppo simile si osserva nelle fibre nervose della cornea. Già nel primo anno, sia la lunghezza delle fibre che la densità delle fibre nervose diminuiscono [7]. La microscopia corneale confocale (CCM) può essere utilizzata per rilevare facilmente questi sviluppi.
Tuttavia, non tutte le polineuropatie associate al diabete mellito devono essere necessariamente polineuropatie diabetiche. Pertanto, per la diagnosi differenziale si raccomanda un programma minimo di medicina interna con i parametri di laboratorio emocromo, creatinina, VES, TSH, vitamina B12, acido folico, alanina aminotransferasi (ALAT), gamma-GT e immunoelettroforesi (paraproteinemia). Se non c’è alcuna indicazione di valori patologici, è necessario consultare un neurologo per chiarimenti.
È sempre necessario consultare un neurologo se si verificano uno o più risultati [1]:
- Predominanza di deficit motori piuttosto che sensoriali,
- rapido sviluppo e progressione dei sintomi,
- Grave asimmetria dei deficit neurologici, mononeuropatia e disturbo dei nervi cranici,
- Progressione dei sintomi nonostante l’ottimizzazione della situazione metabolica,
- Insorgenza dei sintomi negli arti superiori,
- Evidenza di altri sintomi neurologici oltre alla sindrome polineuropatica diabetica,
- Storia familiare di neuropatia.
Regime di trattamento a tre colonne
La terapia della neuropatia diabetica si basa essenzialmente su tre pilastri. L’attenzione si concentra sul controllo ottimale del diabete, che comprende l’adeguamento dello stile di vita e l’intervento multifattoriale. La terapia patogenetica è più efficace nella DSPN asintomatica o non dolorosa. La gestione sintomatica del dolore può migliorare significativamente la qualità di vita delle persone con DSPN dolorosa. La terapia combinata di duloxetina e pregabalin è utile in questo caso (fig. 1).
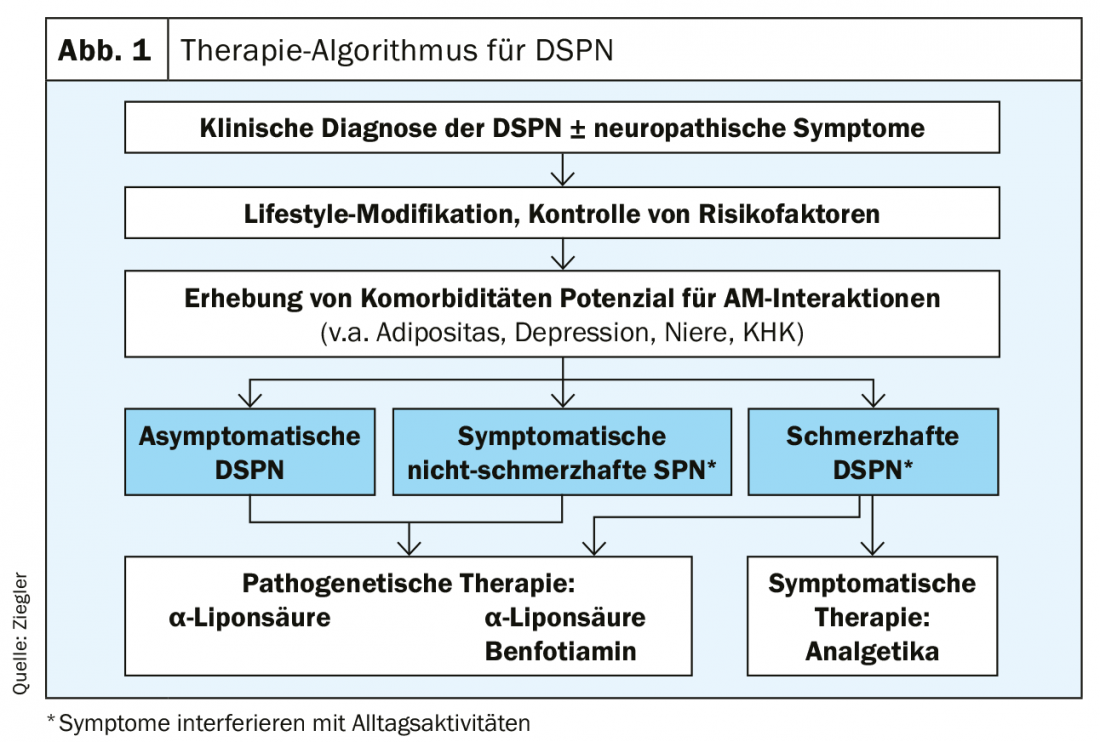
Se la glicemia viene abbassata troppo rapidamente e in modo troppo significativo all’inizio nei diabetici di nuova diagnosi, può verificarsi una neuropatia indotta dalla terapia (TIND) [8]. Soprattutto se il livello di HbA1c viene abbassato oltre il 7%, la neuropatia dolorosa acuta può manifestarsi dopo settimane o mesi. Questo regredisce dopo circa un anno, ma richiede un trattamento intensivo con analgesici. Il rischio può essere ridotto in modo significativo abbassando il livello di HbA1c di una media di due o tre punti in tre mesi.
Per intervenire in modo specifico sulle vie metaboliche del danno microvascolare indotto dall’iperglicemia, si possono utilizzare l’acido α-lipoico, la benfotiamina e l’actovegina. Per l’acido α-lipoico, la dose deve essere di 600 mg per ottenere un buon effetto [9]. Questo può essere dimostrato in un periodo di quattro anni [10]. Anche la benfotiamina 600 mg ha un effetto benefico sui sintomi della neuropatia [11]. Dopo sei settimane, l’NSS è migliorato in modo significativo.
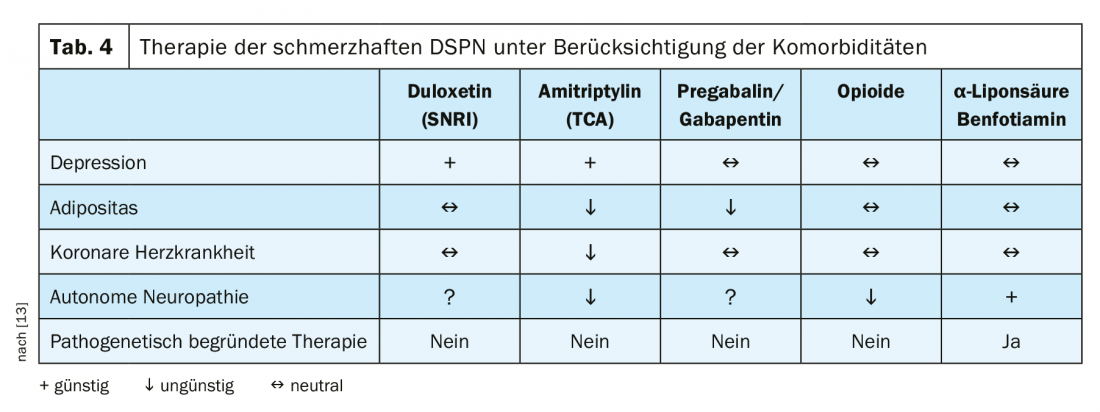
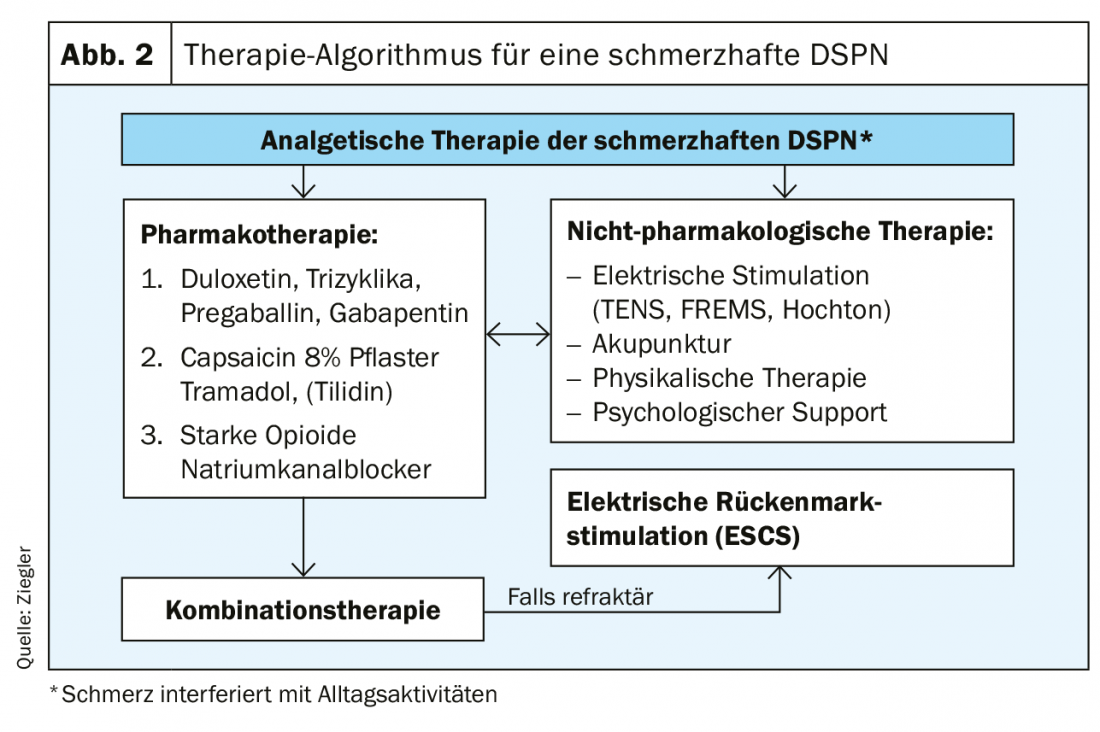
Altrimenti, la terapia può essere costruita principalmente in modo sintomatico. Questi includono la registrazione del dolore, dell’umore, della funzionalità e del sonno. Poiché il dolore è soggettivo, per la valutazione si deve utilizzare una scala numerica di valutazione del dolore (NRS). Per quanto riguarda le prove per le terapie del dolore, è stata riscontrata una forza di prova moderata per gli SNRI. Gli anticonvulsivi, gli antidepressivi triciclici, gli oppioidi atipici, l’acido alfa lipoico e la stimolazione elettrica del midollo spinale mostrano una bassa evidenza [12]. Inoltre, la terapia deve tenere conto delle comorbidità. Pertanto, un cuore pre-danneggiato è una controindicazione per gli inibitori della ricaptazione delle monoamine non selettivi (Tab. 4) [13]. L’algoritmo terapeutico mostrato nella Figura 2 illustra ancora una volta chiaramente tutte le fasi della terapia analgesica per la DSPN dolorosa.
Messaggi da portare a casa
- La neuropatia diabetica si verifica spesso come conseguenza del diabete. Contrariamente alla credenza popolare secondo cui si manifesta solo come conseguenza tardiva, in un periodo di tempo più lungo, una diminuzione delle fibre nervose può essere osservata già nel primo anno dopo la diagnosi.
- La polineuropatia cronica simmetrica distale è la forma più comune di neuropatia diabetica (DSPN) e può essere suddivisa in DSPN sintomatica non dolorosa, DSPN dolorosa e DSPN asintomatica.
- La terapia dipende dalla gravità e dalle possibili comorbidità. Una buona gestione della malattia di base è obbligatoria. Inoltre, esiste un trattamento patogenetico e sintomatico.
- Oltre agli SNRI, per la terapia farmacologica del dolore nella DSPN sono disponibili anticonvulsivanti, antidepressivi triciclici, cerotti alla capsaicina e oppioidi.
Letteratura:
- Neuropatia NVL nel diabete in età adulta. www.awmf.org/uploads/tx_szleitlinien/nvl-001e_k_S3_Diabetes_Neuropathie_2016-08.pdf (ultimo accesso il 12.06.2019)
- Pop-Busui R, et al: Neuropatia diabetica: una presa di posizione dell’American Diabetes Association. Diabetes Care 2017; 40: 136-154.
- Ziegler D, et al: Le neuropatie dolorose e indolori sono entità distinte e in gran parte non diagnosticate nei soggetti che partecipano a un’iniziativa educativa (studio PROTECT). Diabetes Res Clin Pract 2018; 139: 147-154.
- Ziegler D et al: Neuropatia diabetica. Diabetologia, 2018; 13: 230-243.
- Strom A, et al: Riduzione pronunciata della densità delle cellule di Langerhans cutanee nel diabete di tipo 2 diagnosticato di recente. Diabete 2014; 63: 1148 1153.
- Ziegler D, et al.: Sovraespressione della superossido dismutasi mitocondriale cutanea nel diabete di tipo 2 di recente insorgenza. Diabetologia 2015; 58: 1621-1625.
- Ziegler D, et al.: Rilevamento precoce della perdita di fibre nervose mediante microscopia confocale corneale e biopsia cutanea nel diabete di tipo 2 di recente diagnosi. Diabete 2014; 63: 2454-2463.
- Gibbons CH, Freeman R: Neuropatia del diabete indotta dal trattamento: una complicanza acuta e iatrogena del diabete. Brain 2015; 138: 43-52.
- Amato Nesbit S, et al: Trattamenti non farmacologici per i sintomi della neuropatia periferica diabetica: una revisione sistematica. Curr Med Res Opin 2018; 17: 1-11.
- Ziegler D, et al.: Efficacia e sicurezza del trattamento antiossidante con l’acido α-lipoico per 4 anni nella polineuropatia diabetica: lo studio NATHAN 1. Diabetes Care 2011; 34: 2054-2060.
- Stracke H, et al: Benfotiamina nella polineuropatia diabetica (BENDIP): risultati di uno studio clinico randomizzato, in doppio cieco, controllato con placebo. Exp Clin Endocrinol Diabetes 2008; 116: 600-605.
- AHRO: Prevenire le complicazioni e trattare i sintomi della neuropatia periferica diabetica. Rivista sull’efficacia comparativa, numero 187, 2017.
- Ziegler D: Polineuropatia diabetica dolorosa. Neurologia 2012; 31: 140-146.
PRATICA GP 2019; 14(7): 8-11
CARDIOVASC 2019; 18(5): 16-19