Una sintesi della situazione attuale della farmacogenetica in psichiatria – con consigli pratici per la sua applicazione, dato che dall’inizio del 2017 è entrata in vigore una revisione della lista di analisi. In determinate condizioni, ciò consente il rimborso dei test farmacogenetici.
La farmacogenetica in psichiatria potrebbe presto festeggiare il suo 50° compleanno. Gli autori scandinavi avevano già scoperto nel 1969 che dopo il trattamento con nortriptilina, i livelli plasmatici di questo antidepressivo triciclico noradrenergico erano molto simili all’interno di coppie di gemelli monozigoti ma non dizigoti, il che portò alla conclusione che la variabilità dei livelli plasmatici aveva un background genetico [1]. Allo stesso tempo, questo lavoro ha anche già evidenziato la presenza di interazioni farmacocinetiche che devono essere definite fattori ambientali, in quanto la somiglianza delle concentrazioni di nortriptilink all’interno delle coppie non è stata osservata nei gemelli monozigoti trattati con altri farmaci.

Il passo successivo e importante, nel 1977, è stata la descrizione di diversi fenotipi, ossia i metabolizzatori “efficienti” (EM) o “normali” e i “non metabolizzatori” (n.m., oggi chiamati “poveri metabolizzatori”, PM) del farmaco antipertensivo debrisochina [2]. Si è sospettata una carenza genetica di debrisochina idrossilasi, che ora è nota come enzima geneticamente polimorfico citocromo P-450 2D6, o CYP2D6, nei PM sulla base dei dati farmacocinetici. Utilizzando le moderne tecniche di analisi del DNA, nel 1988 è stata ottenuta la presentazione dei genotipi, ovvero la prima prova biologica molecolare di un polimorfismo genetico, utilizzando il CYP2D6 come esempio [3]. Nel 1981, sono stati misurati livelli plasmatici eccezionalmente elevati di nortriptilina in un paziente trattato con nortriptilina che era PM nel test farmacogenetico debrisoquin. Inoltre, il paziente ha sofferto di gravi effetti collaterali nonostante la dose abituale (75 mg/giorno). L’abbassamento della dose a 25 mg/die ha portato a un miglioramento clinico e alla risoluzione degli effetti collaterali [4]. Questo caso storico è considerato la prima descrizione psicofarmacogenetica, clinicamente rilevante. Da allora, numerosi studi hanno sostenuto l’ipotesi che, oltre ai fattori ambientali e a quelli legati al paziente come persona, anche i fattori genetici sono responsabili delle differenze interindividuali nella farmacocinetica e nella farmacodinamica degli psicofarmaci (Fig. 1) [5]. In particolare, sono state identificate numerose varianti genetiche negli enzimi coinvolti nel metabolismo di questi farmaci e la loro influenza sull’attività enzimatica è stata caratterizzata [6,7]. Grazie alla collaborazione tra il mondo accademico e l’industria nel campo della farmacogenomica-farmacogenetica, esistono già biomarcatori genetici adatti all’implementazione della terapia personalizzata nella pratica [7,8].
Questo documento riassume la situazione attuale della farmacogenetica in psichiatria. Contiene consigli pratici per la loro applicazione, dato che la farmacogenomica in Svizzera ha recentemente subito un’importante innovazione: Il 1 gennaio 2017 è entrata in vigore una revisione dell’elenco delle analisi, che consente di rimborsare i test farmacogenetici dall’assicurazione di base a determinate condizioni.
Importanza generale della farmacogenomica farmacogenetica
Si è sviluppata una disciplina chiamata farmacogenomica che studia l’effetto delle differenze genetiche interindividuali sulla farmacocinetica, sugli effetti terapeutici e sugli effetti collaterali dei farmaci [9]. La farmacogenomica e la farmacogenetica sono spesso usate come sinonimi. I biomarcatori farmacogenetici consentono di stimare la risposta terapeutica a un farmaco o la sua tossicità in un singolo paziente. Si tratta spesso di varianti genetiche di enzimi del metabolismo dei farmaci o di proteine di trasporto, di recettori responsabili dell’effetto dei farmaci, ma anche del complesso maggiore di istocompatibilità (antigeni leucocitari umani, HLA; vedere l’esempio seguente carbamazepina).
Nella pratica clinica, i seguenti ruoli sono attribuiti ai test farmacogenetici [10]:
- Evitare i sovradosaggi che portano a reazioni avverse ai farmaci.
- Evitare le sottodosi che portano a un effetto terapeutico insufficiente.
- Evitare l’uso di farmaci in pazienti ipersensibili e a rischio.
- Miglioramento della diagnosi differenziale, ad esempio per stabilire la causalità di una reazione avversa ai farmaci.

L’obiettivo generale è quello di utilizzare le conoscenze acquisite dalla farmacogenomica farmacogenetica per adattare le terapie farmacologiche al profilo genetico del singolo paziente. Altri autori parlano di “farmacoterapia stratificata” [11]. Per dare un contributo significativo alla loro attuazione, ma anche per promuovere la ricerca, è stato recentemente fondato il gruppo svizzero “Farmacogenomica e Terapia Personalizzata”, come sezione della Società Svizzera di Farmacologia Clinica e Tossicologia (SGKPT). (Riquadro “Gruppo svizzero di farmacogenomica e terapia personalizzata”). Va specificato che la farmacogenetica non studia solitamente i geni che sono responsabili dello sviluppo delle malattie. [12]. La farmacogenomica studia le varianti geniche che influenzano le aree della farmacocinetica e della farmacodinamica di un farmaco. I bersagli dei farmaci sono, ad esempio, i recettori o le proteine di trasporto dei neurotrasmettitori. A seconda della variante genetica presente, i farmaci interagiscono in modo diverso in termini farmacologici. I farmaci possono quindi differire interindividualmente nella loro farmacodinamica a causa dei diversi profili genetici dei pazienti trattati. A questo proposito, esistono numerosi studi sull’importanza delle varianti genetiche delle proteine trasportatrici di neurotrasmettitori (ad esempio, il trasportatore 5-HT) e delle proteine recettoriali (ad esempio, il recettore della dopamina) per l’effetto clinico degli psicofarmaci [13,14]. Tuttavia, la genotipizzazione in quest’area non è attualmente raccomandata nella pratica quotidiana a causa delle prove insufficienti [15].
La situazione è diversa nell’area della farmacocinetica-farmacogenomica, dove è già in atto una timida implementazione. Molti autori e comitati raccomandano la genotipizzazione degli enzimi di metabolizzazione dei farmaci e, più recentemente, delle proteine di trasporto dei farmaci nella pratica clinica. Le quattro fasi del destino di un farmaco nell’organismo sono assorbimento, distribuzione, metabolismo ed eliminazione (“ADME”). In passato, si presumeva che i farmaci venissero distribuiti nell’organismo attraverso la semplice diffusione. Nel frattempo, però, sono state caratterizzate proteine di trasporto che accelerano il passaggio di sostanze attive attraverso le barriere cellulari e di membrana, ad esempio dall’intestino al sangue e attraverso la barriera emato-encefalica. Anche l’assorbimento nel fegato, dove avviene gran parte del metabolismo dei farmaci, è mediato da proteine di trasporto. Queste includono la P-glicoproteina (PgP), che, tra l’altro, agisce come trasportatore di efflusso per garantire che i farmaci e altri xenobiotici, nella misura in cui sono substrati della PgP, vengano rapidamente rimossi dal SNC e quindi non possano raggiungere concentrazioni intracerebrali rilevanti. Il gene ABCB1, che codifica per la proteina PgP, presenta numerose varianti genetiche. Come risultato di questo polimorfismo genetico, ci sono individui in cui la funzione della PgP come proteina di trasporto per alcuni substrati viene esercitata solo in misura limitata o non viene esercitata affatto, influenzando così la loro farmacocinetica e il loro effetto clinico [16].
Come accennato all’inizio, anche il sistema enzimatico del citocromo P-450 svolge un ruolo importante nel metabolismo dei farmaci. Diverse forme come CYP2B6, CYP2C9, CYP2C19 e CYP2D6 presentano un polimorfismo genetico. Si fa una distinzione approssimativa tra PM con nessuna copia genica attiva, EM con due copie geniche attive – oggi sono definiti “metabolizzatori normali” [17] – metabolizzatori intermedi (IM) con, ad esempio, una sola copia genica attiva e metabolizzatori ultra-rapidi (UM) con più di due copie geniche attive come conseguenza della moltiplicazione genica. A seconda dello stato metabolico geneticamente determinato, vengono misurati livelli plasmatici di farmaci estremamente elevati (in PM), “normali” (in EM, IM) o estremamente bassi (in UM). C’è quindi un aumento del rischio di reazioni avverse ai farmaci (nel PM) o di mancata risposta (nell’UM) ai farmaci alle dosi abituali [18]. Per i farmaci che vengono convertiti da una forma inattiva all’agente attivo da un enzima con un polimorfismo genetico, i gruppi di rischio sono invertiti (mancata risposta in PM; rischio di effetti collaterali in UM). Ad esempio, il substrato CYP2D6 codeina è un precursore (un “prodrug”) della morfina: nell’UM, il rischio di intossicazione da morfina dopo la somministrazione di codeina è aumentato [19].
Fonti di informazione per le raccomandazioni e le linee guida
Il medico curante basa la sua strategia terapeutica, tra l’altro, sulle informazioni accessibili nel “ Riassunto delle caratteristiche del prodotto “ (SPC). Contiene informazioni sul metabolismo, la farmacocinetica e i meccanismi d’azione dei farmaci. Per diversi farmaci, ora ci sono anche prove dell’influenza delle varianti farmacogenetiche. Nonostante le raccomandazioni della letteratura scientifica, l’esecuzione di test farmacogenetici è molto raramente raccomandata esplicitamente nelle informazioni sui farmaci. Le coppie farmaco/gene carbamazepina/HLA-A*31:01 e carbamazepina/HLA-B*15:02 rappresentano un’eccezione (nello spettro farmacodinamico). Nei portatori degli alleli HLA-A*31:01 o HLA-B*15:02, il rischio di gravi effetti collaterali dermatologici è significativamente aumentato rispetto ai non portatori. Nei pazienti per i quali è prevista la terapia con carbamazepina, si dovrebbe quindi effettuare la genotipizzazione per ridurre il rischio di sindrome di Stevens-Johnson, tra l’altro. Tuttavia, la frequenza di queste varianti di rischio differisce nei diversi gruppi etnici, motivo per cui, ad esempio, solo la genotipizzazione di HLA-A*31:01 è raccomandata per gli individui di origine europea, come descritto in dettaglio nella sezione “Carbamazepina” [20]. La variante HLA-B*15:02 , invece, è comune solo in alcune popolazioni asiatiche e la genotipizzazione è raccomandata solo nei pazienti di origine asiatica.
Un’altra eccezione riguarda una genotipizzazione farmacocinetica-farmacogenetica, ovvero la coppia CYP2D6/Atomoxetina, un farmaco prescritto per il trattamento dell’ADHD (“Disturbo da deficit di attenzione e iperattività”), che è un substrato dell’enzima. Le “Informazioni sul farmaco” specificano: “Circa il 7% di tutti i caucasici ha un genotipo corrispondente a un enzima CYP2D6 difettoso (il cosiddetto CYP2D6 “poor metaboliser”). I pazienti con questo genotipo hanno un’esposizione molto più elevata all’atomoxetina rispetto ai pazienti con un enzima funzionante. I cattivi metabolizzatori hanno quindi un rischio maggiore di effetti collaterali. Per i pazienti con un genotipo noto di “povero metabolizzatore”, si deve prendere in considerazione una dose iniziale più bassa e una titolazione più lenta”. Nonostante queste raccomandazioni di azione, la genotipizzazione ovvia prima di iniziare la terapia non è esplicitamente raccomandata nelle informazioni sul farmaco. D’altra parte, i dati farmacocinetici per lo stesso farmaco permettono di ipotizzare che il rischio di mancanza di effetto (non risposta) all’atomoxetina sia elevato nei pazienti UM (CYP2D6). [21].
Per altri farmaci, come l’aripiprazolo, le informazioni sul farmaco menzionano che questo antipsicotico è metabolizzato dal CYP2D6 e quindi la sua biotrasformazione è fortemente ridotta nella PM, ma non ci sono informazioni o azioni raccomandate su un possibile beneficio della genotipizzazione. Tuttavia, diversi gruppi di autori e organizzazioni hanno nel frattempo pubblicato delle linee guida con raccomandazioni che aiutano il medico curante nell’interpretazione dei risultati dei test farmacogenetici e nelle decisioni sul proseguimento del trattamento con l’inclusione delle informazioni farmacogenetiche.
Molto utili a questo proposito sono organizzazioni come il Clinical Pharmacogenetics Implementation Consortium (Consorzio di implementazione della farmacogenetica clinica). (CPIC) e il PharmGKB ospitato dall’Università di Stanford. (The Pharmacogenomics Knowledgebase). Raccolgono e analizzano le prove scientifiche in questo campo, pubblicano raccomandazioni per la selezione dei farmaci e l’aggiustamento della dose dei farmaci in base ai risultati dei test farmacogenetici e alle informazioni sulla relazione tra geni e varianti geniche specifiche e l’effetto clinico sull’esito del trattamento farmacologico. PharmGKB offre anche strumenti di interpretazione online in cui, dopo aver inserito il genotipo di un paziente, vengono visualizzate direttamente le raccomandazioni relative a quel genotipo.
Questo dimostra che non è semplicemente necessario determinare per un gruppo di farmaci con strutture chimiche simili o con la stessa indicazione, ma per ogni singolo farmaco, sulla base di dati sperimentali e studi clinici, quanto siano rilevanti determinate varianti genetiche e se la genotipizzazione sia utile o meno. Pertanto, è necessario definire le coppie farmaco/gene per le quali la genotipizzazione secondo determinati criteri fornisce informazioni rilevanti per il trattamento e clinicamente orientative.
Livelli di evidenza
PharmGKB ha definito diversi livelli di evidenza che riflettono la forza dei dati scientifici a sostegno di un’associazione tra le varianti genetiche e uno specifico esito terapeutico (effetto, effetti collaterali) per singole coppie gene/farmaco (vedere riquadro).

Gli studi farmacogenetici sono difficili da realizzare perché, a seconda della frequenza degli alleli indagati in una popolazione o dell’effetto collaterale indagato, è necessario includere nello studio un numero molto elevato di pazienti per ottenere risultati statisticamente rilevanti. PharmGKB ha quindi definito quattro diversi livelli di evidenza [22,23]. Ogni nota clinica (“annotazione”) contiene quindi informazioni sul livello raggiunto per la rispettiva coppia farmaco/gene.
La Tabella 1 mostra una compilazione dei farmaci più importanti per la psichiatria, le loro proteine coinvolte nel metabolismo e nel trasporto e i livelli di evidenza clinica delle associazioni. Idealmente, i livelli di evidenza dovrebbero riflettersi anche nelle raccomandazioni delle informazioni sui farmaci. Inoltre, la Food and Drug Administration (FDA) statunitense ha pubblicato un elenco di 200 farmaci le cui informazioni sui farmaci forniscono informazioni sui biomarcatori farmacogenomici.
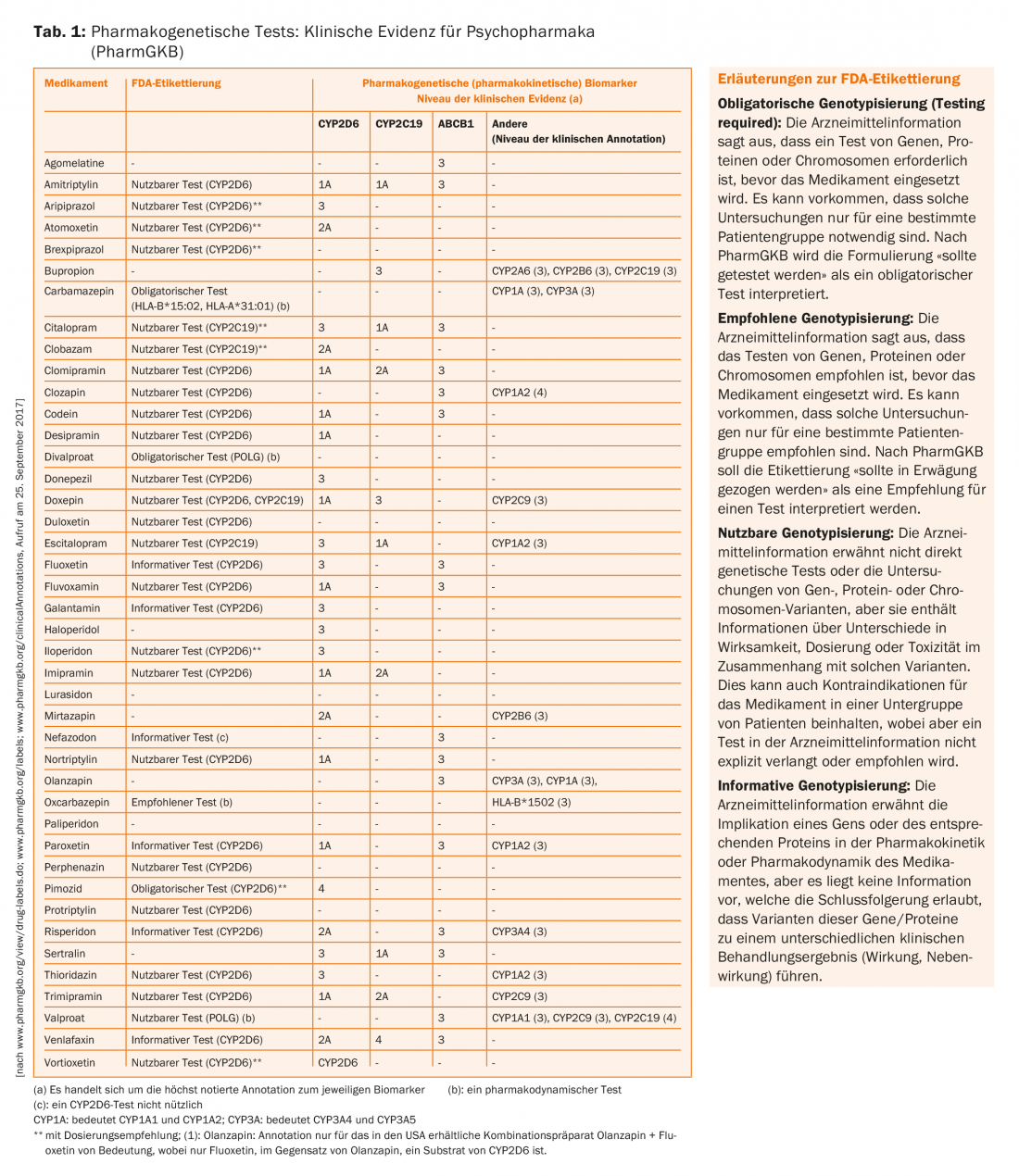
Con 26 biomarcatori, la psichiatria occupa il secondo posto dopo l’oncologia in termini di frequenza (Tab. 1) [24]. Va sottolineato che in oncologia, la genetica del tumore viene molto spesso esaminata per stimare l’effetto di un farmaco (ad esempio, determinate mutazioni nel recettore EGF devono essere presenti nelle cellule tumorali perché il gefitinib funzioni), ma questo di solito differisce dalla genetica del paziente. Al contrario, le questioni farmacogenetiche relative al metabolismo e al trasporto, nonché all’effetto dei farmaci non oncologici, utilizzano le informazioni genetiche delle cellule del corpo del paziente.
La tabella 1 presenta anche le annotazioni delle informazioni sui farmaci della FDA per gli psicofarmaci, riassunte da PharmGKB. Esistono annotazioni corrispondenti, ma meno complete e non presentate in questa sede, anche da parte dell’Agenzia Medica Europea (EMA), dell’Agenzia Giapponese per i Dispositivi Farmaceutici e Medici (PMDA), di Health Canada Santé Canada (HCSC) e di altre agenzie. Da questa compilazione si può riassumere quanto segue:
- Per le coppie farmaco/gene come l’allele carbamazepina/HLA-A*31:01 e l’allele carbamazepina/HLA-B*15:02 , ma anche per alcuni antidepressivi (ad esempio l’amitriptilina)/CYP2D6 e/o CYP2C19, esistono raccomandazioni al livello più alto (1A)
- Le coppie farmaco/gene correlate alle proteine trasportatrici come ABCB1 (PgP) (ad esempio, citalopram/ABCB1) raggiungono solo il livello di evidenza 3.
- Per quasi tutte le coppie farmaco/gene, i test farmacogenetici sono indicati come “azionabili”, cioè utilizzabili o direzionali, ma non necessariamente obbligatori o classificati come tali. Solo per la carbamazepina, il divalproato (ma stranamente non per il valproato – potrebbe essere la conseguenza di una mancanza di dati provenienti da studi clinici per raggiungere questo livello di raccomandazione) e l’antipsicotico pimozide, che non è più autorizzato in Svizzera, un test farmacogenetico è designato come “richiesto” dalla FDA.
Raccomandazioni per i test farmacogenetici in psichiatria
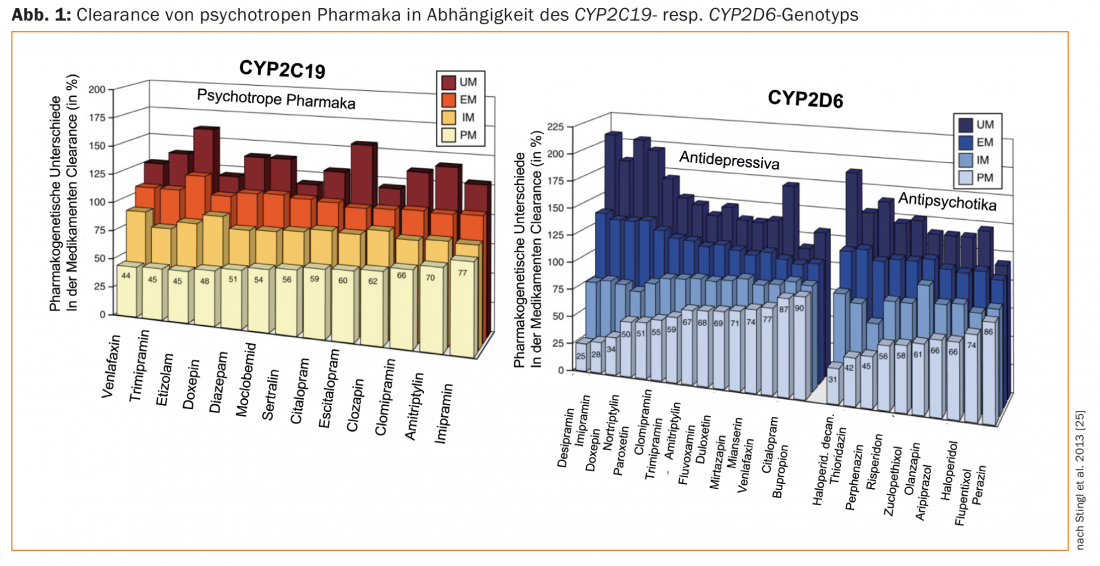
Le recensioni sulla farmacogenetica degli psicofarmaci e le linee guida per i test farmacogenetici in psichiatria riguardano soprattutto la genotipizzazione del CYP2D6 e del CYP2C19 deipazienti trattati con antidepressivi e antipsicotici [25–29]. I farmaci si differenziano per le loro proprietà come substrati di questi enzimi. Questo spiega le differenze significative nelle raccomandazioni di dose tra i diversi farmaci, tenendo conto dei genotipi dei pazienti (UM, EM, IM, PM; Fig. 1; [25]). Ad esempio, per la paroxetina, substrato quasi esclusivo del CYP2D, la dose deve essere ridotta solo al 50% circa della dose abituale per un PM (CYP2D6), e aumentata di oltre il 50% per un UM. Al contrario, questo enzima svolge un ruolo minore nel citalopram, motivo per cui non è necessario un aggiustamento della dose in base al genotipo CYP2D6. D’altra parte, il CYP2C19 svolge un ruolo importante nel metabolismo di questo antidepressivo – a seconda del genotipo CYP2C19, la dose deve essere aumentata (UM) o diminuita (PM) (Fig. 1).
Particolare attenzione merita la raccomandazione di rinomati autori svizzeri che, a nome della Società Svizzera per l’Ansia e la Depressione (SGAD), della Società Svizzera di Psichiatria Biologica (SGBP) e della Società Svizzera di Psichiatria e Psicoterapia (SGPP), hanno raccomandato la genotipizzazione di ABCB1 Raccomandare in tutti i pazienti depressi a cui è stata prescritta una terapia con antidepressivi, ma che non hanno un effetto terapeutico sufficiente. [30]. Questa raccomandazione ha un significato di politica sanitaria ed economica, in quanto potrebbe portare a genotipizzare migliaia di pazienti depressi ogni anno, indipendentemente dal fatto che siano o meno trattati con un substrato della PgP.
Alcuni antidepressivi sono substrati della PgP (citalopram), ma altri non lo sono (mirtazapina). Nei pazienti depressi trattati con antidepressivi, uno studio retrospettivo ha rilevato che in quelli trattati con i substrati della PgP amitriptilina, paroxetina, venlafaxina o citalopram, il polimorfismo genetico del gene ABCB1era associato alla risposta al trattamento [31]. La distribuzione dei genotipi della variante ABCB1(polimorfismo a singolo nucleotide, SNP) rs2032583 era particolarmente importante in questo caso. C’era un numero significativamente inferiore di pazienti non ricoverati tra i portatori dell’allele C di questa variante (25%) rispetto ai pazienti non portatori dell’allele C (62%). Risultati simili sono stati osservati nei calcoli relativi allo SNP rs2235015. Tra i portatori dell’allele T di questa variante, c’era un numero significativamente inferiore di non portatori rispetto ai non portatori. Tali correlazioni non sono state osservate in un gruppo di confronto di pazienti non trattati con substrati della PgP.
Va detto che a questo gruppo è stato prescritto un solo antidepressivo, la mirtazapina. In una meta-analisi, lo stesso team ha concluso che gli SNPs rs2032583 e rs2235015 sono significativamente associati all’effetto clinico [32], mentre l’analisi di altri SNPs non ha mostrato alcuna associazione. Allo stesso tempo, però, i ricercatori hanno concluso in un altro studio che il mantenimento dei livelli plasmatici terapeutici di antidepressivi è una misura necessaria in aggiunta alla genotipizzazione ABCB1 [33].
Alcuni autori della meta-analisi di cui sopra hanno recentemente pubblicato un’altra analisi, molto più completa, di 32 studi sulla relazione tra il polimorfismo ABCB1e l’effetto clinico (effetto terapeutico, tolleranza) degli antidepressivi. [32]Le associazioni più elevate si ottengono quando si analizzano l’rs2032583 e l’rs2235040, ma sono già più deboli quando si prende in considerazione l’rs2032582 e ancora più deboli quando si prendono in considerazione altri SNP come il già citato rs2235015. Nel complesso, gli autori dell’analisi hanno concluso che gli studi condotti finora non sono sufficienti a dimostrare un beneficio clinico della genotipizzazione ABCB1nella terapia farmacologica della depressione [34].
Sono necessari ulteriori studi clinici, ma anche quelli che dimostrino un significato funzionale di queste varianti ABCB1situate al di fuori della regione codificante della proteina del gene. Questo potrebbe essere studiato con tecniche di imaging per scoprire se i pazienti con diversi genotipi ABCB1 o combinazioni di varianti (aplotipi) sperimentano un diverso assorbimento dei farmaci nel cervello dopo la somministrazione di antidepressivi. Un’analisi indipendente della letteratura conferma che in questa fase l’introduzione generale della genotipizzazione di ABCB1nella pratica clinica è prematura [16]. Questa conclusione è stata raggiunta di recente anche dai membri della Commissione Farmaci della professione medica tedesca [35].
Per il medico professionista, questa controversia è fonte di confusione, soprattutto perché un gruppo di autori dubita, sulla base dei risultati delle loro ricerche, che l’amitriptilina sia un substrato della Pgp nell’uomo, in tutti i casi [36]. Inoltre, non è facile capire quali varianti geniche siano state studiate dai laboratori speciali che offrono analisi farmacogenetiche di ABCB1 . La genotipizzazione ABCB1 di routine della maggior parte dei pazienti depressi trattati con farmaci non è quindi chiaramente raccomandata al momento, soprattutto perché mancano studi sulla sensibilità e sulla specificità del test.
Significato del regolamento del 1. gennaio 2017 per i test farmacogenetici
Su 1. Il 1° gennaio 2017, in Svizzera è entrata in vigore un’ordinanza modificata, secondo la quale i test farmacogenetici sono coperti dall’assicurazione sanitaria obbligatoria se sono soddisfatte determinate condizioni (Ordinanza del DFI del 29 gennaio 2017). Settembre 1995 sulle prestazioni dell’assicurazione sanitaria obbligatoria (KLV, al 1 gennaio 2017). È di importanza pratica che queste analisi siano ora incluse nell’Elenco federale delle analisi (Allegato 3 del KLV). I test farmacogenetici sono coperti nell’elenco delle analisi del 1 luglio 2017 alle voci 2150.10, 2250.10, 2271.01, 2547.01 (revisione 14 luglio 2017). Bisogna fare una distinzione tra due condizioni:
- Un piccolo numero di test farmacogenetici può essere prescritto da tutti i medici, indipendentemente dal titolo di specialista, e rimborsato dalle casse malattia. Un elenco di queste analisi in relazione a farmaci specifici (cioè si tratta di coppie farmaco/gene in ogni caso), è fornito dalla Società Svizzera di Farmacologia Clinica e Tossicologia (SGKPT, compilato il 9.6.2016, versione 1):
- Abacavir (HLA-B*57:01);
- Carbamazepina (HLA-A*31:01 e HLA-B*15:02);
- 6-mercaptopurina, azatioprina (TPMT);
- 5-fluorouracile, capecitabina (DPYD);
- Irinotecan (UGT1A1).
Questo elenco viene aggiornato annualmente dalla SGKPT, sulla base della letteratura scientifica attuale e delle prove acquisite attraverso l’esperienza clinica nella selezione delle coppie gene/farmaco. Per la psichiatria e la neurologia, è importante che ogni psichiatra, neurologo, ma anche il medico di base possa (e debba) effettuare una genotipizzazione di HLA-A*31:01 e HLA-B*15:02 (nei pazienti di origine asiatica) nel caso di un nuovo trattamento con carbamazepina e che le compagnie di assicurazione sanitaria rimborsino al paziente i costi del test.
2. per i test farmacogenetici da prescrivere per coppie farmaco/gene diverse da quelle indicate sopra, sono particolarmente importanti le due limitazioni seguenti nell’elenco delle analisi:
- Limitazione 1: “Solo nel caso di un’indicazione per la somministrazione di un farmaco o nel caso in cui si verifichi un effetto collaterale correlato al farmaco o un’efficacia terapeutica ridotta o assente durante il trattamento con un farmaco per il quale esiste un’associazione scientificamente provata tra effetti collaterali significativi correlati al farmaco (inclusi gli effetti tossici) o un’efficacia terapeutica ridotta o assente e le mutazioni geniche analizzate”.
- Limitazione 4: “Per i medicinali che non figurano nell’elenco della SGKPT, la prescrizione delle analisi può essere effettuata solo da medici in possesso di un titolo federale di formazione continua in farmacologia clinica e tossicologia, ai sensi della Legge federale del 23 giugno 2006 sulle professioni mediche universitarie (Legge sulle professioni mediche, LPMed; RS 811.11)”.
Da un punto di vista etico, è degna di nota anche la Limitazione 3, secondo la quale i test non devono essere utilizzati per fare una diagnosi o per cercare una predisposizione a una malattia genetica.
Suggerimenti pratici
Questo articolo dimostra che la farmacogenomica avrà un’importanza crescente in psichiatria per la pianificazione e l’attuazione della farmacoterapia. In seguito alla revisione dell’elenco delle analisi, i test farmacogenetici rilevanti per la psichiatria sono disponibili a carico dell’assicurazione sanitaria obbligatoria, se uno specialista in farmacologia clinica e tossicologia ha stabilito la necessità del test. Per pianificare i test farmacogenetici e interpretarne i risultati in modo ottimale, è necessaria una conoscenza adeguata. Questo tema dovrebbe quindi essere preso sempre più in considerazione nella formazione degli specialisti in psichiatria e psicoterapia, nei programmi di formazione continua e di perfezionamento [37–39]. Anche gli eventi didattici per il pubblico sono necessari per promuovere la comprensione generale della farmacogenomica e per ottenere la sua implementazione nel miglior modo possibile [40]. Si raccomanda una letteratura specializzata che non solo riassuma i principi genetici, ma che contenga anche consigli sulle procedure pratiche ed esempi clinici [11]. In considerazione della difficile materia e a seguito della nuova normativa, la collaborazione con farmacologi e tossicologi clinici è particolarmente preziosa. Per l’attuazione pratica si raccomanda anche la collaborazione con professionisti di laboratorio formati in genetica.
Le indicazioni per i test farmacogenetici includono: Livelli plasmatici di farmaci più alti o più bassi rispetto a quelli normalmente attesi alla dose somministrata, suggerendo che il paziente ha una peculiarità genetica nel suo metabolismo. Il farmaco deve quindi essere un substrato dell’enzima geneticamente polimorfico del citocromo P-450 da testare. Quando un paziente è in comedicazione con gli inibitori, si deve anche considerare che i livelli plasmatici elevati possono simulare una carenza metabolica genetica come risultato di un’interazione farmacologica. Allo stesso modo, la comedicazione con un farmaco che induce un enzima può portare a un abbassamento del livello plasmatico, che non è geneticamente determinato. I test farmacogenetici devono quindi essere generalmente considerati come un complemento al monitoraggio terapeutico dei farmaci (TDM). (Fig. 2). Questo approccio è raccomandato anche dall’Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie (AGNP), che sta attualmente ripubblicando una “Consensus Guideline” per il TDM: descrive l’uso ottimale del TDM da solo, ma anche in combinazione con i test farmacogenetici. [41,42].
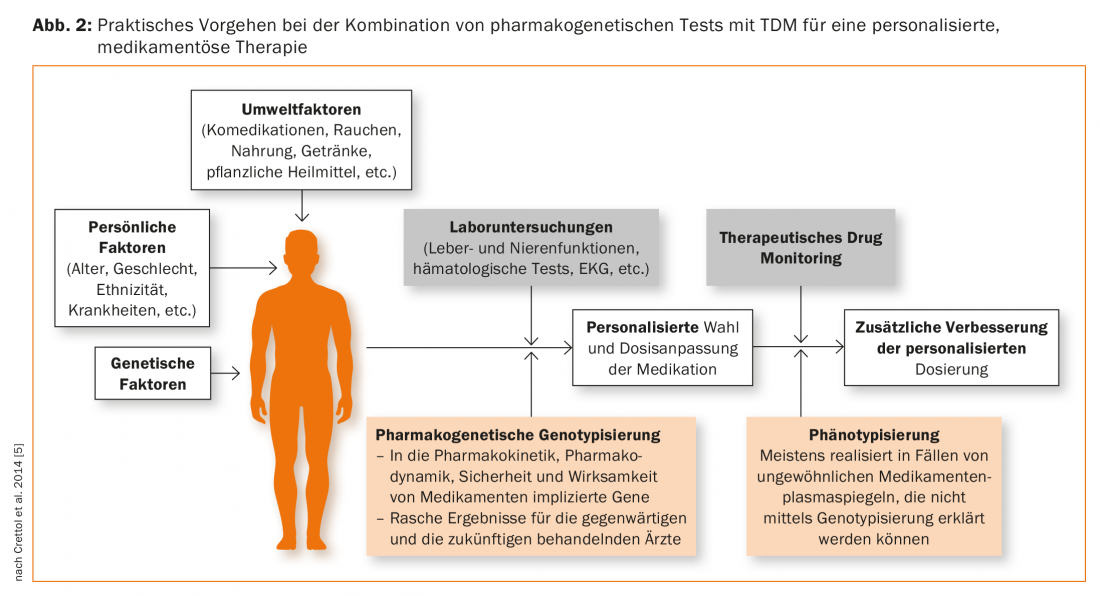
La genotipizzazione porta a risultati che hanno validità per tutta la vita e rappresentano quindi una sorta di “marcatore del tratto”. Il risultato di una fenotipizzazione, come la determinazione di un tasso metabolico, invece, deve essere considerato un “marcatore di stato”. A questo scopo, al paziente viene somministrata una sostanza che è il substrato dell’enzima da testare, poi viene raccolto il sangue o l’urina a seconda del protocollo, quindi generalmente vengono determinati la sostanza madre e il metabolita. Il rapporto metabolita/sostanza madre fornisce un quoziente metabolico, che è una misura della capacità di metabolizzazione dell’enzima testato, come illustrato sopra con l’esempio del debrisoquintest. Il risultato può fornire informazioni sul profilo genetico del paziente, in quanto EM e PM differiscono nel quoziente metabolico. Tuttavia, se il paziente è sotto l’influenza di farmaci o altre sostanze estranee che inibiscono o inducono l’enzima, questa influenza ambientale maschera la componente genetica del metabolismo della sostanza in esame. In psichiatria, sono comuni i seguenti fenotipi: CYP2D6 (destrometorfano come sostanza di prova), CYP2C19 (omeprazolo), CYP1A2 (caffeina), CYP2B6 (bupropione), CYP3A (midazolam) [43,44]. La fenotipizzazione è particolarmente utile per gli enzimi come il CYP1A2 e il CYP3A (CYP3A4), che mostrano grandi differenze interindividuali nella loro attività, ma per i quali non è noto un polimorfismo genetico clinicamente rilevante e la genotipizzazione non è quindi utile. La fexofenadina [44] o la digossina [45] sono state suggerite per fenotipizzare l’attività di ABCB1. A seconda della domanda, possono essere somministrati contemporaneamente diversi campioni di test per i diversi enzimi o trasportatori, come un “cocktail” [44,45]. La fenotipizzazione è quindi un complemento alla TDM e alla genotipizzazione (Fig. 2) [46], poiché il risultato fornisce informazioni sullo stato effettivo dell’attività dell’enzima o del trasportatore al momento del test [42].
Informazioni come i livelli plasmatici del farmaco, le comedicazioni, le comorbidità, la natura di eventuali effetti collaterali, le informazioni sulla risposta terapeutica al farmaco, sono utili e necessarie al farmacologo clinico per giustificare una prescrizione. In caso di domande di farmacogenetica, i Centri svizzeri di farmacologia clinica e tossicologia offrono consulenze e i pazienti possono essere indirizzati per test farmacogenetici su base consultiva.
Conclusioni
È giunto il momento di procedere con l’implementazione dei test farmacogenetici nella psicofarmacoterapia. Possono essere uno strumento prezioso per integrare le indagini cliniche e il TDM (Fig. 2) . Autorità come la FDA e l’EMA, nonché organismi scientifici come PharmGKB e CPIC, pubblicano regolarmente raccomandazioni per l’uso clinico dei test farmacogenetici. Pertanto, oggi esistono linee guida sviluppate da organismi indipendenti e adatte all’uso nella pratica clinica quotidiana. Promuovono la corretta implementazione e interpretazione dei risultati dei test farmacogenetici e quindi una terapia ottimizzata in base al genotipo [48]. È importante che il risultato genetico sia inserito nel contesto generale della terapia del paziente, cioè che si tenga conto delle influenze non genetiche, come la co-somministrazione di farmaci, al momento di adeguare la terapia. Tuttavia, ora sono necessarie anche linee guida adattate a livello regionale, per consentire un’applicazione economicamente e clinicamente sensata, adattata alle condizioni locali, in seguito alla decisione politica di assoggettare i test farmacogenetici a determinate condizioni all’assicurazione sanitaria obbligatoria e quindi più accessibili. Un’applicazione impropria può portare a risultati deludenti e il medico praticante perderà fiducia nella farmacogenomica e nella terapia personalizzata nel medio termine [49]. Come già detto, il tema della “farmacogenomica in psichiatria” dovrebbe essere sempre più considerato nell’educazione e nella formazione degli specialisti in psichiatria e psicoterapia [37–39]. Occorre quindi promuovere la cooperazione tra gli psichiatri e i medici praticanti, da un lato, e gli specialisti in farmacologia clinica, dall’altro. Allo stesso tempo, ci sono ancora molte domande irrisolte, motivo per cui sono ancora necessari studi clinici adeguatamente pianificati e condotti in particolare sulla farmacogenetica.
Letteratura:
- Alexanderson B, Evans DA, Sjöqvist F: Livelli plasmatici allo stato stazionario di nortriptilina nei gemelli: influenza dei fattori genetici e della terapia farmacologica. British Medical Journal 1969; 4(686): 764-768.
- Mahgoub A, et al: Idrossilazione polimorfica della debrisochina nell’uomo. Lancet 1977: 584-6.
- Gonzalez FJ, et al: Caratterizzazione del difetto genetico comune negli esseri umani carenti nel metabolismo della debrisochina. Natura 1988; 331: 442-446.
- Bertilsson L, et al: Lenta idrossilazione della nortriptilina e concomitante scarsa idrossilazione della debrisochina: implicazioni cliniche. Lancet 1981; i: 560-561.
- Crettol S, et al: Farmacogenomica in psichiatria: dal monitoraggio terapeutico dei farmaci alla medicina genomica. Clin Pharmacol Ther 2014; 95(3): 254-257.
- Pratt V, et al: Riassunti di genetica medica. Bethesda (Md), USA: National Center for Biotechnology Information; 2017. 416 p.
- Zhang G, Nebert DW: Medicina personalizzata: previsione del rischio genetico di risposta ai farmaci. Pharmacol Ther 2017; 175: 75-90.
- Relling MV, Evans WE: La farmacogenomica nella clinica. Natura 2015; 526(7573): 343-350.
- Patil J: Farmacogenetica e farmacogenomica: una breve introduzione. Journal of Pharmacovigilance 2015; 3: e139.
- Sim SC, Ingelman-Sundberg M: Biomarcatori farmacogenomici: nuovi strumenti per la terapia farmacologica attuale e futura. Trends Pharmacol Sci 2011; 32(2): 72-81.
- Dingermann T, Zündorf I: Farmacoterapia stratificata. Nozioni di base di genetica, procedura pratica. Eschborn, Germania: Govi; 2017. 339 p.
- Gandal MJ, et al: La strada verso la psichiatria di precisione: tradurre la genetica in meccanismi di malattia. Nat Neurosci 2016; 19(11): 1397-1407.
- Lohoff FW, Ferraro TN: Considerazioni farmacogenetiche nel trattamento dei disturbi psichiatrici. Expert Opin Pharmacother 2010; 11(3): 423-439.
- Budde M, et al: Aspetti farmacogenomici del disturbo bipolare: un aggiornamento. Eur Neuropsychopharmacol 2017; 27(6): 599-609.
- Malhotra AK, Zhang JP, Lencz T: Farmacogenetica in psichiatria: tradurre la ricerca nella pratica clinica. Mol Psychiatry 2012; 17(8): 760-769.
- Wolking S, et al: Impatto dei polimorfismi genetici di ABCB1 (MDR1, P-Glicoproteina) sulla disposizione dei farmaci e potenziali implicazioni cliniche: aggiornamento della letteratura. Farmacocinetica clinica 2015; 54(7): 709-735.
- Caudle KE, et al: Standardizzazione dei termini per i risultati dei test farmacogenetici clinici: termini di consenso del Clinical Pharmacogenetics Implementation Consortium (CPIC). Genet Med 2017; 19(2): 215-223.
- Hicks JK, et al: Linea guida del consorzio di implementazione della farmacogenetica clinica (CPIC) per i genotipi CYP2D6 e CYP2C19 e il dosaggio degli antidepressivi triciclici: aggiornamento 2016. Clin Pharmacol Ther 2017; 102(1): 37-44.
- Gasche Y, et al: Intossicazione da codeina associata a metabolismo ultrarapido del CYP2D6. N Engl J Med 2004; 351(27): 2827-2831.
- McCormack M, et al: HLA-A*3101 e reazioni di ipersensibilità indotte da carbamazepina negli europei. N Engl J Med 2011; 364(12): 1134-1143.
- de Leon J: Tradurre la farmacogenetica nella pratica clinica: i metabolizzatori ultrarapidi del citocromo P450 2D6 hanno bisogno di dosi più elevate di atomoxetina? J Am Acad Child Adolescatry 2015; 54(7): 532-534.
- Whirl-Carrillo M, et al: Conoscenze di farmacogenomica per la medicina personalizzata. Clin Pharmacol Ther 2012; 92(4): 414-417.
- McDonagh EM, et al: Dall’acquisizione di conoscenze farmacogenomiche alle applicazioni cliniche: il PharmGKB come risorsa di biomarcatori farmacogenomici clinici. Biomark Med 2011; 5(6): 795-806.
- Dickmann LJ, Ware JA: La farmacogenomica nell’era della medicina personalizzata. Drug Discov Today Technol 2016; 21-22: 11-6.
- Stingl JC, Brockmoller J, Viviani R: Variabilità genetica degli enzimi metabolizzatori dei farmaci: il duplice impatto sulla terapia psichiatrica e sulla regolazione della funzione cerebrale. Psichiatria Mol 2013; 18(3): 273-287.
- Stingl JC, Brockmoller J: [Farmacogenetica personalizzata. Linee guida basate sull’evidenza e applicazione clinica della diagnostica farmacogenetica]. Bundesgesundheitsblatt, Ricerca sulla salute, Protezione della salute. 2013; 56(11): 1509-1521.
- Ravyn D, et al: Strategie di trattamento farmacogenetico CYP450 per gli antipsicotici: una revisione delle prove. Schizophr Res 2013; 149(1-3): 1-14.
- Fabbri C, et al: Progressi e prospettive nella farmacogenetica dei farmaci antidepressivi. Expert Opin Drug Metab Toxicol 2016; 12(10): 1157-1168.
- Spina E, de Leon J: Applicazioni cliniche della genotipizzazione CYP in psichiatria. J Neural Transm (Vienna) 2015; 122(1): 5-28.
- Holsboer-Trachsler E, et al: Trattamento aigu degli episodi depressivi. Swiss Medical Forum 2016; 16(35): 716-724.
- Uhr M, et al: I polimorfismi del gene trasportatore di farmaci ABCB1 predicono la risposta al trattamento antidepressivo nella depressione. Neuron 2008; 57(2): 203-209.
- Breitenstein B, et al: Varianti del gene ABCB1 e esito del trattamento antidepressivo: una meta-analisi. Am J Med Genet B Neuropsychiatr Genet 2015; 168B(4): 274-283.
- Breitenstein B, et al: Associazione tra varianti del gene ABCB1, concentrazione plasmatica di antidepressivi e risposta al trattamento: risultati di uno studio clinico randomizzato. J Psychiatr Res 2016; 73: 86-95.
- Bruckl TM, Uhr M: Genotipizzazione ABCB1 nel trattamento della depressione. Farmacogenomica 2016; 17(18): 2039-2069.
- Bschor T, et al:[Genetic tests for controlling treatment with antidepressants]. Neurologist 2017; 88(5): 495-499.
- O’Brien FE, et al: La P-glicoproteina umana influenza in modo differenziato il trasporto di farmaci antidepressivi: rilevanza per la permeabilità della barriera emato-encefalica. Int J Neuropsychopharmacol 2013; 16(10): 2259-2272.
- Baumann P, et al: Una proposta per un catalogo di obiettivi di apprendimento e un curriculum di psicofarmacologia-farmacoterapia in Europa. World J Biol Psychiatry 2017; 18(1): 29-38.
- Whirl-Carrillo M, et al: Nuovo database di farmaci-malattia che dimostra l’applicabilità per la prescrizione basata sulla farmacogenomica. Clin Pharmacol Ther 2016; 100(6): 600-602.
- Collins SL, Carr DF, Pirmohamed M: I progressi della farmacogenomica delle reazioni avverse ai farmaci. Drug Saf 2016; 39(1): 15-27.
- Green ED, Guyer MS; Ricerca nazionale sul genoma umano I: tracciare un percorso per la medicina genomica dalle coppie di basi al letto del malato. Natura 2011; 470(7333): 204-213.
- Hiemke C, et al: Linee guida di consenso AGNP per il monitoraggio terapeutico dei farmaci in psichiatria: aggiornamento 2011. Farmacopsichiatria 2011; 44(6): 195-235.
- Hiemke C, et al: Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2017 Sep 14. doi: 10.1055/s-0043-116492. [Epub ahead of print]
- Hiemke C, Shams M: Fenotipizzazione e genotipizzazione del metabolismo dei farmaci per guidare la farmacoterapia in psichiatria. Curr drug deliv 2013; 10(1): 46-53.
- Bosilkovska M, et al.: Cocktail di Ginevra per la valutazione dell’attività del citocromo p450 e della glicoproteina P, utilizzando i punti di sangue secco. Clin Pharmacol Ther 2014; 96(3): 349-359.
- Fuhr U, Jetter A, Kirchheiner J: Procedure di fenotipizzazione appropriate per gli enzimi metabolizzatori di farmaci e i trasportatori nell’uomo e il loro uso simultaneo nell’approccio “cocktail”. Clin Pharmacol Ther 2007; 81(2): 270-283.
- Crettol S, et al.: Farmacogenomica in psichiatria – dalla TDM alla medicina genomica. Clin Pharmacol Ther 2014; 95(3): 254-257.
- Baumann P, et al: Crisi epilettiforme in seguito al trattamento con sertralina in un adolescente affetto da disturbo ossessivo compulsivo e che presenta un raro stato farmacogenetico. J Clin Psychopharmacol 2006; 26(6): 679-681.
- Amstutz U, Carleton BC: Test farmacogenetici: è tempo di linee guida di pratica clinica. Clin Pharmacol Ther 2011; 89(6): 924-927.
- de Leon J: Test farmacogenetici in psichiatria: dalla paura al fallimento al clamore. J Clin Psychopharmacol 2016; 36(4): 299-304.
- Mlakar V, et al: Farmacogenomica in oncologia pediatrica: revisione delle associazioni gene-farmaco per uso clinico. Int J Mol Sci 2016; 17(9): 1502.
InFo NEUROLOGIA & PSICHIATRIA 2017; 15(6): 21-30.