L’artrite psoriasica (PsA) comporta un grande onere per le persone che ne soffrono e molte di loro non rispondono in modo soddisfacente ai trattamenti finora disponibili. [2]. Ora i pazienti con PsA da moderata a grave possono beneficiare di un’ulteriore opzione di terapia biologica efficace e tollerabile. [1].
Tra l’1 e il 3% delle persone che soffrono di psoriasi in Svizzera, circa una su tre è affetta anche da PsA [2, 3]. Le manifestazioni cliniche tipiche della malattia infiammatoria cronica sistemica comprendono artrite, entesite, dattilite, disturbi assiali e psoriasi cutanea e ungueale [4]. Se la PsA progredisce senza controllo, può portare alla distruzione dell’articolazione e alla conseguente disabilità e all’aumento del rischio di mortalità. Le patologie concomitanti che si verificano di frequente, come le malattie cardiovascolari, la sindrome metabolica, l’obesità, il diabete o i disturbi psichiatrici, compromettono ulteriormente la funzionalità fisica e la qualità di vita delle persone colpite [2]. Dal 17 marzo 2022, risankizumab (Skyrizi®) offre un’ulteriore opzione terapeutica [1].
Espansione delle indicazioni di risankizumab [1]
Quasi tre anni dopo la sua approvazione nella psoriasi a placche da moderata a grave nell’aprile 2019, risankizumab (150 mg) può ora essere utilizzato come monoterapia o in combinazione con farmaci antireumatici modificanti la malattia (DMARD) non biologici per trattare gli adulti con PsA attiva che hanno avuto una risposta inadeguata o sono intolleranti a uno o più DMARD [1, 5]. L’inibitore selettivo dell’IL-23 è caratterizzato, tra l’altro, da un intervallo di trattamento di 3 mesi, adatto al paziente, dopo 2 iniezioni iniziali nelle settimane 0 e 4 [1, 6]. La sua efficacia a lungo termine e il suo profilo di sicurezza benefico e stabile nella psoriasi sono stati dimostrati in diversi studi di fase III [6-9]. I risultati degli studi randomizzati, controllati con placebo, di fase III KEEPsAKE 1 e 2 [2, 4] mostrano che risankizumab può anche influenzare positivamente il decorso della malattia nei pazienti con PsA attiva.
Efficacia comprovata e buona tollerabilità nella PsA [2, 4]
In KEEPsAKE 1 e 2, un totale di 1408 pazienti adulti affetti da PsA con risposta inadeguata o intolleranza ai DMARD sintetici convenzionali (cs) (KEEPsAKE 1) e/o biologici (b) DMARDs (KEEPsAKE 2) randomizzati a 24 settimane di trattamento in doppio cieco con risankizumab (150 mg) o placebo. Nella successiva estensione in aperto (OLE), tutti i pazienti hanno ricevuto risankizumab. Dopo 24 settimane, un numero significativamente maggiore di pazienti ha raggiunto l’endpoint primario di una risposta del 20% secondo i criteri dell’American College of Rheumatology (ACR 20) con risankizumab rispetto al placebo in entrambi gli studi(tabella). Nel braccio risankizumab sono stati ottenuti anche risultati significativamente migliori in termini di risposta ACR 50 e ACR 70 e di miglioramento di entesite, dattilite, affaticamento e funzionalità fisica [2, 4]. Secondo gli ultimi dati presentati al Congresso EADV 2021, l’efficacia di risankizumab nell’OLE ha continuato ad aumentare numericamente. Ad esempio, il tasso di risposta ACR 20 nei pazienti trattati in modo continuativo con risankizumab a 52 settimane è stato del 70,0% in KEEPsAKE 1 e del 58,5% in KEEPsAKE 2, che comprendeva anche pazienti con risposta inadeguata a precedenti bDMARD [10]. Nel complesso, risankizumab è stato ben tollerato e il profilo di sicurezza è stato paragonabile a quello osservato nei pazienti con psoriasi [2, 4].
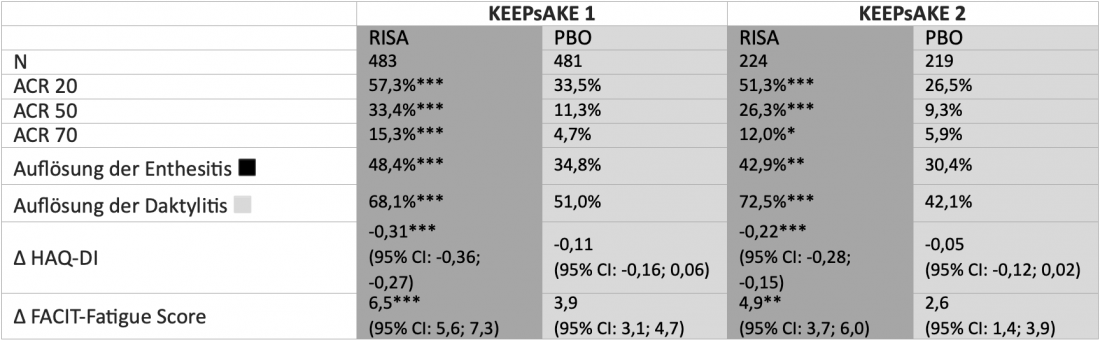
Tabella: Risposta dei pazienti con artrite psoriasica attiva che hanno assunto RISA dopo 24 settimane negli studi KEEPsAKE 1 e 2 di fase III, randomizzati e controllati con PBO. I pazienti di KEEPsAKE 1 avevano precedentemente risposto in modo inadeguato o non tollerato ≥ 1 csDMARDs. I pazienti di KEEPsAKE 2 avevano precedentemente risposto in modo inadeguato o non tollerato ≤ 2 bDMARD e/o ≥ 1 csDMARD. Imputazione dei non rispondenti (NRI) con imputazioni multiple se i dati sono mancanti a causa di COVID-19, o NRI se nessun dato è mancante a causa di COVID-19. *p<0,05; **p<0,01; ***p< 0,001.
◾ Definito come Leeds Enthesitis Index (LEI)=0 nei pazienti con LEI>0 al basale . ◽ Definito come Indice di Dattilite di Leeds (LDI)=0 nei pazienti con LDI>0 al basale. RISA: 150 mg di risankizumab alle settimane 0, 4 e 16; PBO: placebo; ACR 20/50/70: miglioramento di 20/50/70% nei criteri dell’American College of Rheumatology; HAQ-DI: Health Assessment Questionnaire-Disability Index; FACIT-Fatigue: Functional Assessment of Chronic Illness Therapy Fatigue Questionnaire. Adattato da [2, 4]
Conclusione
L’espansione delle indicazioni di risankizumab nel marzo 2022 consente ora ai pazienti adulti con PsA attiva di beneficiare di questa opzione terapeutica efficace a lungo termine, con un profilo di sicurezza stabile e un utilizzo facile per il paziente [1, 6]. Come dimostrano i risultati di KEEPsAKE 1 e 2, il trattamento con l’inibitore dell’IL-23 può alleviare significativamente i sintomi associati alla PsA [2, 4].
Letteratura
Le referenze possono essere richieste dai professionisti all’indirizzo medinfo.ch@abbvie.com.
Con il sostegno finanziario di AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Brevi informazioni tecniche Skyrizi®
CH-SKZD-220042_03/2022