Il lupus eritematoso sistemico (LES) è spesso una grande sfida non solo per le persone colpite, ma anche per i medici. Nonostante le numerose opzioni terapeutiche, il trattamento è di solito una passeggiata sul filo del rasoio tra una pericolosa attività autoimmune e l’immunosoppressione con molti effetti collaterali. Le attuali linee guida servono come supporto per una terapia ottimale. Grazie ai nuovi farmaci approvati, i limiti della terapia guida possono essere ampliati.
Il LES è una malattia multiorgano con un aspetto sfaccettato. In genere, la malattia ha un decorso recidivante. Tenere sotto controllo questi episodi non è sempre facile. Tuttavia, l’obiettivo dovrebbe essere quello di ottenere la più bassa attività di malattia possibile. Questo perché le recidive causano danni irreversibili, che sono associati a una prognosi sfavorevole. Ma come si può contenere l’attività della malattia?
Valutazione dell’attività della malattia
Il lupus eritematoso sistemico è, come suggerisce il nome, sistemico. Pertanto, per valutare l’attività della malattia si utilizzano principalmente vari punteggi clinici che mappano più sistemi di organi. Lo SLEDAI, il BILAG, lo SLAM, il LAI e l’ECLAM sono tutti punteggi affidabili e funzionali per valutare l’attività del lupus. Nelle attuali linee guida dell’EULAR (European Alliance Of Associations For Rheumatology) , tuttavia, vengono utilizzati principalmente lo SLEDAI e il BILAG, motivo per cui qui spieghiamo brevemente questi due punteggi [2].
- Lo SLEDAI (Systemic Lupus Erythematosus Disease Activity Index) e la sua modifica, il SELENA-SLEDAI, consistono in 24 valori di laboratorio e risultati clinici ponderati. Lo SLEDAI è probabilmente il punteggio più facile da usare e ha un valore massimo di 105 [3]. È ideale per l’uso in ambito clinico.
- Il BILAG valuta l’attività clinica della malattia in otto sistemi di organi e quindi integra un totale di 86 dati. Ogni organo viene valutato individualmente e suddiviso in categorie da A a E. A descrive un’attività patologica molto elevata nell’organo corrispondente, D un decorso stabile della malattia ed E significa che l’organo non è mai stato colpito dal lupus. I numeri vengono poi assegnati alla classificazione alfabetica: A = 9, B = 3, C = 1, D = 0, E = 0. Così, si può stimare l’attività complessiva del LES. Il valore massimo è 72. Il BILAG è più sensibile dello SLEDAI per monitorare un nuovo episodio di malattia. Tuttavia, il BILAG è relativamente complicato da raccogliere e quindi è più adatto a scopi di studio [3].
Nelle attuali linee guida, l’attività della malattia del LES è suddivisa in 3 categorie. Semplificando, questa classificazione può essere fatta utilizzando i punteggi appena spiegati.
- Lieve: SLEDAI ≤6; ≤1 BILAG B
Manifestazioni - Moderato: SLEDAI 7-12; ≥ 2 BILAG B
Manifestazioni e - Pesante: SLEDAI > 12; BILAG A
Manifestazioni
Linee guida attuali per il trattamento del LES
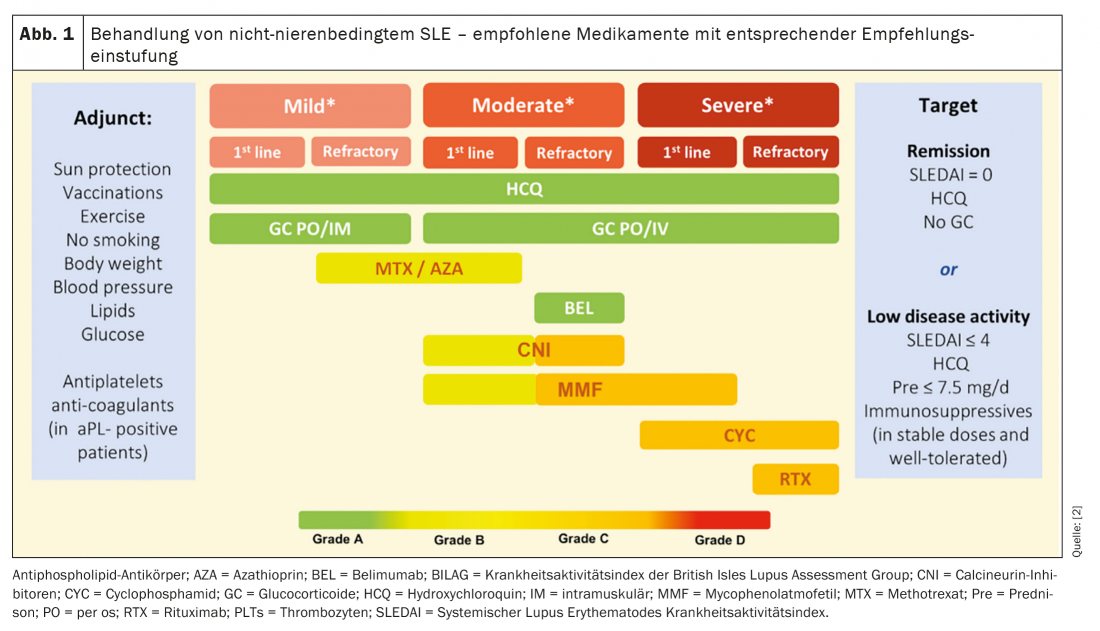
La terapia del LES si svolge secondo un sofisticato schema a tappe in base all’attività della malattia della persona colpita (Fig. 1) . L’obiettivo è la remissione del LES o almeno il raggiungimento di una bassa attività di malattia (LDA). A questo scopo, la terapia con idrossiclorochina è stata raccomandata per tutti i pazienti con lupus attivo dal 2019. In precedenza, l’idrossiclorochina era indicata solo per i pazienti con manifestazioni da lievi a moderate. Per l’idrossiclorochina, non si devono superare i 5 mg/kg di peso corporeo a causa della retinotossicità con l’uso a lungo termine. Questo porta a scaldare gli animi, poiché l’efficacia dell’idrossiclorochina è stata dimostrata con una dose di 6,5 mg/kg di peso corporeo. Tuttavia, costituisce senza dubbio la terapia di prima linea. Inoltre, i glucocorticoidi fanno sempre parte della terapia di una ricaduta. Tuttavia, questi non devono raggiungere una dose massima di 7,5 mg/d di prednisone equivalente per la somministrazione a lungo termine e devono essere interrotti, se possibile. È utile ridurre la terapia steroidea iniziando una terapia immunomodulante [2]. Inoltre, belimumab può ora essere somministrato nei corsi refrattari, di cui si parlerà più dettagliatamente in seguito.
Nuovi farmaci
Di seguito, parliamo brevemente di tre farmaci per i quali sono stati pubblicati studi importanti dopo la pubblicazione delle linee guida EULAR. Le terapie non sono quindi ancora integrate nelle linee guida attualmente in vigore. Tuttavia, sono particolarmente interessanti per il trattamento della nefrite lupica. Questa manifestazione del lupus viene attualmente trattata come terapia di seconda linea, in aggiunta alla terapia sistemica del lupus stabilita con gli inibitori della calcineurina conosciuti, come il tacrolimus o la ciclosporina.
Anifrolumab (Saphnelo)
L’anifrolumab è un anticorpo monoclonale che inibisce il recettore dell’interferone di tipo 1 sui macrofagi e sulle cellule NK. Riduce quindi l’effetto dell’IFNα e di altri interferoni di tipo 1, che sono significativamente coinvolti nella patogenesi del LES.
Anifrolumab è stato somministrato come terapia aggiuntiva ai regimi terapeutici standard con idrossiclorochina, glucocorticoidi e immunomodulatori. L’endpoint primario dello studio di fase III TULIP-2 era un miglioramento significativo del BICLA (BILAG-Based Composite Lupus Assessment). Già dopo le prime otto settimane, è stato possibile rilevare un effetto significativo rispetto al gruppo placebo. Non sono stati riscontrati ulteriori effetti collaterali, ad eccezione di un’aumentata incidenza di herpes zoster. Di conseguenza, l’anno scorso l’FDA ha approvato l’anifrolumab per le manifestazioni moderate e gravi del lupus. L’approvazione dell’EMA è ancora in sospeso.
Belimumab (Benlysta)
Belimumab è un anticorpo monoclonale che inibisce il BLyS (B Lymphocyte Stimulating Factor) . La BLyS è normalmente prodotta dai monociti e dai neutrofili.
Belimumab era già stato approvato dalla FDA e dall’EMA per la terapia del LES nel 2011. Tuttavia, solo nel 2020 lo studio BLISS-LN ha dimostrato l’efficacia di belimumab contro la nefrite lupica. L’endpoint primario era la risposta renale parziale con un uPCR ≤0,7 (rapporto proteine-creatinina urinaria). L’endpoint secondario era la risposta renale completa (uPCR ≤0,5). Gli endpoint primari e secondari sono stati raggiunti dal 10% in più di soggetti dopo 104 settimane. Gli studi successivi di fase IV hanno persino dimostrato un miglioramento della risposta renale in oltre il 20 percento dei soggetti.
Voclosporina (Lupkynis)
La voclosporina è un analogo della ciclosporina. Come la ciclosporina, la voclosporina inibisce la calcineurina. La voclosporina riduce così la produzione di interleuchina-2, importante per la risposta immunitaria mediata dalle cellule T. La voclosporina non solo è più potente della ciclosporina, ma ha anche un intervallo terapeutico più ampio. Questa maggiore sicurezza della voclosporina elimina la necessità di un monitoraggio della dose, come avviene di solito quando si assume la ciclosporina. Inoltre, la voclosporina stabilizza il citoscheletro di actina dei podociti renali. Questo supporta la funzione della membrana basale.
Lo studio di fase III Aurora 1 ha analizzato l’efficacia contro la nefrite da lupus. L’endpoint primario era la risposta renale completa e l’endpoint secondario era la risposta renale parziale. Dopo 52 settimane, la terapia con voclosporina in combinazione con micofenolato mofetile e glucocorticoidi a basso dosaggio ha mostrato un tasso maggiore di risposta renale completa. Il profilo degli effetti collaterali era paragonabile a quello del gruppo placebo. Di conseguenza, la voclosporina è stata approvata dalla FDA nel 2021. L’approvazione dell’EMA è ancora in sospeso. La voclosporina è preferibile al belimumab nella nefrite lupica con proteinuria elevata. Se la componente nefritica è presente nella nefrite lupica, si raccomanda la terapia con belimumab.
Strategia “Treat-to-target
L’obiettivo generale della terapia del LES è la remissione senza farmaci continui oltre all’idrossiclorochina. I pazienti traggono il massimo beneficio da una strategia di trattamento mirata. Questa strategia di trattamento si divide in tre fasi, come mostrato nella figura 2 . Quando si raggiunge la remissione, l’obiettivo dovrebbe essere quello di interrompere i glucocorticoidi e successivamente gli immunomodulatori. Se il paziente ha raggiunto solo una bassa attività della malattia e nessuna remissione al basale, si raccomanda una riduzione graduale dei glucocorticoidi e degli immunomodulatori. Fortunatamente, le terapie efficaci aiutano così bene che nella stragrande maggioranza dei casi un attacco acuto può essere fermato. Il problema più grande è il controllo a lungo termine dell’attività della malattia. Pertanto, l’attività del lupus deve essere monitorata ogni quattro-sei mesi tra le fasi del trattamento. In questo modo, è possibile individuare precocemente una ricaduta durante la riduzione della terapia. Questo è particolarmente importante perché si verificano molti danni agli organi, soprattutto all’inizio di una ricaduta. Dopo 6 mesi di attività del lupus, il danno irreversibile è già visibile in circa un quinto dei pazienti. I due fattori prognosticamente rilevanti che hanno un effetto protettivo sull’ulteriore decorso della malattia sono, da un lato, una lunga durata della remissione e, dall’altro, la durata accumulata dell’assunzione di idrossiclorochina. Tuttavia, spesso è solo una questione di tempo prima che si verifichi la prossima ricaduta. Grazie ai nuovi meccanismi d’azione dei farmaci appena approvati, c’è almeno una speranza che le fasi di remissione durino più a lungo in futuro.
Congresso: SSAI
Letteratura:
- Andrea Doria (Padova IT), Nuove strategie nella gestione del LES, Conferenza SSAI 28.01.2022.
- Fanouriakis A, Kostopoulou M, Alunno A, et al: Aggiornamento 2019 delle raccomandazioni EULAR per la gestione del lupus eritematoso sistemico. Annali delle Malattie Reumatiche 2019;78:736-745.
- Lam GK, Petri M: Valutazione del lupus eritematoso sistemico. Clin Exp Rheumatol. 2005 Sep-Oct; 23(5 Suppl 39): S120-132.
PRATICA GP 2022; 17(6): 24-25