La terapia genica, la speranza di lunga data della ricerca medica, sta finalmente trovando la sua strada nella clinica per curare le malattie monogenetiche. Così, la medicina ha a disposizione una nuova terapia che può trattare le malattie ereditarie non solo a livello sintomatico, ma anche causale. Un altro approccio di terapia genica è il trattamento delle alterazioni geniche acquisite nei tumori maligni con le cellule T CAR (recettore chimerico dell’antigene).
La terapia genica, la speranza di lunga data della ricerca medica, sta finalmente trovando la sua strada nella clinica per curare le malattie monogenetiche. Così, la medicina ha a disposizione una nuova terapia che può trattare le malattie ereditarie non solo a livello sintomatico, ma anche causale. Un altro approccio di terapia genica è il trattamento delle alterazioni geniche acquisite nei tumori maligni con le cellule T CAR (recettore chimerico dell’antigene). Quella che segue è una panoramica dei principi biologici molecolari e dell’applicazione clinica delle attuali procedure di terapia genica e cellulare.
I geni sono le impronte di tutte le proteine – le mutazioni come causa delle malattie monogenetiche
Ogni cellula umana contiene un’impronta genetica all’interno del nucleo cellulare, sotto forma di acido desossiribonucleico (DNA). Il DNA è composto da quattro elementi di base, le basi adenina (A), timina (T), guanina (G) e citosina (C), che, allineate in lunghe catene lineari, formano la struttura di base dei cromosomi di una cellula umana. Il DNA di ogni cellula contiene unità di codifica individuali, i geni. Ogni gene è composto da una regione codificante e da un’unità regolatrice, il promotore, la cui attività può essere amplificata da un elemento potenziatore, se necessario. Ogni gene codifica la struttura di una proteina attraverso la sequenza dei quattro elementi di base del DNA. Le proteine sono composte da 20 elementi di base, gli aminoacidi, che si ripiegano insieme in una o più catene lineari per formare le proteine. Solo le proteine correttamente ripiegate possono svolgere la loro funzione biologica nella cellula.
Malattie monogenetiche
Se si verifica una riparazione difettosa dopo un danno al DNA, la sequenza dei blocchi di base del DNA può essere alterata. In alternativa, si possono perdere anche i blocchi di base del DNA. Questi cambiamenti sono chiamati “mutazioni”. Se si verifica una mutazione in una sezione del DNA che codifica per una proteina, questa può alterare la struttura della proteina in essa codificata: La proteina difettosa sintetizzata secondo il progetto del DNA non può svolgere la sua funzione naturale nella cellula o può farlo solo in modo incompleto. Questo cambiamento genetico, nel caso più semplice, ad esempio lo scambio di una A con una C all’interno del DNA, può essere la causa scatenante di una malattia genetica, se la funzione della cellula in un tessuto è ridotta o addirittura fallisce come risultato, ad es.
- Quando il metabolismo nelle cellule funziona in modo insufficiente e i metaboliti si accumulano (ad esempio, difetto della lipoproteina lipasi).
- Quando la sintesi di singoli mattoni di base da parte del metabolismo è carente (ad esempio, difetto della glucosio-6-fosfato deidrogenasi).
- Se singoli componenti del sistema immunitario non funzionano (ad esempio, granulomatosi settica o immunodeficienza combinata grave).
In uno studio recente, 4166 malattie rare e monogenetiche potrebbero essere collegate causalmente a 3163 geni [1]. Una cura per la malattia con una causa genetica è possibile solo se è possibile compensare o correggere la causa scatenante.
Nuovi approcci alla guarigione attraverso la terapia genica
Se una mutazione genetica chiaramente definita è stata identificata come causa di una malattia, questa diventa accessibile per una potenziale terapia genica. Sono disponibili diverse procedure:
- Nelle malattie in cui la mutazione del gene porta alla perdita dell’espressione della proteina o all’espressione di una proteina difettosa (mutazioni “loss-of-function” o “dysfunction”), può essere eseguita l’aggiunta del gene.
- Nelle malattie in cui la mutazione del gene porta a un’iperfunzione della proteina (mutazioni “gain-of-function”), si può tentare la riparazione del gene.
Nell’aggiunta genica, il genoma della cellula viene ampliato da un gene che codifica correttamente la proteina mancante o mal funzionante e quindi compensa la funzione del gene mutato. Ciò comporta il ripristino della funzione originale della proteina. L’aggiunta genica è stata testata in studi clinici per il trattamento di numerose malattie, con successo clinico per oltre 20 malattie ereditarie congenite. Tutti i prodotti di terapia genica attualmente approvati si basano sull’aggiunta di geni.
Nella riparazione genica con nucleasi come CRISPR-Cas9 (fusione della nucleasi Cas9 con CRISPR che lega il DNA, Clustered Regularly Interspaced Short Palindromic Repeats), la sequenza corretta del DNA viene ripristinata nella cellula mirando alla mutazione e correggendo la mutazione in situ (principio: cut out and replace). In questo modo, la funzione prevista della proteina viene ripristinata e, di conseguenza, si verifica una normalizzazione della funzione biologica. L’uso della riparazione genica (“forbici geniche”/CRISPR-Cas) è possibile indipendentemente dalla presenza di mutazioni “gain-of-function” o “loss-of-function”. Tale modifica sequenza-specifica delle informazioni genetiche è possibile in laboratorio, ma finora è stata utilizzata in oncologia solo nel contesto di alcuni studi clinici.
Genaddition
I primi successi clinici attraverso la terapia genica sono stati raggiunti nel campo dell’immunologia. Le cause delle immunodeficienze congenite risiedono nelle cellule staminali ematopoietiche. I pazienti affetti possono quindi spesso essere curati attraverso il trapianto di cellule staminali ematopoietiche da un donatore estraneo o familiare (trapianto allogenico). I familiari sono raramente utilizzati come donatori HLA-aploidentici a causa di un tasso più elevato di effetti collaterali. I membri della famiglia che hanno un’identità HLA più elevata, ma che sono anche portatori del difetto genetico, hanno maggiori probabilità di non essere idonei. In assenza di un donatore HLA-identico (in circa 1/3 dei caucasici, più frequentemente in altri gruppi etnici), la terapia genica autologa può portare alla guarigione della malattia.
Per la terapia genica ex vivo, le cellule autologhe vengono aferite dopo la mobilizzazione con G-CSF, purificate, arricchite e coltivate ex vivo per un breve periodo di tempo. Durante questo periodo, le cellule staminali vengono trattate con il vettore di terapia genica e poi reinfuse nel paziente, di solito dopo la chemioterapia per ablare il midollo osseo. Sorprendentemente, a seconda dell’immunodeficienza, una correzione parziale può essere sufficiente per un miglioramento clinico significativo.
La prima pubblicazione sulla terapia genica di successo è apparsa nel 2000 sul trattamento dei neonati con la forma più grave di immunodeficienza congenita, l’immunodeficienza combinata grave, che di solito porta alla morte senza trapianto nel primo anno di vita a causa delle infezioni più gravi [2].
Tra il 2000 e il 2006, tutti i successi clinici nel campo della terapia genica sono stati ottenuti con l’aiuto dei cosiddetti vettori retrovirali. Questi introducono la sequenza di correzione sotto forma di RNA nelle cellule staminali, dove viene convertita in DNA mediante trascrizione inversa e poi integrata nel DNA del paziente (aggiunta di geni). Successivamente, si forma una proteina funzionale e quindi il difetto viene corretto clinicamente.
Per un’aggiunta di geni in vivo, le cellule del corpo non vengono rimosse, trattate e restituite, ma le particelle virali con la sequenza di correzione vengono iniettate direttamente nel corpo. La prima aggiunta genica in vivo è stata pubblicata nel 2007: per il trattamento della malattia di Parkinson, ai pazienti sono state iniettate unilateralmente, per via subtalamica, particelle virali adeno-associate (AAV) modificate che codificavano la decarbossilasi dell’acido glutammico [3]. La maggior parte delle sperimentazioni cliniche di terapia genica in vivo utilizza particelle AAV modificate per trasmettere informazioni genetiche nell’organismo. Le eccezioni sono l’uso di particelle virali modificate derivate dal virus herpes simplex-1 (HSV-1) [4] o di particelle adenovirali non replicanti [5] per il trattamento del glioblastoma e la sperimentazione di particelle virali derivate dall’HIV-1 per il trattamento in vivo della malattia di Parkinson [6].
Effetti collaterali nei primi studi di terapia genica
Nella prima generazione di terapie geniche ex vivocon vettori γ-retrovirali, è stato dimostrato che il sito di integrazione del vettore di terapia genica nel genoma della cellula bersaglio gioca un ruolo chiave per quanto riguarda i possibili effetti collaterali. Questi vettori di prima generazione si sono integrati preferenzialmente vicino ai siti di inizio della trascrizione. Nei vettori di terapia genica γ-retrovirale di prima generazione, l’espressione della proteina era guidata da un promotore nel vettore di terapia genica e potenziata da un potenziatore. L’enhancer del vettore di terapia genica di prima generazione era in grado di interagire con il sito di inizio della trascrizione del gene in cui era integrato il vettore di terapia genica. Se si verifica l’integrazione in un oncogene, questo oncogene potrebbe essere attivato in aggiunta all’espressione della proteina terapeutica, che porta alla guarigione della malattia di base. Di conseguenza, le cellule staminali in cui si è verificata questa costellazione hanno acquisito un vantaggio di crescita e possono moltiplicarsi clonalmente. In alcuni studi clinici con varie immunodeficienze, questo ha portato alcuni pazienti a sviluppare tumori maligni ematologici come effetto collaterale della terapia genica [7–10]. Questi effetti collaterali hanno portato a passare dai vettori γ-retrovirali ai vettori lentivirali derivati dal virus dell’HIV-1 a partire dal 2009, poiché il loro profilo di integrazione promette maggiore sicurezza [11]. Inoltre, nei cosiddetti vettori lentivirali auto-inattivanti (SIN), sono stati rimossi il promotore derivato dal virus HIV-1 e il suo elemento esaltatore. L’assenza di elementi enhancer nei vettori di terapia genica di seconda e terza generazione impedisce la transattivazione mediata da enhancer degli oncogeni dopo il trattamento ex vivo dellecellule staminali. Ad oggi, gli studi clinici hanno trattato le cellule staminali di circa 100 pazienti con vettori lentivirali SIN. Finora, nessuno di questi studi clinici ha portato allo sviluppo di neoplasie ematologiche, il che indica un miglioramento significativo della sicurezza rispetto alla prima generazione di vettori.
I vettori di terapia genica basati su AAV utilizzati per l’aggiunta di geni in vivosi integrano solo in minima parte nel genoma delle cellule bersaglio. Pertanto, la mutagenesi per inserzione è improbabile. Il potenziale di rischio maggiore dei vettori di terapia genica basati su AAV risiede in qualsiasi immunità preesistente alle strutture di superficie del vettore AAV. In uno studio clinico per il trattamento dell’emofilia B, è stato utilizzato un vettore AAV2 codificante il fattore di coagulazione IX per via intramuscolare. Una risposta immunitaria mediata dalle cellule T ha portato all’eliminazione di tutte le cellule geneticamente modificate e ha terminato l’effetto terapeutico [12]. Al contrario, la somministrazione per via endovenosa ha determinato l’assorbimento dei vettori negli epatociti e gli effetti terapeutici a lungo termine nei pazienti in cui non era possibile rilevare gli anticorpi contro l’AAV prima dell’inclusione nello studio [13].
Successi della terapia genica
La prima generazione di vettori di terapia genica γ-retrovirale ha fornito la prova che la terapia genica può portare al successo clinico per l’X-SCID (immunodeficienza combinata grave legata all’X) [2], l’ADA (adenosina deaminasi)-SCID [14], l’X-CGD (granulomatosi settica legata all’X) [9], l’epidermolisi bollosa [15] e per la sindrome di Wiskott Aldrich (WAS) [16].
A causa dei suddetti effetti collaterali nel trattamento di X-SCID, X-CGD e WAS con vettori di terapia genica di prima generazione (vettori γ-retrovirali con promotore/enhancer completo), sono stati sviluppati vettori lentivirali SIN, che hanno portato a una storia di successo clinico. Finora sono stati raggiunti successi clinici con i vettori lentivirali SIN nella terapia genetica ex vivo per il trattamento di
- Adrenoleucodistrofia legata all’X (ALD) [17]
- γ-Talassemia [18,19]
- COSA [20]
- X-SCID [21]
- ADA-SCID [22]
- Malattia falciforme [23]
- COL7A1 Epidermolisi Bullosa [24]
- Leucodistrofia metacromatica [25]
Nel frattempo, la terapia genica in vivomediata da AAV è stata utilizzata anche per il trattamento di almeno 14 indicazioni:
Neurologia
- Parkinson [3,26,27]
Oftalmologia
- Cong del fegato. Amaurose [28,29]
- Corioideremia [30,31]
- Degenerazione maculare legata all’età [32]
- Neuropatia ottica ereditaria di Leber [33,34]
Ematologia
- Emofilia B [13]
Distrofia muscolare
- Distrofia muscolare di Becker [35]
- Atrofia muscolare spinale di tipo I (SMA1) [36]
Malattie metaboliche
- Malattia di Pompe [37]
- Carenza di α-1-antitripsina (AAT) [38,39]
- Mucopolisaccaridosi di tipo IIIB [40]
- Carenza di decarbossilasi degli aminoacidi aromatici [41,43]
- Deficit di lipasi lipoproteica [42]
Nel trattamento della leucemia, le cellule CAR-T sono utilizzate in numerosi studi e ora sono anche terapie approvate. A questo scopo, i recettori antigenici chimerici vengono introdotti nelle cellule T autologhe dei pazienti affetti. Ciò consente a queste cellule T geneticamente modificate (cellule CAR-T) di riconoscere ed eliminare le cellule tumorali [44–46].
Riparazione del genere
Finora, non è stato possibile avere vettori di terapia genica lenti- o γ-retrovirali integrati in siti predeterminati nel genoma. L’inserimento e/o la correzione specifici per la sequenza sono diventati possibili solo dopo che è stato possibile tagliare il DNA in modo specifico per la sequenza. Questo avviene utilizzando nucleasi come la CRISPR-Cas. In questo sistema di terapia genica, è stata prodotta una fusione tra il DNA-binding Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR) e il DNA-cutting Cas9 (CRISPR/Cas9) [47]. La conseguente rottura del DNA può essere riparata dalla cellula in due modi diversi: O le estremità vengono ricollegate in un processo difettoso chiamato giunzione non omologa delle estremità. Il secondo meccanismo di riparazione è la ricombinazione omologa. Questo percorso viene intrapreso quando nella cellula c’è del DNA di riparazione le cui estremità corrispondono alla sequenza del DNA nel sito della rottura del DNA. Questo DNA di riparazione viene somministrato alle cellule insieme alla nucleasi e serve come modello genetico. Nella ricombinazione omologa, la rottura del DNA viene poi chiusa dagli enzimi endogeni di riparazione cellulare in base alla sequenza del DNA di riparazione. Ciò consente di introdurre un gene di correzione nel genoma in modo specifico per la sequenza o di correggere geneticamente le mutazioni puntiformi. L’aggiunta di geni specifici per la sequenza non ha ancora trovato applicazione clinica, perché l’efficienza del metodo è stata finora limitante. Tuttavia, i recenti sviluppi tecnici stanno portando gli studi clinici nel regno delle possibilità.
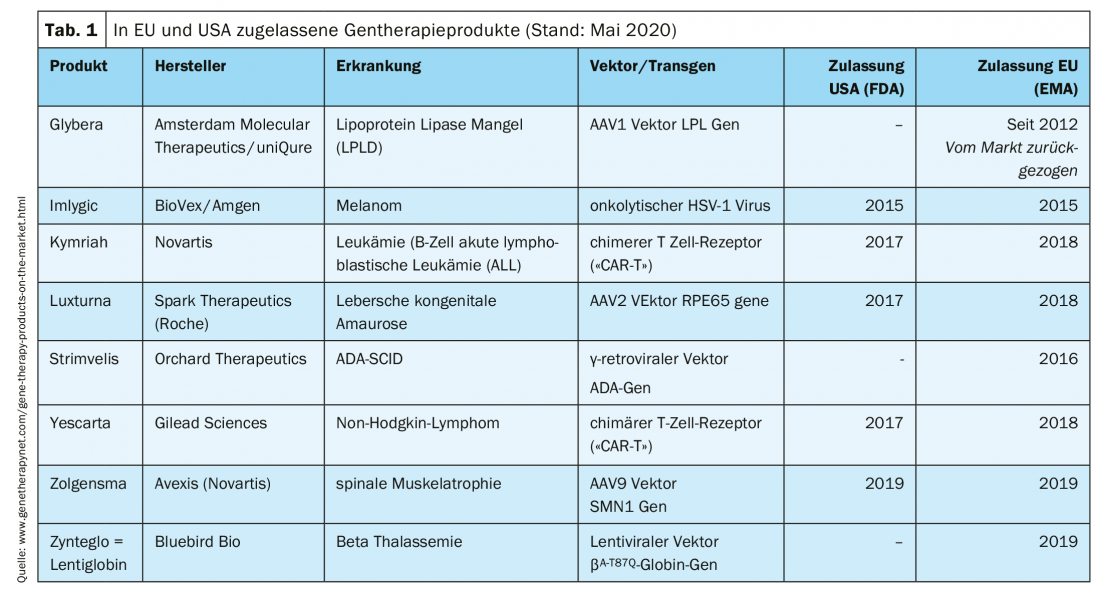
Prodotti di terapia genica clinicamente approvati
Il trattamento dei pazienti con prodotti di terapia genica è possibile in centri specializzati. Diversi prodotti hanno già ricevuto l’autorizzazione all’immissione in commercio (Tab. 1).
Messaggi da portare a casa
- La terapia genica come trattamento causale per le malattie ereditarie monogenetiche sta trovando sempre più spazio nella clinica.
- Utilizzando vettori virali, la terapia genica basata sull’aggiunta di geni è stata utilizzata con successo negli studi clinici per alcune malattie ematologiche dal 2000.
- malattie e immunodeficienze congenite.
- La riparazione genica mirata mediante nucleasi è stata finora utilizzata in pochi studi per le malattie oncologiche in cui la funzione di un gene deve essere disattivata.
- Alcuni tumori maligni possono essere trattati con cellule T geneticamente modificate (cellule CAR-T).
- I terapici genici sono attualmente già disponibili come prodotti approvati per 7 malattie.
Letteratura:
- Ehrhart F, et al: Storia delle malattie rare e delle loro cause genetiche – un approccio guidato dai dati. bioRxiv 2020; preprin doi: https://doi.org/10.1101/595819
- Cavazzana-Calvo, M et al: Terapia genica della malattia umana da immunodeficienza combinata grave (SCID)-X1. Science 2000; 288: 669-672.
- Kaplitt MG, et al: Sicurezza e tollerabilità della terapia genica con un gene GAD trasportato da un virus adeno-associato (AAV) per la malattia di Parkinson: uno studio di fase I in aperto. Lancet 2007; 369(9579): 2097-2105.
- Todo T: Immunoterapia attiva: terapia virale oncolitica con HSV-1 Adv Exp Med Biol. 2012; 746: 178-186.
- Brenner AJ, et al: Sicurezza ed efficacia di VB-111, una terapia genica antitumorale, nei pazienti con glioblastoma ricorrente: risultati di uno studio di fase I/II. Neuro Oncol 2020; 22(5): 694-704.
- Palfi S, et al: Follow-up a lungo termine di uno studio di fase I/II di ProSavin, una terapia genica con vettore lentivirale per la malattia di Parkinson. Hum Gene Ther Clin Dev 2018; 29(3): 148-155.
- Hacein-Bey-Abina S, et al: Evento avverso grave dopo una terapia genica di successo per l’immunodeficienza combinata grave X-linked. N Engl J Med 2003; 348(3): 255-256.
- Aiuti A, et al.: Il documento di riflessione del Comitato per le Terapie Avanzate dell’Agenzia Europea dei Medicinali sulla gestione dei rischi clinici derivanti dalla mutagenesi inserzionale. Human Gene Ther Clin Dev 2013; 24: 47-54.
- Ott MG, et al: Correzione della malattia granulomatosa cronica legata all’X mediante terapia genica, aumentata dall’attivazione inserzionale di MDS1-EVI1, PRDM16 o SETBP1. Nat Med 2006; 12(4): 401-409.
- Siler U, et al.: Successo della combinazione di terapia genica sequenziale e allo-HSCT di salvataggio in due bambini con X-CGD – Importanza del tempismo. Curr Gene Ther 2015; 15(4): 416-427.
- Serrao E, et al: Siti di integrazione del DNA retrovirale: dalla ricerca di base alle applicazioni cliniche. AN Crit Rev Biochem Mol Biol 2015; 28: 1-17.
- Manno CS, et al: Successo della trasduzione del fegato nell’emofilia con AAV-Fattore IX e limitazioni imposte dalla risposta immunitaria dell’ospite. Nat Med 2006; 12: 342-347.
- Nathwani AC, et al: Sicurezza ed efficacia a lungo termine della terapia genica con fattore IX nell’emofilia B. N Engl J Med 2014; 371(21): 1994-2004.
- Aiuti A, et al.: Correzione di ADA-SCID mediante terapia genica con cellule staminali combinata con condizionamento non mieloablativo. Science 2002; 296(5577): 2410-2413.
- Mavilio F, et al: Correzione dell’Epidermolisi Bullosa Giunzionale mediante trapianto di cellule staminali epidermiche geneticamente modificate. Nat Med 2006; 12(12): 1397-1402.
- Boztug K, et al: Terapia genica con cellule staminali per la sindrome di Wiskott-Aldrich. N Engl J Med 2010; 363(20): 1918-1927.
- Cartier N, et al.: Terapia genica con cellule staminali ematopoietiche con un vettore lentivirale nell’Adrenoleucodistrofia X-linked. Science 2009; 326(5954): 818-823.
- Cavazzana-Calvo M, et al.: Indipendenza trasfusionale e attivazione di HMGA2 dopo la terapia genica della β-talassemia umana. Natura 2010; 467(7313): 318-322.
- Thompson AA, et al: Terapia genica nei pazienti con β-talassemia dipendente da trasfusione. N Engl J Med 2018; 378: 147993.
- Aiuti A, et al.: Terapia genica con cellule staminali ematopoietiche lentivirali in pazienti con sindrome di Wiskott-Aldrich. Science 2013; 341(6148): 1233151.
- De Ravin SS, et al: Terapia genica con cellule staminali ematopoietiche lentivirali per l’immunodeficienza combinata grave X-linked. Sci Transl Med 2016; 8(335): 335ra57.
- Mullard A: L’EMA dà il via libera alla seconda terapia genica. Nat Rev Drug Discov 2016; 15: 299.
- Ribeil JA, et al: Terapia genica in un paziente con malattia falciforme. N Engl J Med 2017; 376(9): 848-855.
- Lwin SM, et al: Risultati di sicurezza e di efficacia precoce della terapia genica con fibroblasti lentivirali nell’Epidermolisi Bullosa Distrofica Recessiva. JCI Insight 2019; 4(11): e126243.
- Biffi A, et al.: La terapia genica con cellule staminali ematopoietiche lentivirali giova alla leucodistrofia metacromatica. Science 2013; 341(6148): 1233158.
- Niethammer M, et al: La terapia genica riduce i sintomi della malattia di Parkinson riorganizzando la connettività funzionale del cervello. Sci Transl Med 2018; 10(469): eaau0713.
- Heiss JD, et al: Prova di terapia genica putaminale guidata dalla risonanza magnetica per la malattia di Parkinson avanzata. Mov Disord 2019; 34(7): 1073-1078.
- Bainbridge JWB, et al: Effetto della terapia genica sulla funzione visiva nell’Amaurosi Congenita di Leber. N Engl J Med 2008; 358(21): 2231-2239.
- Bainbridge JWB, et al: Effetto a lungo termine della terapia genica sull’Amaurosi Congenita di Leber. N Engl J Med 2015; 372(20): 1887-1897.
- MacLaren RE, et al: Terapia genica retinica nei pazienti con coroideremia: risultati iniziali di uno studio clinico di fase 1/2. Lancet 2014; 383: 1129-1137.
- Xue K, et al: Effetti benefici sulla vista nei pazienti sottoposti a terapia genica retinica per la coroideremia. Nat Med 2018; 24(10): 1507-1512.
- Rakoczy EP, et al: Terapia genica con vettori adeno-associati ricombinanti per la degenerazione maculare neovascolare correlata all’età: follow-up di un anno di uno studio clinico randomizzato di fase 1. Lancet 2015; 386(10011): 2395-2403.
- Feuer WJ, et al: Terapia genica per la neuropatia ottica ereditaria di Leber: risultati iniziali. Oftalmologia 2015; 123(3): 558-570.
- Bouquet C, et al: Risposta immunitaria e infiammazione intraoculare nei pazienti con neuropatia ottica ereditaria di Leber trattati con l’iniezione intravitreale di virus ricombinante adeno-associato 2 portatore del gene ND4: un’analisi secondaria di uno studio clinico di fase 1/2. JAMA Ophthalmol 2019; 137(4): 399-406.
- Mendell JR, et al: Uno studio di fase 1/2a sulla terapia genica con follistatina per la distrofia muscolare di Becker. Mol Ther 2015; 23(1): 192-201.
- Mendell JR, et al: Terapia di sostituzione genica a dose singola per l’atrofia muscolare spinale. N Engl J Med 2017; 377(18): 1713-1722.
- Corti M, et al: La deplezione delle cellule B è protettiva contro la risposta immunitaria anti-capside dell’AAV: un caso di studio su un soggetto umano. Mol Ther Methods Clin Dev 2014; 1: 14033.
- Calcedo R, et al: Risposte delle cellule T di classe I a un peptide polimorfico in uno studio clinico di terapia genica per il deficit di α-1-antitripsina. Proc Natl Acad Sci U S A 2017; 114(7): 1655-1659.
- Mueller C, et al.: Espressione dell’anno e riparazione del difetto dei neutrofili dopo la terapia genica nel deficit di alfa-1 antitripsina. Mol Ther 2017; 25(6): 1387-1394.
- Tardieu M, et al: Terapia genica intracerebrale nei bambini con sindrome da mucopolisaccaridosi di tipo IIIB: uno studio clinico di fase 1/2 non controllato. Lancet Neurol 2017; 16(9): 712-720.
- Chien YH, et al: Efficacia e sicurezza della terapia genica AAV2 nei bambini con deficit di L-amminoacido decarbossilasi aromatica: uno studio di fase 1/2 in aperto. Lancet Child Adolesc Health 2017; 1(4): 265-273.
- Kassner U, et al.: Terapia genica nel deficit di lipoproteina lipasi: rapporto sul primo paziente trattato con Alipogene Tiparvovec in condizioni di pratica quotidiana. Hum Gene Ther 2018; 29(4): 520-527.
- Kojima K, et al: La terapia genica migliora la funzione motoria e mentale del deficit di L-aminoacido decarbossilasi aromatica. Brain 2019; 142(2): 322-333.
- Porter DL, et al: Cellule T modificate con il recettore dell’antigene chimerico nella leucemia linfoide cronica. N Engl J Med 2011; 365(8): 725-733.
- Savoldo B, et al: la stimolazione del CD28 migliora l’espansione e la persistenza delle cellule T modificate con il recettore dell’antigene chimerico nei pazienti affetti da linfoma. J Clin Invest 2011; 121(5): 1822-1826.
- Grupp SA, et al: Cellule T Chimeric Antigen Receptor-Modified per la leucemia linfoide acuta. N Engl J Med 2013; 368(16): 1509-1518.
- Yang G, Huang X: Metodi e applicazioni del sistema CRISPR/Cas per l’editing del genoma nelle cellule staminali. Cell Regen (Lond) 2019; 8(2): 33-41.
PRATICA GP 2020; 15(9): 6-10