Se si sospetta un’arterite a cellule giganti, è necessario procedere immediatamente a ulteriori chiarimenti e al trattamento. I sintomi tipici, come il mal di testa o il dolore alla masticazione e i disturbi visivi, possono essere assenti. La RZA oligosintomatica può essere diagnosticata con la diagnostica per immagini. La biopsia dell’arteria temporale è il gold standard diagnostico. L’antagonista del recettore dell’IL-6, tocilizumab (Actemra), è molto efficace nel trattamento dei pazienti refrattari agli steroidi e sarà utilizzato più frequentemente – e probabilmente anche come terapia di prima linea – in futuro.
Storicamente, consideriamo l’arterite a cellule giganti (RZA) come la malattia di Horton o arterite temporale, che è un’infiammazione autoimmune dell’arteria temporale. Possono verificarsi sintomi cranici come cefalea e dolore alla masticazione, disturbi visivi come la neuropatia ottica ischemica anteriore (AION) o addirittura ictus, accompagnati da una risposta infiammatoria sistemica. Questo è anche in linea con i criteri di classificazione della Società Americana di Reumatologia (ACR) per la RZA, stabiliti oltre 25 anni fa: età >50 anni, cefalea di nuova insorgenza, VES >40 mm/1h, anormalità dell’arteria temporale (polso assente, arteria indurita) ed evidenza di infiammazione transmurale nella biopsia dell’arteria temporale. Attenzione, questi criteri sono destinati alla classificazione dei pazienti a scopo di studio e non come criteri diagnostici.

Il caso 1 è un paziente tipico. Inoltre, questi pazienti possono manifestare altri sintomi ischemici, come dolore alla masticazione, cuoio capelluto sensibile, disturbi visivi (visione annebbiata, visione doppia). È possibile una concomitante polimialgia reumatica (PMR) e/o sintomi generali.
Tuttavia, con lo sviluppo e la maggiore disponibilità di metodi diagnostici come l’ecografia, la risonanza magnetica e la PET-CT, registriamo sempre più spesso pazienti con evidenza di vasculite dei grandi vasi senza coinvolgimento dell’arteria temporale e senza sintomi cranici. Questo amplia lo spettro delle malattie diagnosticate. Come illustrato nel caso 2, la presentazione clinica può variare in modo significativo. In particolare, i criteri ACR menzionati sono solo insufficientemente soddisfatti o non soddisfatti da molti di questi pazienti.
Chiarimento sull’arterite temporale “classica
Se un paziente si presenta al suo studio come il caso 1, la diagnosi di RZA è ovvia. Il trattamento rapido con cortisone ad alte dosi per prevenire la perdita visiva irreversibile o l’ictus è fondamentale in questa situazione. Se il paziente risponde rapidamente e bene a questi, spesso si è tentati di rinunciare a ulteriori diagnosi. Anche se questo può essere possibile senza problemi in alcuni casi, è consigliabile puntare a una diagnosi definitiva per diverse ragioni.
Insufficiente specificità di molti sintomi RZA: L’esempio spesso citato del paziente di 70 anni affetto da influenza dimostra che le mialgie, il mal di testa e/o una reazione infiammatoria non costituiscono ancora una vasculite. Anche l’eccellente risposta dei sintomi al trattamento con cortisone è suggestiva, ma non specifica per la RZA. La PMR, che condivide molti dei sintomi con la RZA, o altre malattie infiammatorie sistemiche, risponde anche a dosi più elevate di prednisone. Non sono rare le incertezze sulla diagnosi definitiva o sull’ulteriore corso d’azione. Purtroppo, la diagnostica è spesso improduttiva a questo punto, perché i pazienti sono già in trattamento con prednisone da molto tempo, il che rende l’interpretazione degli esami difficile o addirittura impossibile.
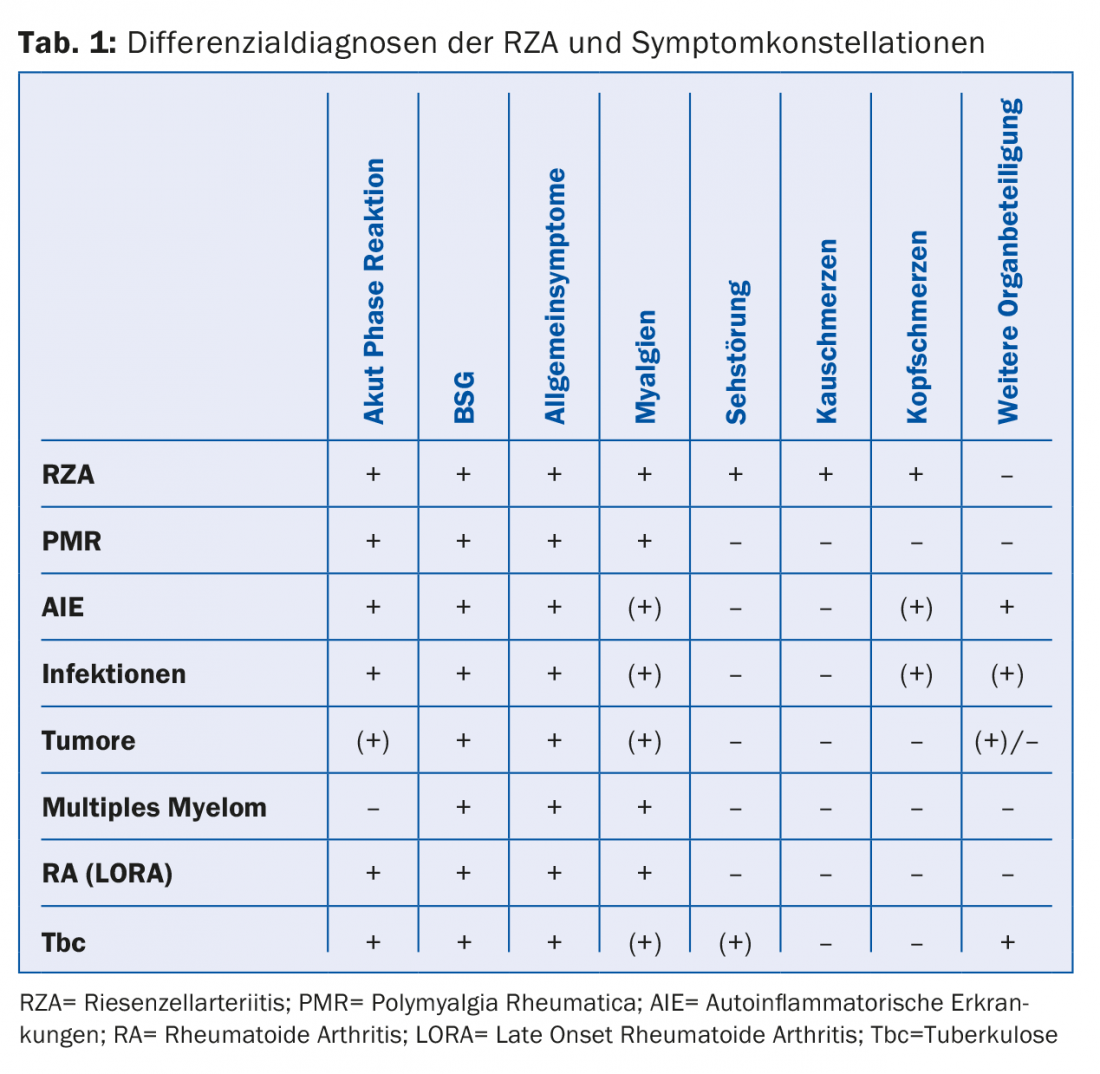
D’altra parte, dobbiamo evitare trattamenti cortisonici intensivi e inutilmente lunghi. In definitiva, l’esclusione di possibili diagnosi differenziali (Tab. 1) può essere costosa e non giustificata in tutti i casi.
Data la necessità di un rapido inizio della terapia in caso di sintomi cranici, l’ideale sarebbe effettuare ulteriori diagnosi entro 24 ore, poiché la sensibilità dei metodi di analisi diminuisce notevolmente dopo alcuni giorni di trattamento. Negli ospedali centrali vengono sempre più spesso istituite cliniche fast-track, alle quali i medici di base possono indirizzare i pazienti per una diagnosi rapida in caso di sospetto.
Esame ecografico: spesso viene eseguito un esame ecografico dell’arteria temporale. Questo ha un’ottima sensibilità (88%) e specificità (97%) per la diagnosi di arterite temporale [1]. Inoltre, le arterie carotidee e ascellari possono essere visualizzate nella stessa seduta, il che aumenta la sensibilità. Il rilevamento positivo della vasculite nella sonografia Doppler si basa solitamente sul rilevamento di una parete vasale ispessita ipoecogena, in contrasto con i cambiamenti iperecogeni focali dell’aterosclerosi. (Fig. 1A, B). I nuovi sviluppi tecnici delle macchine PET, TC e RM consentono ora di eseguire l’imaging delle arterie temporali, che può essere un ulteriore strumento diagnostico.
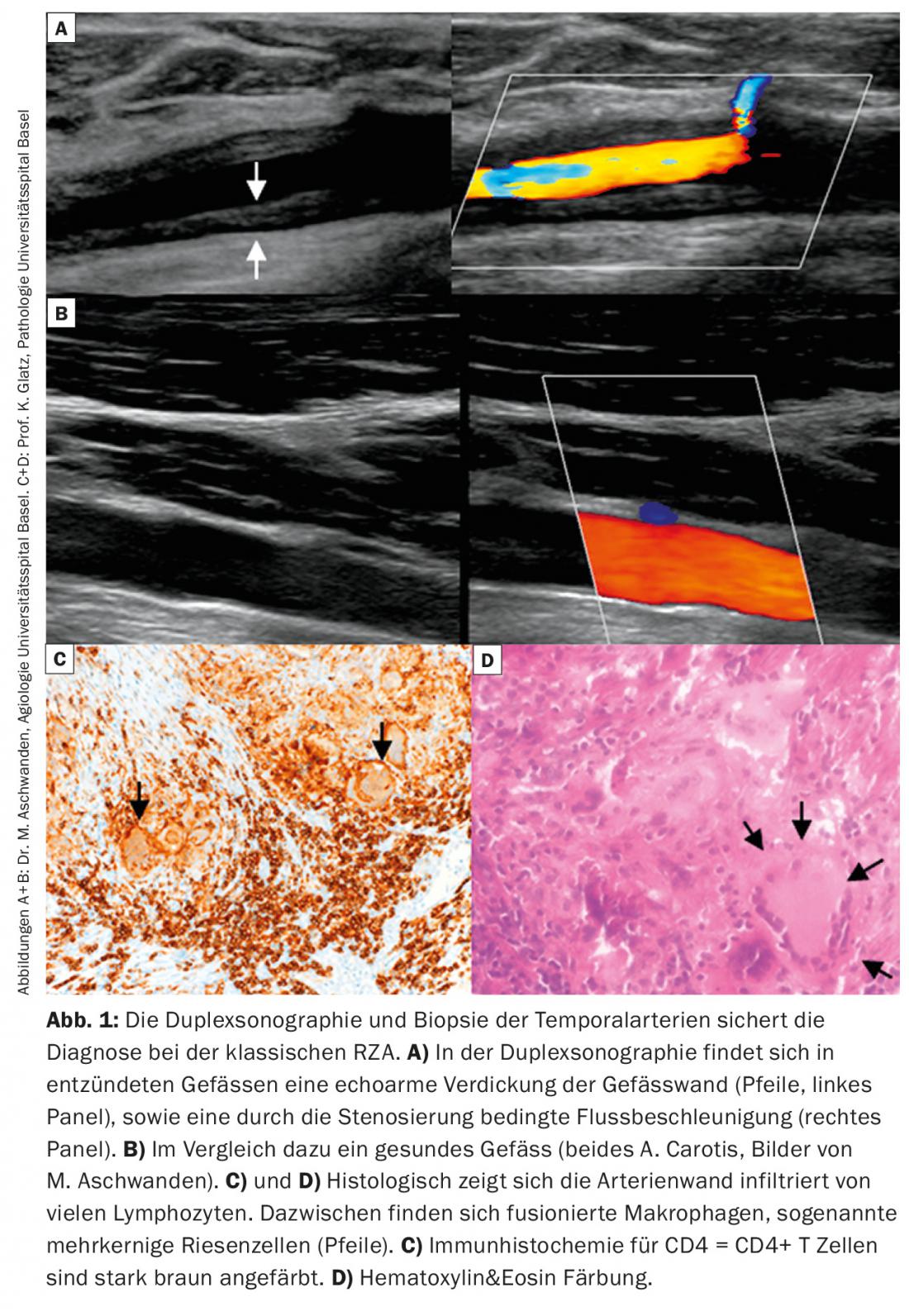
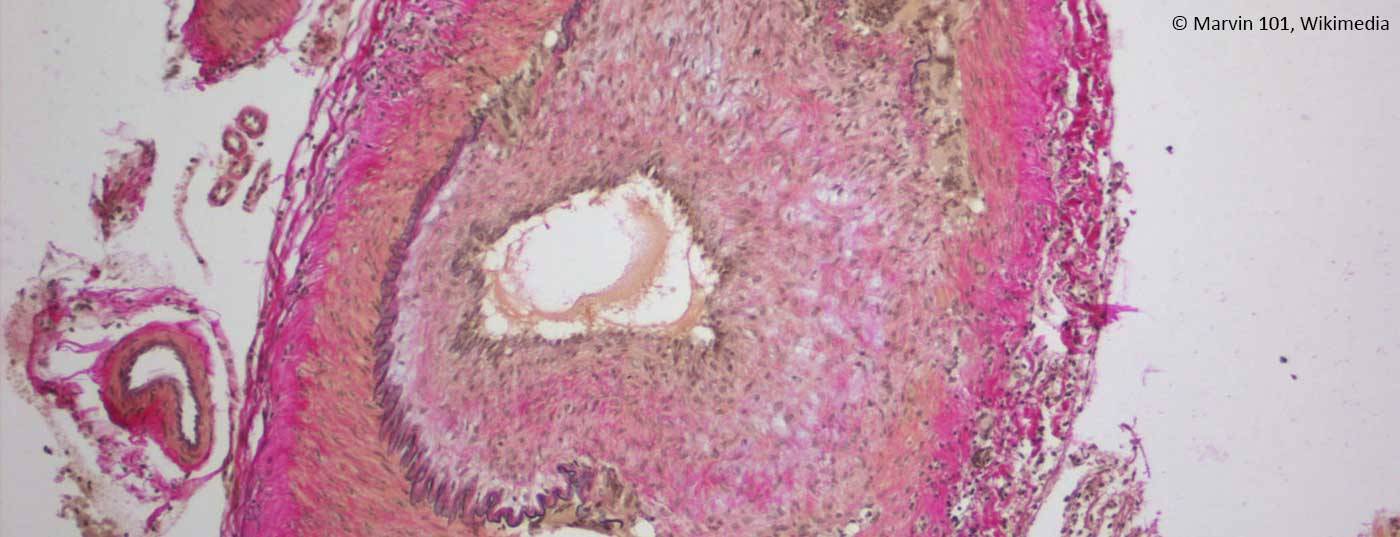
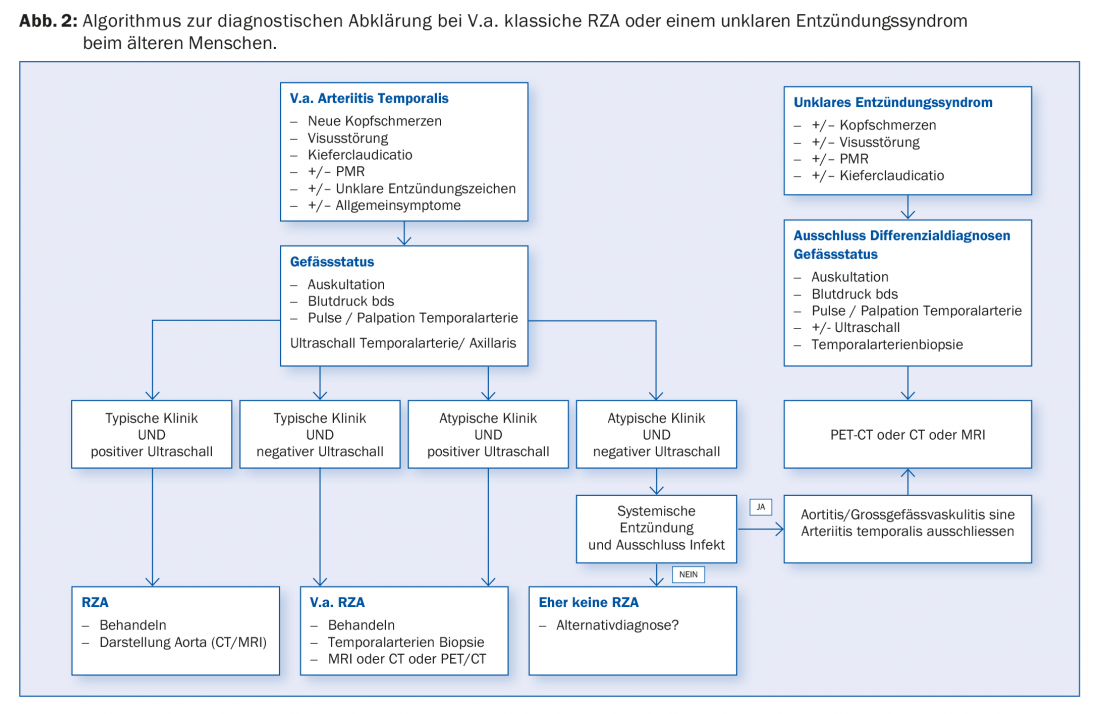
Conferma positiva della diagnosi: la conferma positiva della diagnosi mediante istologia fornisce la prova della presenza di RZA. Questo mostra un’infiltrazione di linfociti e macrofagi, che vagano per l’intera parete del vaso (Fig. 1C). Patognomonico è il rilevamento di cellule giganti; macrofagi fusi e multinucleati (Fig. 1D). Tuttavia, questi sono assenti in fino alla metà dei pazienti. Altri segni possono includere un’intima ispessita con restringimento del lume vascolare, frammentazione della lamina elastica interna o infiammazione nell’avventizia. Tuttavia, questi ultimi risultati sono indicativi di RZA solo se c’è una prova simultanea di un infiltrato infiammatorio. Se si verificano senza infiammazione, possono anche essere degenerativi legati all’età. Si deve anche notare che dopo 7 – 14 giorni di trattamento con prednisone, l’infiltrato infiammatorio scompare, portando a una biopsia ‘falsa negativa’. Attenzione, una biopsia negativa in una clinica tipica non esclude mai la diagnosi, poiché fino al 40% dei pazienti può avere una biopsia negativa. Poiché rimane una procedura invasiva (anche se piccola), si sta cercando di stabilire altri algoritmi diagnostici che rendano la biopsia non necessaria in alcuni scenari clinici (Fig. 2).
RZA oligosintomatica – un’importante diagnosi differenziale
Sempre più spesso, la diagnosi di RZA viene fatta in pazienti con infiammazione sistemica in primo piano – spesso solo dopo lunghe indagini. La diagnosi in questi pazienti è spesso determinata dalla diagnostica per immagini. L’imaging eseguito per la ricerca di un tumore/infezione o intenzionalmente per la ricerca di RZA rivelerà quindi i cambiamenti corrispondenti nell’aorta e nei suoi rami che suggeriscono la diagnosi (Fig. 2).
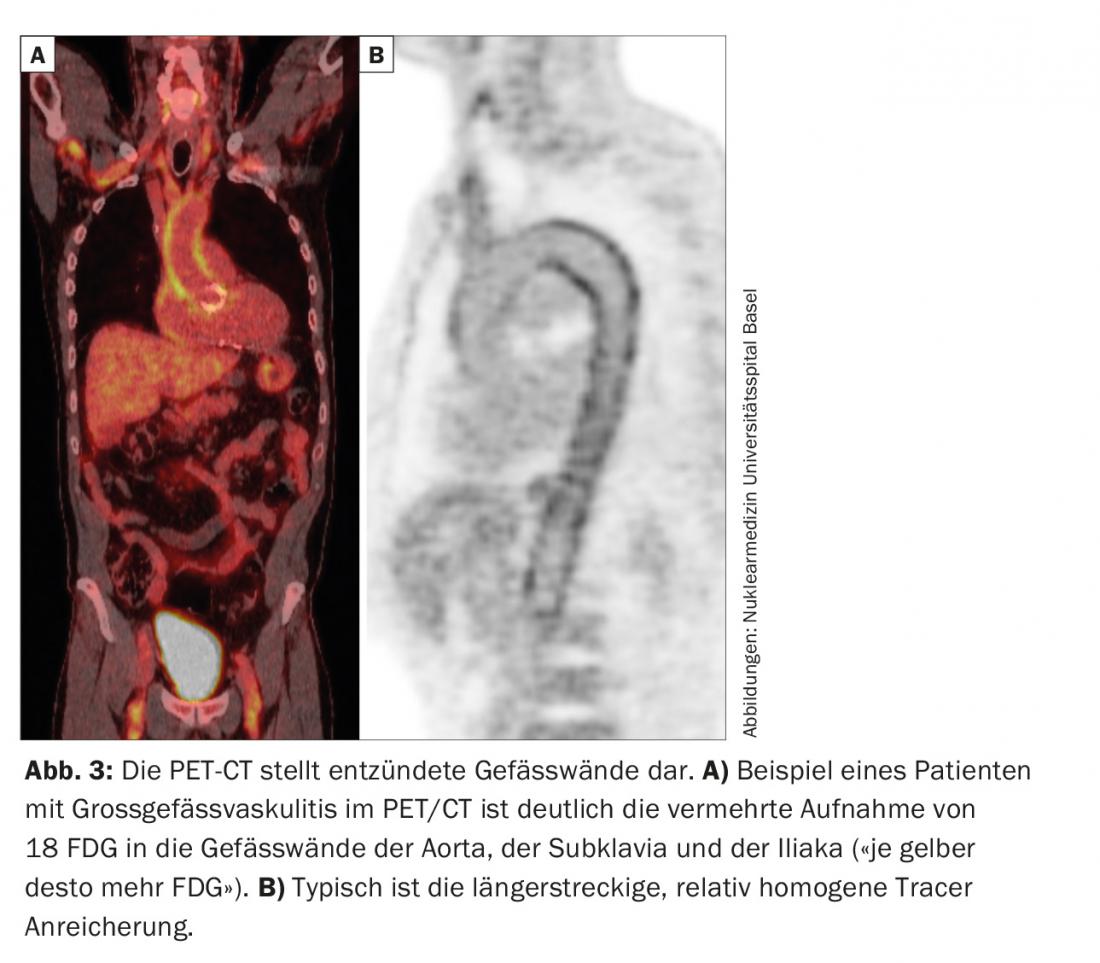
La RZA dovrebbe essere presa in considerazione nei pazienti anziani, con infiammazione sistemica e assenza di segni evidenti di infezione o malignità [2]. Anche se non lamentano mal di testa, perdita dell’acutezza visiva o dolore alla masticazione (vedere il caso di studio 2). Qui può essere eseguita anche una biopsia dell’arteria temporale. Nel caso positivo, la diagnosi viene confermata; nel caso negativo, non viene esclusa, poiché in assenza di “sintomi della testa” le arterie temporali non devono necessariamente essere infiammate. Per questo motivo si parla anche di vasculite dei grandi vasi. Diverse modalità di imaging (RM, PET, TAC) sono in grado di visualizzare l’infiammazione della parete vascolare. Questi possono manifestarsi come ispessimento della parete (ecografia), ad esempio con immagini di contrasto nella TAC. La PET mostra – tramite un tracciante di medicina nucleare – l’assorbimento del glucosio nel tessuto. L’infiammazione ha bisogno di più glucosio, ecco perché la parete di un vaso infiammato si illumina nella PET (Fig. 3) . Poiché l’imaging si basa sull’attività metabolica, l’esame PET è probabilmente vicino a una vera determinazione dell’attività. Questo è in contrasto con la TAC, la risonanza magnetica e l’ecografia, dove i cambiamenti cronici post-infiammatori sono talvolta difficili da distinguere dall’infiammazione attiva.
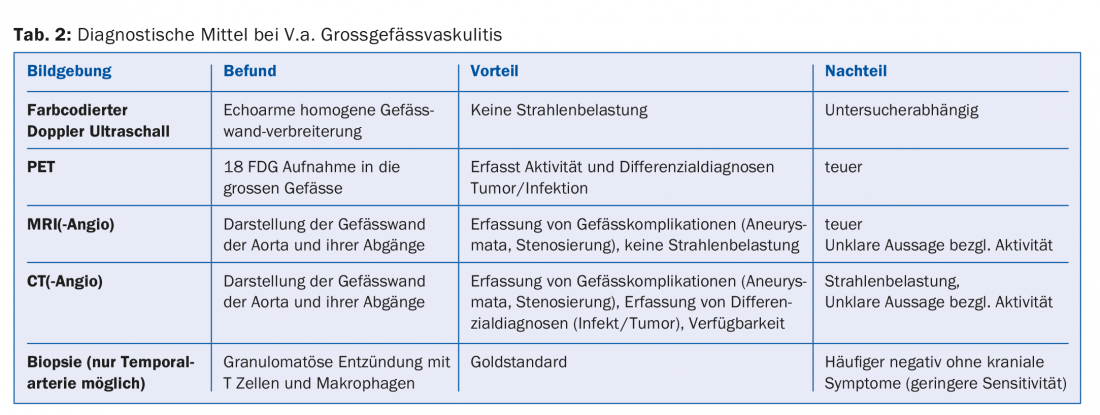
Un vantaggio dell’imaging dei grandi vasi è la visualizzazione simultanea di eventuali complicazioni vascolari preesistenti, come stenosi o aneurismi. Poiché la RZA è associata a un rischio significativamente aumentato di tali complicazioni vascolari, la diagnostica per immagini iniziale dei grandi vasi è generalmente raccomandata per ogni paziente RZA (Tab. 2). Anche in questo caso, la terapia è essenziale perché questi pazienti possono sviluppare complicanze ischemiche o aneurismatiche/stenotiche nel corso della malattia. Un work-up diagnostico suggerito per il sospetto di arterite a cellule giganti è illustrato nella Figura 2.
Trattamento prolungato ad alte dosi di prednisone
Gli steroidi sono ancora la base della terapia. La dose abituale utilizzata è di 1 mg/kg di peso corporeo, con un massimo di 60 mg al giorno raccomandato [1]. Fanno eccezione gli eventi ischemici gravi. Tra questi, ci sono i disturbi visivi/la cecità o addirittura un ictus vasculitico. In questo caso, inizialmente si utilizzano dosi più elevate sotto forma di terapia d’urto per prevenire un’ulteriore ischemia.
La dose di steroidi deve essere ridotta nel tempo, con l’obiettivo di arrivare a 5 mg dopo circa 6 mesi [1]. Durante questa fase, la clinica e i parametri infiammatori devono essere controllati regolarmente. Se ci sono prove di una ricaduta, la dose deve essere regolata di conseguenza. Più della metà dei pazienti ha una o più ricadute [3]. Pertanto, la terapia steroidea di mantenimento viene solitamente aggiunta come misura preventiva. Ci sono pochi dati sulla migliore durata e dose di questa terapia. In particolare, ad oggi non esistono fattori predittivi che permettano di identificare i pazienti che hanno un rischio maggiore di ricaduta. Nella maggior parte dei casi, il trattamento è con 5(-7,5) mg di prednisone per un altro anno fino a un massimo di 18 mesi [1,4].
L’aspetto negativo del controllo della malattia sono gli effetti collaterali degli steroidi. Sono estremamente comuni a causa dell’età e delle comorbidità, quindi quasi tutti i pazienti sviluppano almeno un problema. Tra questi, cataratta, fratture e infezioni (31%) sono i più comuni. Inoltre, spesso sono presenti ipertensione (22%) o diabete mellito (9%) [5].
Oltre al trattamento immunosoppressivo e al controllo degli effetti collaterali, sono raccomandate diverse altre misure profilattiche [1]. Presumibilmente, i pazienti hanno meno eventi ischemici con l’acido acetilsalicilico (ASA), motivo per cui l’EULAR raccomanda una terapia con ASA a basso dosaggio (75-150 mg/die). Se l’ASA e il cortisone sono combinati, deve essere prescritto un inibitore della pompa protonica. Inoltre, tutti i pazienti devono ricevere una profilassi dell’osteoporosi e, se necessario, una terapia. Di conseguenza, eseguiamo di routine una valutazione del rischio e una misurazione della densità ossea all’inizio della terapia.
Decorso refrattario alla terapia e trattamento delle recidive
Una recidiva è spesso seguita da una seconda. Gli aumenti ripetuti di cortisone portano poi a dosi cumulative elevate, che possono potenziare gli effetti collaterali e compromettere il sistema immunitario a lungo termine.
In una meta-analisi di studi randomizzati, finora solo il metotrexato ha dimostrato di essere un debole farmaco risparmiatore di steroidi. Negli ultimi anni, il tocilizumab (antagonista del recettore anti-IL6 Actemra®) si è affermato come terapia alternativa. Qui si sono verificati miglioramenti sorprendenti e rapidi nei pazienti refrattari [6]. Poiché l’IL-6 è anche lo stimolo principale per la produzione di proteine di fase acuta nel fegato, il blocco dell’IL-6 porta a una rapida normalizzazione della CRP e della VES.
Il blocco dell’IL6 annuncia una nuova era?
Ci sono nuovi dati sull’uso di tocilizumab nella terapia primaria. In uno studio randomizzato controllato presso l’Ospedale Universitario di Berna, è stato dimostrato che i pazienti che hanno ricevuto principalmente tocilizumab non hanno avuto quasi nessuna recidiva, nonostante una riduzione relativamente rapida della terapia con prednisone, con un chiaro effetto di risparmio di steroidi [7]. I dati di uno studio internazionale di registrazione per il trattamento iniziale con tocilizumab (GiACTA) giungono alla stessa conclusione, anche se i dati definitivi non sono attesi prima della fine del 2016. Si prevede che questo porterà a un uso più frequente e precoce di tocilizumab nei pazienti con RZA.
Va notato che la CRP viene soppressa con tocilizumab e le infezioni possono quindi essere mascherate. Pertanto, in questi pazienti, la chiarificazione e il trattamento precoci sono essenziali in caso di possibile infezione. Altri effetti collaterali includono l’innalzamento delle transaminasi e dei lipidi, nonché la neutropenia e la trombocitopenia, rare ma potenzialmente pericolose. Le perforazioni intestinali sono state osservate più frequentemente nei pazienti con diverticolite negli studi pivotal iniziali.
Letteratura:
- Mukhtyar C, et al: Raccomandazioni dell’EULAR per la gestione della vasculite dei grandi vasi. Ann Rheum Dis 2009; 68(3): 318-23.
- Muto G, et al: Vasculite dei grandi vasi nei pazienti anziani: diagnosi precoce e valutazione della risposta agli steroidi con FDG-PET/CT e TC con contrasto. Reumatologia Internazionale. 2014; 34(11):1545-54.
- Alba MA, et al: Recidive nei pazienti con arterite a cellule giganti: prevalenza, caratteristiche e risultati clinici associati in una coorte seguita longitudinalmente di 106 pazienti. Medicina (Baltimora) 2014; 93(5): 194-201.
- Weyand CM, et al: Pratica clinica. Arterite a cellule giganti e polimialgia reumatica. N Engl J Med 2014; 371(1): 50-7.
- Proven A, et al: Terapia con glucocorticoidi nell’arterite a cellule giganti: durata ed esiti avversi. Arthritis Rheum 2003; 49(5): 703-8.
- Osman M, et al: Il ruolo degli agenti biologici nella gestione della vasculite dei grandi vasi (LVV): una revisione sistematica e una meta-analisi. PLoS One 2014;9(12):e115026.
- Villiger PM, et al: Tocilizumab per l’induzione e il mantenimento della remissione nell’arterite a cellule giganti: uno studio di fase 2, randomizzato, in doppio cieco, controllato con placebo. Lancet 2016; 387(10031): 1921-7.
PRATICA GP 2016; 11(9): 22-26