L’istologia (resezione del tumore o biopsia) è essenziale per diagnosticare i gliomi di grado superiore e valutare la prognosi e la terapia. I marcatori molecolari servono come supplemento alla classificazione OMS per quanto riguarda il decorso previsto della malattia e la risposta terapeutica alla chemioterapia alchilante. La terapia standard per i pazienti di età inferiore a 65 o 70 anni consiste in una radioterapia e chemioterapia combinate con temozolomide (TMZ) concomitante e adiuvante. I pazienti di età superiore a 65 o 70 anni hanno un vantaggio di sopravvivenza con la chemioterapia con TMZ nel caso di un promotore MGMT metilato; senza un promotore MGMT metilato, si raccomanda la sola radioterapia. Negli oligodendrogliomi anaplastici e negli oligoastrocitomi con codelezione 1p/19q, c’è un vantaggio di sopravvivenza in caso di chemioterapia alchilante precoce (PCV o TMZ).
I gliomi anaplastici e i glioblastomi sono tra i tumori cerebrali maligni più comuni. Sono caratterizzate da una prognosi sfavorevole. La conferma istologica tramite biopsia chirurgica del tessuto è necessaria per stabilire la diagnosi. Per tutti i gliomi maligni, si dovrebbe puntare a un alto grado di resezione, per quanto possibile senza dover accettare un deficit neurologico permanente, a causa della prognosi più favorevole. I tumori cerebrali sono classificati nei gradi da I a IV secondo la classificazione dell’OMS (2007), basata su criteri anatomo-patologici. Lo scopo di questa classificazione è quello di fornire indicazioni sulla prognosi, sul decorso clinico e sulle opzioni terapeutiche basate sull’evidenza, in base al grado di malignità.
Marcatori molecolari
Negli ultimi anni, sono stati identificati dei marcatori molecolari che caratterizzano i sottotipi di glioma con prognosi e risposte diverse alle terapie. Un marcatore con valore prognostico informa sulla prognosi della malattia indipendentemente dalla terapia effettuata. Particolarmente importante per il processo decisionale clinico è un marcatore con valore predittivo che preveda la risposta a una particolare terapia.
- Codelezione 1p/19q: un marcatore molecolare strettamente associato ai tumori oligodendrogliali è la perdita combinata dei bracci cromosomici 1p e 19q (“perdita di eterozigosi”, LOH-1p/19q, codelezione 1p/19q).
- Promotore MGMT: un altro importante marcatore è lo stato di metilazione del promotore della O6-metilguanina-DNA metiltransferasi (MGMT). MGMT è una proteina di riparazione del DNA che riduce gli effetti della chemioterapia alchilante. Nel caso della metilazione del promotore, il gene MGMT viene espresso a un livello ridotto, migliorando così relativamente l’efficacia della chemioterapia alchilante. Un promotore MGMT metilato ha un valore prognostico favorevole per i gliomi di grado WHO III e IV e, a seconda del sottogruppo, è anche predittivo in termini di vantaggio di sopravvivenza in caso di chemioterapia alchilante.
- Mutazione IDH: un marcatore prognosticamente favorevole in tutte le gliomentalità è una mutazione nel gene dell’isocitrato deigenasi (IDH)-1 o -2. I pazienti con astrocitoma anaplastico senza mutazione IDH (IDH wild type) hanno una prognosi meno favorevole rispetto ai pazienti con glioblastoma con mutazione IDH [1]. Si ritiene che i glioblastomi IDH-mutati siano nati da tumori di grado II o III in termini di progressione maligna (glioblastomi secondari), a differenza dei glioblastomi primari, che sono caratterizzati da IDH wild-type e probabilmente rappresentano un’entità biologicamente diversa.
Di seguito, forniremo una panoramica delle attuali opzioni terapeutiche, tenendo conto della classificazione WHO, dei marcatori molecolari e dell’età dei pazienti; un percorso decisionale clinico suggerito è riassunto nelle Figure 1 e 2 .


Oligodendrogliomi anaplastici e oligoastrogliomi di grado WHO III
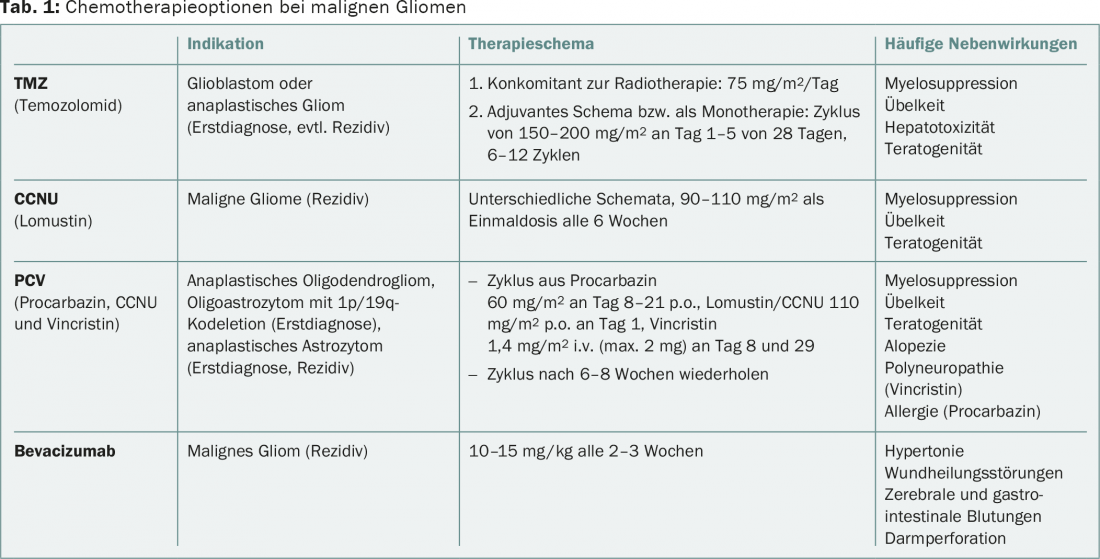
La presenza di una codelezione 1p/19q, strettamente associata alla mutazione IDH, è fondamentale per la decisione terapeutica nei gliomi anaplastici di origine oligodendrogliale. Questi pazienti traggono beneficio dalla combinazione di radioterapia e chemioterapia con procarbazina, lomustina (CCNU) e vincristina (regime PCV) alla diagnosi iniziale rispetto alla sola radioterapia, secondo il follow-up a lungo termine degli studi RTOG-9402 e EORTC-26951 [2,3]. I dati dello studio NOA-04 mostrano la stessa efficacia dei regimi con PCV resp. con temozolomide (TMZ) nei gliomi anaplastici nel complesso. A causa della tossicità del regime PCV, spesso viene preferita la TMZ, meglio tollerata. Che la sola chemioterapia alchilante sia equivalente alla combinazione diretta di chemioterapia e radioterapia come terapia di prima linea è piuttosto improbabile se si considerano i dati disponibili. In caso di sola chemioterapia alla diagnosi iniziale, la radioterapia deve essere somministrata in caso di progressione del tumore. Inoltre, non esistono raccomandazioni terapeutiche standardizzate per la recidiva del tumore. Si possono applicare anche le opzioni per il glioblastoma (Tab. 1).
Astrocitomi anaplastici, grado OMS III
Secondo lo studio NOA-04, per la terapia di prima linea, la chemioterapia con TMZ o PCV seguita da radioterapia alla ricaduta è equivalente alla radioterapia primaria seguita da TMZ o PCV alla ricaduta. Per i pazienti con glioma anaplastico senza codelezione 1p/19q, il ruolo della chemioterapia con TMZ in aggiunta alla radioterapia nel trattamento di prima linea è attualmente oggetto di uno studio di fase III (studio CATNON). La codelezione 1p/19q, la metilazione del promotore MGMT e la mutazione IDH sono biomarcatori prognostici e possono essere utili per differenziare i tumori oligodendrogliali (1p/19q) e i glioblastomi (IDH). Inoltre, nei gliomi anaplastici senza mutazione IDH, un promotore MGMT metilato è predittivo di una prolungata sopravvivenza libera da progressione in caso di chemioterapia alchilante con o senza radioterapia. Per la recidiva del tumore dopo la radioterapia e la chemioterapia con TMZ o PCV, non esistono raccomandazioni affidabili; le opzioni sono analoghe a quelle per la recidiva del glioblastoma.
Glioblastoma, grado OMS IV
I fattori prognostici sfavorevoli nei glioblastomi sono l’età avanzata, il cattivo stato di Karnofsky-Perfomance, la bassa estensione della resezione, l’assenza di mutazione IDH e un promotore MGMT non metilato. La radioterapia con chemioterapia concomitante e adiuvante con TMZ, che si è affermata dopo lo studio EORTC-NCIC, continua ad essere considerata come terapia di prima linea [4]. La metilazione del promotore MGMT è anche predittiva di una buona risposta alla radiochemioterapia. Per i pazienti anziani di età superiore a 65 o 70 anni senza stratificazione in base al profilo molecolare, finora non è stato dimostrato alcun vantaggio clinicamente rilevante della radiochemioterapia combinata, vista l’elevata tossicità del regime nei pazienti anziani. Per i pazienti anziani con promotore MGMT metilato, è stato dimostrato un beneficio di sopravvivenza con la monoterapia con TMZ rispetto alla radioterapia [5,6]. Senza conoscere lo stato di MGMT o nel caso di un promotore MGMT non metilato, la terapia di scelta nei pazienti anziani è la sola radioterapia con un protocollo ipofrazionato (10× 3,4 Gy), che è equivalente o forse addirittura superiore alla radioterapia convenzionalmente frazionata [6].
Bevacizumab, un anticorpo contro il fattore di crescita endoteliale vascolare (VEGF), non ha mostrato alcun effetto sulla sopravvivenza globale in due studi randomizzati di fase III [7,8].
I risultati dello studio di fase III EF-14 sono stati presentati alla fine del 2014. Ha dimostrato un beneficio di sopravvivenza di 19,6 vs. 16,6 mesi con l’aggiunta di NovoTTF-100A (Tumour Treating Fields) alla terapia standard [9]. La terapia consiste in campi elettrici alternati applicati alla testa attraverso una maschera per almeno 18 ore al giorno. Il valore di NovoTTF per la terapia di prima linea del glioblastoma nella pratica clinica è attualmente oggetto di discussione nei circoli di esperti e presso le autorità regolatorie.
In caso di progressione del tumore, le opzioni terapeutiche sono limitate, non standardizzate e poco basate sull’evidenza. Una nuova resezione può essere utile nei pazienti giovani con una buona condizione generale e una localizzazione favorevole del tumore. Le chemioterapie comprendono i nitrosoureas come la lomustina/CCNU, la TMZ o il bevacizumab (scheda 1). Ulteriori informazioni si trovano nelle linee guida dell’Associazione Europea di Neuro-Oncologia (EANO) [10].
Terapie di supporto
Oltre alla terapia specifica per il tumore, l’uso ottimale di corticosteroidi, farmaci anticonvulsivanti e supporto psico-oncologico è molto importante per la gestione dei gliomi. Gli steroidi (desametasone fino a un massimo di 16 mg come dose singola al mattino) possono essere utili in caso di deterioramento clinico o pressione intracranica e durante la radioterapia. Per evitare effetti collaterali, si deve puntare ad un uso limitato nel tempo, a seconda della clinica. Per la terapia anticonvulsivante, sono preferibili sostanze non enzimatiche come il levetiracetam o la lamotrigina. Molto potente nella profilassi delle crisi epilettiche è anche l’acido valproico, inibitore enzimatico, per il quale si stanno discutendo anche effetti antitumorali diretti.
Prospettiva
Negli attuali studi clinici, gli approcci immunoterapeutici sono particolarmente promettenti. Gli studi di vaccinazione utilizzano vaccini con molecole bersaglio specifiche del tumore, ad esempio la variante del recettore EGFR EGFRvIII (studio ACT-IV, fase III) o con combinazioni di antigeni associati al tumore (studio ICT-107, fase II), oppure approcci basati sulle cellule, comprese le cellule dendritiche attivate. Tra le terapie immunomodulanti, sono particolarmente degni di nota gli inibitori della via di segnalazione della morte programmata-1 o del suo ligando. Nonostante i progressi nella comprensione della biologia molecolare del glioblastoma, è necessario un ulteriore sviluppo di terapie traslazionali di successo per migliorare le opzioni terapeutiche ancora limitate.
Letteratura:
- Hartmann C, et al.: Sopravvivenza a lungo termine nel glioblastoma primario con e senza mutazioni dell’isocitrato deidrogenasi. Clin Cancer Res 2013; 19(18): 5146-5157.
- van den Bent MJ, et al: Chemioterapia adiuvante con procarbazina, lomustina e vincristina nell’oligodendroglioma anaplastico di nuova diagnosi: follow-up a lungo termine dello studio 26951 dell’EORTC Brain Tumor Group. Journal of Clinical Oncology 2013; 31(3): 344-350.
- Cairncross G, et al: Studio di fase III sulla chemioradioterapia per l’oligodendroglioma anaplastico: risultati a lungo termine di RTOG 9402. J Clin Oncol 2013; 31(3): 337-343.
- Stupp R, et al: Radioterapia più temozolomide concomitante e adiuvante per il glioblastoma. N Engl J Med 2005; 352(10): 987-996.
- Wick W, et al: Temozolomide da sola chemioterapia rispetto alla sola radioterapia per l’astrocitoma maligno negli anziani: lo studio randomizzato di fase 3 NOA-08. Lancet Oncol 2012; 13(7): 707-715.
- Malmström A, et al: Temozolomide versus radioterapia standard di 6 settimane versus radioterapia ipofrazionata in pazienti di età superiore a 60 anni con glioblastoma: lo studio randomizzato nordico di fase 3. Lancet Oncol 2012; 13(9): 916-926.
- Chinot OL, et al: Bevacizumab più radioterapia-temozolomide per il glioblastoma di nuova diagnosi. N Engl J Med 2014; 370(8): 709-722.
- Gilbert MR, et al: Uno studio randomizzato sul bevacizumab per il glioblastoma di nuova diagnosi. N Engl J Med 2014; 370(8): 699-708.
- Stupp R, et al: Analisi intermedia NT-40 dello studio EF-14: uno studio prospettico multicentrico di NovoTTF-100A insieme a Temozolomide rispetto a Temozolomide da solo in pazienti con GBM di nuova diagnosi. Neuro-Oncologia 2014; 16 (suppl. 5): v167.
- Weller M, et al: Linea guida EANO per la diagnosi e il trattamento dei gliomi anaplastici e del glioblastoma. Lancet Oncol 2014; 15(9): e395-403.
InFo ONCOLOGIA & EMATOLOGIA 2015; 3(3-4): 24-27