Diversi studi hanno recentemente portato a un ampliamento delle indicazioni per la terapia di risincronizzazione cardiaca. Il desiderio di evitare elettrodi intravascolari collegati a un dispositivo sottocutaneo ha portato allo sviluppo di ICD impiantabili sottocute e di pacemaker senza sonda, erogati tramite catetere. Mentre i primi sono già utilizzati nella pratica clinica quotidiana, dopo un’attenta selezione dei pazienti, i secondi sono utilizzati solo nel contesto degli studi. Sono in corso sforzi per sviluppare un sistema completo a due o tre camere senza conduttori elettrici. Le complicazioni da infezione dopo l’impianto e la modifica di un dispositivo cardiaco sono un problema temuto. Le fasce per dispositivi rivestite di antibiotici sono un approccio promettente per ridurre il tasso di infezione. Tuttavia, sono necessari ulteriori studi su questo aspetto e sulla somministrazione sistemica di antibiotici peri-intervento.
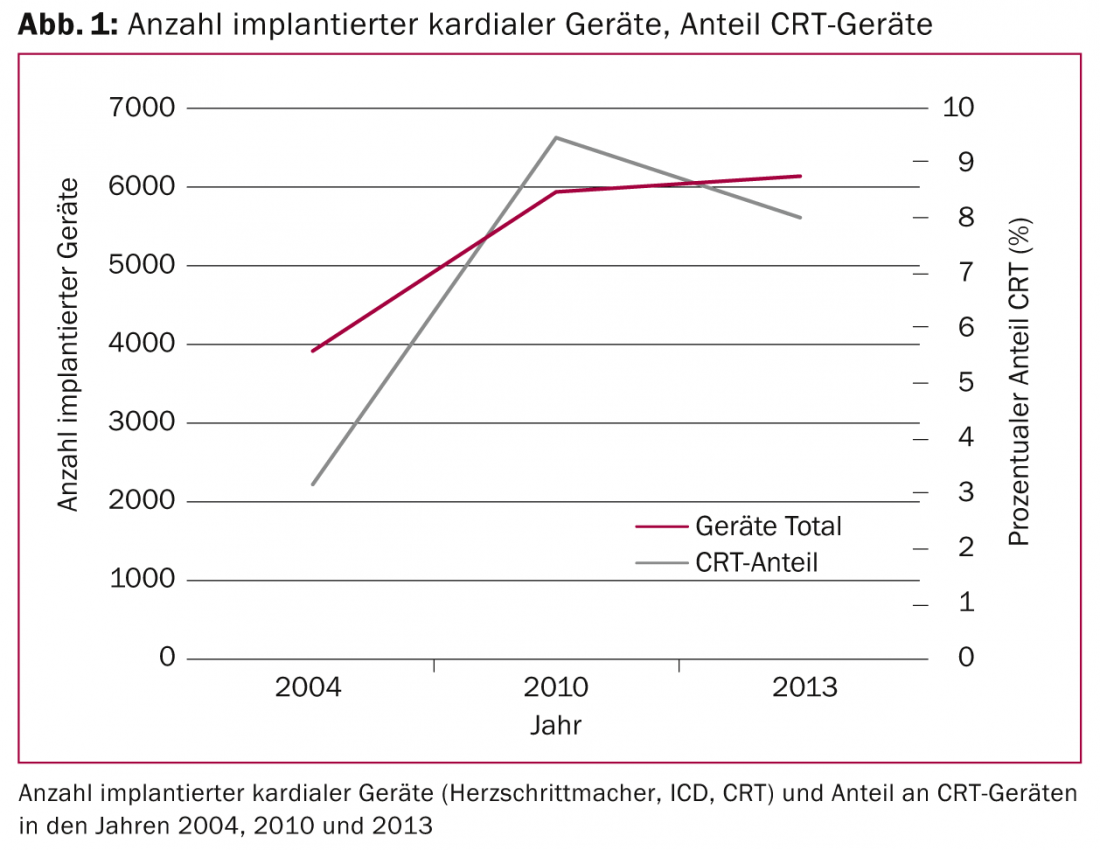
Le indicazioni per l’impianto di dispositivi cardiaci (pacemaker convenzionali, defibrillatori impiantabili [ICD] e sistemi di pacemaker biventricolari) si sono ampliate negli ultimi dieci anni grazie alle nuove scoperte, soprattutto nel campo della terapia di risincronizzazione cardiaca (CRT). Mentre nel 2004 in Svizzera sono stati impiantati poco meno di 4000 dispositivi cardiaci, questa cifra è cresciuta fino a ben 6000 dispositivi nel 2013. La quota dei dispositivi CRT è triplicata tra il 2004 e il 2010 (Fig. 1) .
Una pietra miliare tecnica è stata l’introduzione dell’ICD sottocutaneo e la dimostrazione della fattibilità/sicurezza della stimolazione senza fili. Tuttavia, mentre queste nuove tecnologie si stanno facendo strada solo gradualmente nella pratica clinica di routine, l’esecuzione di esami di risonanza magnetica in pazienti con dispositivi non compatibili con la risonanza magnetica o la prevenzione di infezioni del dispositivo sono sfide frequenti nella pratica clinica quotidiana, che verranno affrontate brevemente in questo articolo di revisione.
Selezione del paziente per la terapia di risincronizzazione cardiaca
Nel campo della CRT, negli ultimi anni sono stati condotti e pubblicati numerosi studi interessanti. Lo studio di estensione CARE-HF ha dimostrato una riduzione significativa del rischio relativo di mortalità per tutte le cause del 40% (riduzione assoluta dal 38,1 al 24,7%) entro tre anni con la CRT nei pazienti con insufficienza cardiaca grave trattata in modo ottimale (NYHA III/IV), LVEF ≤35% e un complesso QRS allargato. Nei pazienti con insufficienza cardiaca lieve (NYHA I/II) e un’indicazione primaria di ICD profilattico, la CRT aggiuntiva non ha ridotto l’endpoint primario composito nello studio REVERSE, ma ha ridotto i ricoveri ospedalieri legati all’insufficienza cardiaca e ha influenzato favorevolmente la geometria del ventricolo sinistro con un aumento significativo della frazione di eiezione. La mortalità annuale nel follow-up a 5 anni pubblicato di recente è stata sorprendentemente bassa, pari al 2,9%, il che spiega almeno in parte la mancanza di influenza della terapia su questo endpoint nei 610 pazienti inclusi . L’analogo studio RAFT ha confrontato la terapia CRT-ICD con la sola terapia ICD e ha riscontrato una riduzione significativa dell’endpoint primario di mortalità per tutte le cause e di ospedalizzazione legata all’insufficienza cardiaca nei pazienti con insufficienza cardiaca NYHA II/III. Considerati insieme, questi due lavori suggeriscono che anche i pazienti con insufficienza cardiaca più lieve traggono beneficio dalla CRT. Un’ulteriore espansione della CRT potrebbe anche derivare in futuro dai risultati positivi dello studio HF a blocchi pubblicato di recente, in cui i pazienti con indicazione al pacemaker a causa di un’aritmia lenta hanno beneficiato della CRT rispetto alla terapia con pacemaker convenzionale, indipendentemente dalla loro classe NYHA, se la funzione di pompa ventricolare sinistra era inferiore al 50%.
Il fatto che i pazienti con un’ampiezza del QRS <120 ms possano avere un’evidenza ecocardiografica di dissincronia e che alcuni studi monocentrici abbiano dimostrato un beneficio nei sintomi dell’insufficienza cardiaca dalla CRT in questi pazienti, ha portato all’idea di estendere il concetto di CRT ai pazienti con un QRS relativamente stretto. Tuttavia, i due studi multicentrici randomizzati e controllati LESSER-EARTH ed EchoCRT hanno dimostrato non solo l’assenza di benefici in termini di sopravvivenza della CRT rispetto alla sola terapia con ICD, ma anche un eccesso di mortalità nel gruppo CRT (EchoCRT), per cui la CRT è ora una controindicazione nei pazienti con un QRS <120 ms senza un’indicazione di pacemaker.
L’aspetto negativo dell’aumento delle indicazioni della CRT è certamente il tasso di complicanze più elevato dei dispositivi CRT rispetto ai dispositivi ICD. In un’analisi multivariabile, l’impianto di CRT-D è stato associato a un rischio di complicanze di 2,2 volte maggiore entro 45 giorni dall’impianto rispetto all’impianto di ICD monocamerale [1], e l’impianto di CRT-D è un fattore di rischio indipendente per le revisioni del dispositivo rispetto al solo impianto di ICD.
Stimolazione LV multisito
La diminuzione della risposta alla CRT può essere osservata con l’aumento della cicatrizzazione LV, della cicatrizzazione posterolaterale o della dissincronia meccanica estrema [2]. Le aree cicatriziali hanno proprietà di conduzione elettrica sfavorevoli e la stimolazione in un’area cicatriziale miocardica è quindi indesiderabile. Gli studi TARGET e STARTER dimostrano che il posizionamento mirato della sonda LV nei segmenti miocardici eccitati tardivi identificati ecocardiograficamente può influenzare favorevolmente la prognosi [2]. Le sonde LV multipolari con più vettori di stimolazione tra cui scegliere possono offrire dei vantaggi a questo proposito, in quanto i segmenti miocardici vitali e/o le aree eccitate tardivamente possono essere stimolati in modo specifico anche dopo l’impianto della sonda LV (multipolare) attraverso una programmazione appropriata. Inoltre, la possibile stimolazione frenica può essere aggirata cambiando il vettore di stimolazione. I vantaggi teorici sono convincenti e resta da vedere se i pochi dati disponibili che confermano questo concetto si consolideranno anche in studi più ampi.
può.
ICD sottocutaneo
I sistemi ICD transvenosi sviluppati negli anni ’80 richiedono elettrodi complessi che devono svolgere sia la funzione di rilevamento/pacing che quella di defibrillatore. Non sorprende quindi che, nonostante le tecnologie innovative, questi elettrodi siano soggetti a difetti, come ci hanno dimostrato gli elettrodi Medtronic SprintFidelis o SJM Riata. In uno studio tedesco monocentrico su 990 pazienti con ICD, il 15% ha avuto problemi agli elettrodi durante il follow-up (mediana di 2,5 anni) [3], 56 difetti di isolamento, 12 fratture di elettrodi e il 31% altri problemi come perdita di cattura, problemi di rilevamento o di impedenza. Anche se queste cifre elevate non hanno potuto essere confermate in uno studio multicentrico in cui il tasso di revisioni degli elettrodi a 5 anni è stato del 2,5% [4], non c’è dubbio che il maggior punto debole di un ICD sia l’elettrodo. È quindi allettante poter offrire una protezione antitachicardica senza le difficoltà associate agli elettrocateteri transvenosi; questo approccio è stato reso almeno parzialmente possibile dall’introduzione dell’S-ICD, che non richiede un elettrocatetere intravenoso (Fig. 2) .
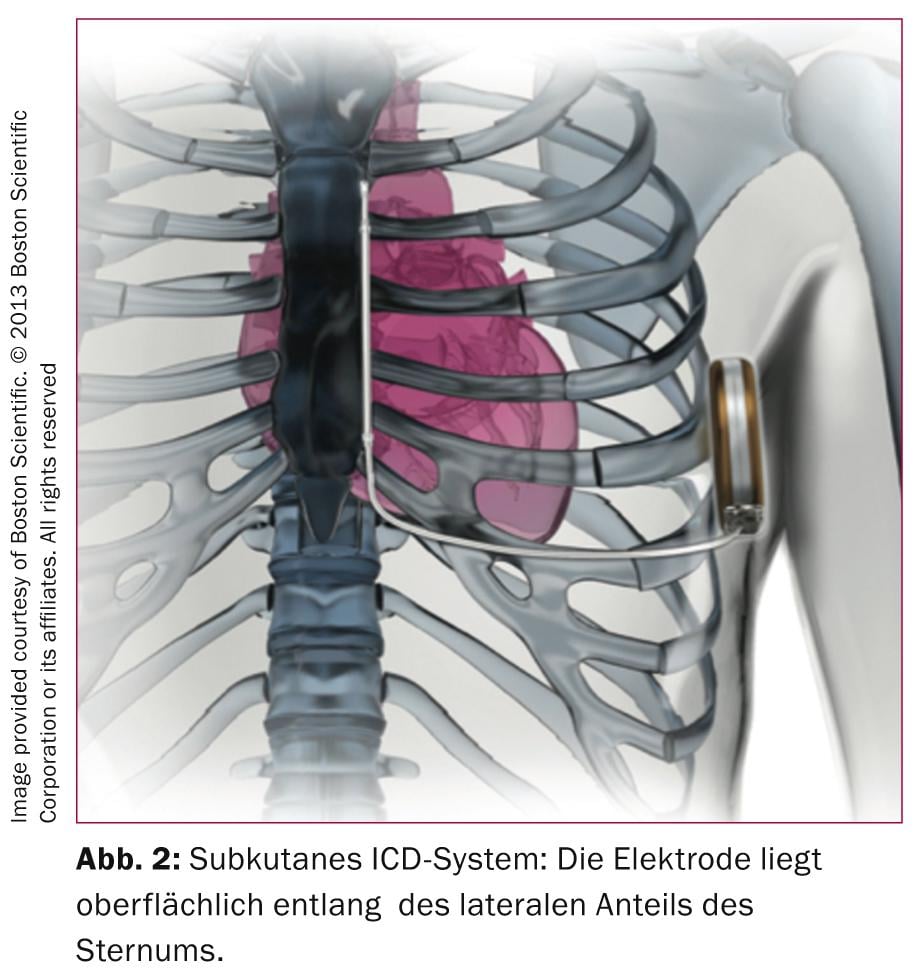
L’assenza di un elettrodo intravascolare presenta dei vantaggi al momento dell’impianto del dispositivo (riduzione della dose di radiazioni X) e previene futuri problemi agli elettrodi con estrazioni complicate eventualmente necessarie. Lo svantaggio dell’S-ICD è che in assenza di un elettrocatetere intracardiaco, il rilevamento della fibrillazione ventricolare può essere difficile, motivo per cui l’ECG di superficie deve essere analizzato in dettaglio prima di impiantare un S-ICD. Tuttavia, secondo i dati del registro più completo pubblicato finora [5], il tasso di shock inappropriati è del 7%, cioè rispetto ai sistemi ICD convenzionali, il tasso di shock ICD ingiustificati è piuttosto basso [6]. La stimolazione antitachicardica per sovrastimolare la tachicardia ventricolare non è possibile con i sistemi sottocutanei (o non sarebbe tollerata dai pazienti), motivo per cui questi sistemi tendono ad essere utilizzati meno nei pazienti con malattia coronarica o cardiomiopatia non ischemica e le indicazioni principali sono i pazienti con disturbi dei canali ionici, cardiomiopatia ipertrofica o pazienti dopo infezioni da ICD con sistemi transvenosi. Infine, per terminare la tachicardia/fibrillazione ventricolare è necessario un picco di corrente più forte, caricando il condensatore a 80 J, il che richiede un dispositivo più grande. Nei singoli casi, è quindi necessario valutare criticamente i vantaggi e gli svantaggi prima di impiantare un S-ICD.
Stimolazione senza elettrocateteri
Molte complicazioni dell’impianto di dispositivi sono dovute al fatto che gli elettrodi devono essere inseriti e ancorati intravascolari nel cuore e sono sottoposti a uno stress meccanico costante per tutta la vita del paziente. Pertanto, un modo senza sonda per stimolare il cuore è molto interessante. Nello studio LEADLESS, il sistema di pacemaker senza fili Nanostim™ sviluppato da Nanostim (acquisito da St. Jude Medical) è stato testato per la prima volta su 33 pazienti ed è risultato fattibile e sicuro. Medtronic ha sviluppato un sistema simile (Micra™ Transcatheter Pacing System), che può anche essere ancorato all’apice del ventricolo destro tramite un catetere orientabile dall’inguine. La batteria di questo sistema ha una durata prevista di circa otto anni. Sono in corso sforzi tecnici per consentire la comunicazione tra diversi piccoli pacemaker posizionati nell’atrio destro e in entrambi i ventricoli, aprendo la strada a sistemi bicamerali e tricamerali senza fili. Se questi sistemi dovessero diffondersi in futuro , e siamo convinti che lo faranno, cambieranno notevolmente la nostra tecnica di impianto, in quanto tali sistemi devono essere inseriti da inguinale in un laboratorio di elettrofisiologia/cateterismo cardiaco e gli attuali cateteri, che non sono ancora in commercio, hanno un diametro compreso tra 18 e 23 F. In mani inesperte, questo porta inevitabilmente a complicazioni e pone nuove sfide alla logistica ospedaliera.
Risonanza magnetica nei pazienti con dispositivi cardiaci
Si stima che fino al 75% dei pazienti con pacemaker riceverà un’indicazione per una risonanza magnetica nel corso della sua vita. Questa realizzazione è presa in considerazione da un numero crescente di dispositivi compatibili con la risonanza magnetica di diversi produttori, che spesso e volentieri vengono impiantati nella vita quotidiana. Nonostante la crescente popolarità di questi dispositivi, nella pratica clinica quotidiana si presenta spesso il problema di un esame RM desiderato nei pazienti con sistemi esistenti non compatibili con la RM. In questi casi, un esame di risonanza magnetica di solito non è fattibile. Sebbene vi siano prove crescenti che gli esami di risonanza magnetica hanno relativamente poche complicanze anche in questi pazienti, la FDA statunitense e i produttori di dispositivi considerano tutti gli ICD e la maggior parte dei pacemaker come controindicazioni all’esame di risonanza magnetica. Tuttavia, secondo le ultime linee guida ESC [7], dopo l’esclusione dei pazienti con dispositivi appena impiantati o elettrodi non collegati a sinistra (frammenti), un esame RM è giustificabile in caso di assoluta necessità (nessuna procedura di imaging a fette alternativa) dopo un’attenta valutazione del rischio/beneficio, anche nei pazienti senza dispositivi idonei alla RM e può essere eseguito a 1,5 Tesla con un basso rischio di complicanze, a condizione che sia stata effettuata una preparazione adeguata.
Riduzione del rischio di infezione durante l’impianto di un dispositivo.
L’infezione è probabilmente la complicanza più temuta dell’impianto di un dispositivo ed è associata a costi economici elevati e a un aumento della mortalità. I fattori di rischio per le infezioni da dispositivi sono i reinterventi, la febbre e/o la mancanza di profilassi antibiotica delle infezioni [8]. È interessante notare che fino a un terzo delle logge o degli elettrodi dell’ICD sono colonizzati battericamente durante la sostituzione dell’ICD [9], il che potrebbe essere correlato all’aumento del rischio di infezione dopo i reinterventi. L’unico studio randomizzato controllato che ha confrontato la somministrazione di antibiotici periinterventistici rispetto al placebo prima dell’impianto di pacemaker ha dovuto essere interrotto prematuramente dopo aver reclutato due terzi dei pazienti previsti, a causa del chiaro vantaggio della somministrazione di antibiotici [10]. In uno studio di registro prospettico pubblicato di recente, è stato dimostrato che la somministrazione aggiuntiva di antibiotici post-operatori per quattro giorni porta a un’ulteriore riduzione significativa delle infezioni del dispositivo sia negli interventi iniziali che nelle ri-operazioni [11]. Inoltre, sono disponibili pochi dati, ma promettenti, per una rete antibiotica assorbibile recentemente disponibile (Fig. 3) [12].

Questa rete, autoassorbita dopo nove settimane e rivestita con minociclina e rifampicina , è stata in grado di ridurre significativamente il tasso di infezione dal 3 allo 0,9% in una popolazione di pazienti selezionati rispetto a un controllo storico ed è particolarmente efficace nei pazienti ad alto rischio di infezione [12]. Ulteriori studi sono necessari e in corso (studio CITADEL/CENTURION).
Prospettiva
Le innovazioni tecniche mostrano lo sforzo crescente di allontanarsi dagli elettrodi inseriti per via transcutanea, che si tratti di ICD sottocutanei o di stimolazione senza sonda. Poiché mancano ancora grandi numeri di impianti e i dati endpoint devono prima confermare i promettenti risultati preliminari, resta da vedere se e quanto rapidamente queste nuove tecnologie troveranno spazio nell’uso clinico quotidiano. Per quanto riguarda la riduzione dei tassi di infezione, soprattutto dopo il cambio dei tachidermi, abbiamo urgentemente bisogno di nuovi studi che indaghino sulla somministrazione di antibiotici peri- e post-operatori. Sono state pubblicate prove retrospettive per l’antibiotico prolungato e i dati positivi delle fasce imbevute di antibiotico supportano il concetto di antibiotico prolungato per prevenire l’infezione.
Dr. med. Dr. scient. Roman Brenner, MD
David Altmann, MD
Prof. Dr. med. Peter Ammann
Letteratura:
- Lee DS, et al: Valutazione delle complicanze precoci legate all’impianto di un defibrillatore cardioverter De Novo, intuizioni dal database ICD dell’Ontario. J Am Coll Cardiol 2010; 55(8): 774-782.
- Leyva F, Nisam S, Auricchio A: 20 anni di terapia di resincronizzazione cardiaca. J Am Coll Cardiol 2014; 64(10): 1047-1058.
- Kleemann T, et al: Tasso annuale di difetti degli elettrocateteri di defibrillazione transvenosa nei cardioverter-defibrillatori impiantabili in un periodo di >10 anni. Circolazione 2007; 115(19): 2474-2480.
- Eckstein J, et al: Necessità di revisione chirurgica degli elettrocateteri del defibrillatore impiantati a lungo termine: cause e gestione. Circolazione 2008; 117(21): 2727-2733.
- Lambiase PD, et al: Esperienza mondiale con un defibrillatore impiantabile totalmente sottocutaneo: primi risultati del Registro EFFORTLESS S-ICD. Eur Heart J 2014; 35(25): 1657-1665.
- Poole JE, Gold MR: Chi dovrebbe ricevere il defibrillatore impiantabile sottocutaneo?: Il defibrillatore cardioverter impiantabile (ICD) sottocutaneo dovrebbe essere preso in considerazione in tutti i pazienti con ICD che non richiedono la stimolazione. Circ Arrhythm Electrophysiol 2013; 6(6): 1236-1244; discussione 1244-1245.
- Brignole M, et al.: Linee guida ESC 2013 sulla stimolazione cardiaca e la terapia di resincronizzazione cardiaca: la Task Force sulla stimolazione cardiaca e la terapia di resincronizzazione della Società Europea di Cardiologia (ESC). Sviluppato in collaborazione con la European Heart Rhythm Association (EHRA). Eur Heart J 2013; 34(29): 2281-2329.
- Klug D, et al: Fattori di rischio legati alle infezioni di pacemaker e cardioverter-defibrillatori impiantati: risultati di un ampio studio prospettico. Circolazione 2007; 116(12): 1349-1355.
- Kleemann T, et al: Prevalenza della colonizzazione batterica delle tasche del generatore in pazienti con defibrillatore cardioverter impiantabile senza segni di infezione sottoposti a sostituzione del generatore o a revisione dell’elettrocatetere. Europace 2010; 12(1): 58-63.
- De Oliveira JC, et al: Efficacia della profilassi antibiotica prima dell’impianto di pacemaker e cardioverter-defibrillatori: risultati di un ampio studio prospettico, randomizzato, in doppio cieco, controllato con placebo. Circ Arrhythm Electrophysiol 2009; 2(1): 29-34.
- Senaratne JM, et al: Uno studio di 19 anni sulle infezioni correlate al pacemaker: una richiesta di utilizzo di antibiotici post-operatori. Pacing Clin Electrophysiol 2014; 37(8): 947-954.
- Mittal S, et al: Infezioni da dispositivi elettronici impiantabili cardiaci: incidenza, fattori di rischio ed effetto della busta antibatterica AigisRx. Ritmo cardiaco 2014; 11(4): 595-601.
CARDIOVASC 2015; 14(1): 17-20