Il melanoma maligno della pelle ha un alto tasso di metastasi e rappresenta oltre il 90% di tutti i decessi legati al cancro della pelle. Pertanto, la diagnosi precoce e il miglior trattamento possibile sono molto importanti. L’Associazione Europea di Dermatooncologia (EADO), insieme al Forum Europeo di Dermatologia (EDF) e all’Organizzazione Europea per la Ricerca e il Trattamento del Cancro (EORTC), ha pubblicato nuove linee guida per la diagnosi e il trattamento del melanoma nel 2022.
Il Prof. Dr. med. Claus Garbe, Clinica Dermatologica Universitaria di Tubinga, ha fornito una panoramica attuale degli aspetti importanti della linea guida [1,2] in occasione della riunione annuale dell’Associazione Europea di Dermato-Oncologia (EADO). Per quanto riguarda lo screening e la diagnostica, il presidente ad interim dell’EADO ha spiegato che per la valutazione delle lesioni cutanee pigmentate e non pigmentate, la dermoscopia è ancora considerata lo standard. Per i pazienti ad alto rischio, la linea guida raccomanda anche l’uso della fotografia del corpo intero per individuare i melanomi il più precocemente possibile. La dermoscopia digitale può anche migliorare la diagnosi precoce del melanoma e dovrebbe essere utilizzata nei pazienti ad alto rischio con un elevato numero totale di nevi. Circa il 70% dei melanomi sono di nuova formazione e il 30% si sviluppa da nevi melanocitici, ha spiegato il Prof. Garbe. Utilizzando tecnologie moderne come la “scansione del corpo”, è possibile identificare in modo affidabile le nuove lesioni. Le immagini attuali del corpo intero vengono confrontate automaticamente con quelle dell’ultimo esame, in modo da rilevare sia i nevi modificati che quelli aggiunti di recente. Se c’è un sospetto clinico di melanoma, la conferma istopatologica è obbligatoria. Si possono distinguere quattro tipi principali di melanoma maligno in base al modello di crescita e alla localizzazione: il melanoma a diffusione superficiale è il più comune, seguito dal melanoma nodulare, dalla lentigo maligna e dal melanoma acrolentiginoso [3].
Si raccomanda l’ecografia dei linfonodi locoregionali
Per la stadiazione dei melanomi primari pT1b**, si raccomanda la diagnosi ecografica dei linfonodi locoregionali e della via di transito, sia durante il workup iniziale che durante il follow-up. Se c’è un sospetto clinico di melanoma, si deve procedere immediatamente all’escissione completa con un piccolo margine di sicurezza (1-3 mm) (riquadro ). Le biopsie incisionali sono utili per le lesioni di grandi dimensioni, come quelle sul viso (ad esempio, la lentigo maligna), per le lesioni acrali o per le lesioni nell’area genitale. Se l’esame istologico mostra che si tratta di un melanoma maligno, si deve eseguire un’ulteriore riescissione con un margine di sicurezza di 1-2 cm [4] per evitare la probabilità di recidiva locale. Per alcuni sottotipi di melanoma, come la lentigo maligna o i melanomi genitali e acrali, si può ricorrere alla chirurgia controllata al microscopio per risparmiare il tessuto circostante e garantire una resezione completa. In Germania, questo viene usato relativamente spesso, ha riferito il relatore. Ad esempio, viene utilizzata la tecnica “Slow Mohs”.
** pT = tumore primario valutato istopatologicamente
Biopsia del linfonodo sentinella: un argomento molto discusso
Per una corretta classificazione del tumore (stadiazione) e come base per la decisione terapeutica, ai pazienti con uno spessore del tumore ≥1,0 mm (o in caso di fattori di rischio istologico aggiuntivi da ≥0,8 mm) deve essere offerta una biopsia del linfonodo sentinella (SLNB) [1,2]. “Questo sarà motivo di dibattito in futuro”, ha detto il Prof. Garbe, aggiungendo che non è certo se la SLNB sarà ancora effettuata tra qualche anno [1]. Originariamente, la SLNB serviva a stabilire l’indicazione per una linfadenectomia completa. Ma studi recenti dimostrano che la sopravvivenza non migliora nei pazienti con linfadenectomia completa, ha riferito il Presidente dell’EADO [1]. Secondo la linea guida attuale, i pazienti con micrometastasi nel linfonodo sentinella non dovrebbero più sottoporsi a una linfadenectomia completa. Si tratta di un’indicazione per la terapia sistemica adiuvante. In caso di oligo-metastasi, si può prendere in considerazione la resezione completa o altre procedure distruttive. In passato si consigliava la metastasectomia, ma oggi si predilige il trattamento con gli inibitori del checkpoint immunitario o la terapia mirata. La radioterapia del tumore primario è raramente indicata per il melanoma. Ma per i pazienti che rifiutano il trattamento chirurgico, ad esempio, si può prendere in considerazione la radioterapia.
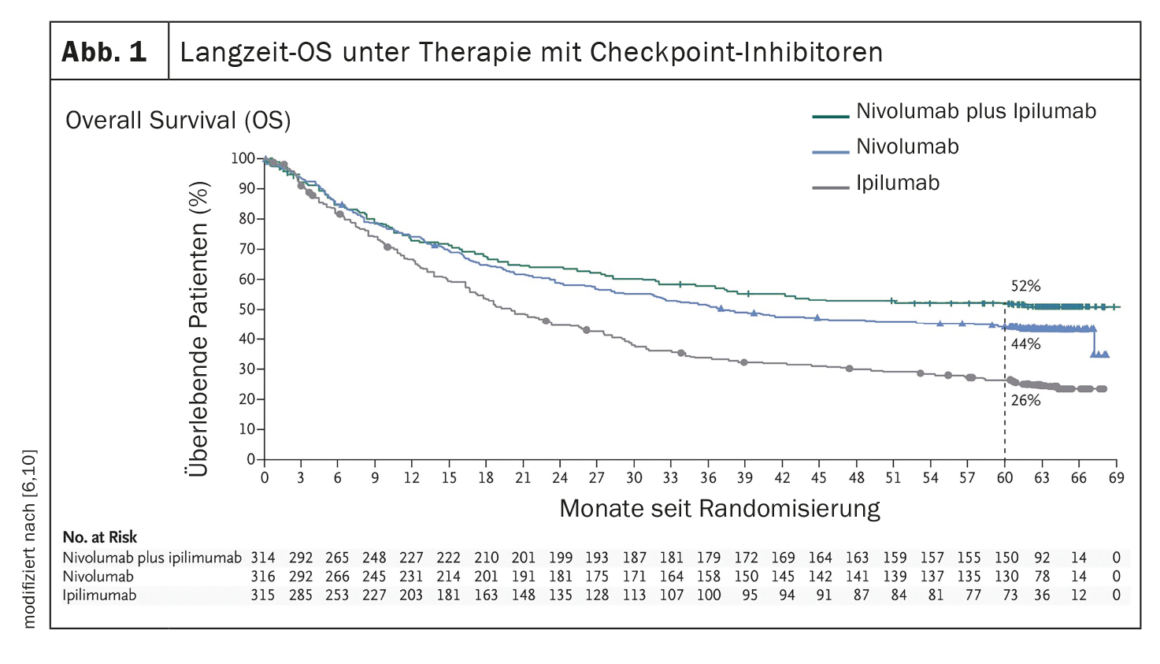
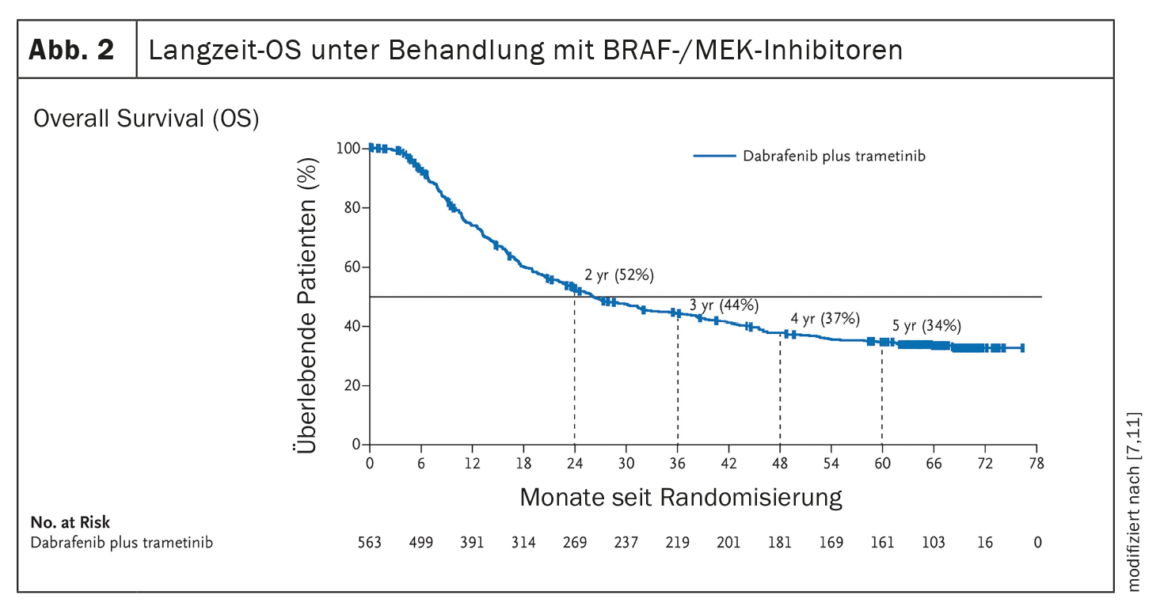
Migliori risultati grazie ai moderni regimi di terapia farmacologica
L’istituzione di terapie di sistema, come l’inibizione del checkpoint immunitario o la terapia mirata con l’inibizione di BRAF/MEK (in presenza di una mutazione BRAF V600), ha portato a un miglioramento significativo del decorso clinico dei pazienti con melanoma metastatico. (Fig. 1, Fig. 2). Nell’era della chemioterapia, la sopravvivenza mediana dei pazienti con metastasi non resecabili era di 7 mesi e la sopravvivenza a 3 anni era del 5%, secondo i dati pubblicati nel 2008 [5]. Al contrario, i dati dello studio CheckMate067, pubblicati nel 2019, mostrano una sopravvivenza globale (OS) a 5 anni del 52% nel braccio di trattamento con nivolumab più ipilimumab e del 44% con la monoterapia con nivolumab, rispettivamente, quando trattati con inibitori del checkpoint immunitario (Fig. 1) [6]. E il trattamento con l’inibitore BRAF dabrafenib (150 mg due volte al giorno) più l’inibitore MEK trametinib (2 mg una volta al giorno) ha raggiunto tassi di OS a 5 anni del 34% (95% CI; 30-38) [7] (Fig. 2 ).
Immunoterapia o terapia mirata come prima linea?
Sulla base dei dati attuali, l’inibizione del checkpoint immunitario dovrebbe essere offerta come trattamento di prima linea nei pazienti in stadio IV, anche indipendentemente dallo stato di mutazione BRAF. Il Prof. Garbe ha spiegato che il trattamento combinato con nivolumab e ipilimumab è preferito alla monoterapia. Nel melanoma in stadio IV, la determinazione dell’espressione di PD-L1 non è necessaria e non dovrebbe essere un criterio per le decisioni terapeutiche. In determinate situazioni, ai pazienti con melanoma in stadio IV e mutazione BRAFV600E o V600K comprovata può essere offerta una terapia di prima linea con inibitore BRAF/MEK come alternativa all’immunoterapia. Ci sono dati che dimostrano che alcuni pazienti traggono beneficio quando la terapia mirata viene utilizzata all’inizio.
Terapia nel contesto adiuvante
Per molti anni, sono stati sperimentati concetti di terapia sistemica adiuvante per prevenire le metastasi a distanza, prolungare il tempo di sopravvivenza e aumentare il tasso di sopravvivenza a lungo termine. La terapia adiuvante può ridurre il rischio di recidiva nei pazienti con melanoma maligno resecato e dovrebbe essere offerta a tutti i pazienti in stadio IIIA-IIID [1,2]. La terapia anti PD-1 è un’opzione a prescindere dallo stato di mutazione, mentre per i pazienti con mutazione BRAFV600/K può essere presa in considerazione anche una terapia adiuvante con inibitore BRAF/MEK. Per il trattamento adiuvante del melanoma in stadio IV (dopo resezione completa), la linea guida consiglia di suggerire nivolumab come opzione di trattamento ai pazienti, indipendentemente dallo stato di mutazione. “Queste terapie adiuvanti sono incredibilmente efficaci”, ha sottolineato il Prof. Garbe, affermando di non essere attualmente a conoscenza di altre entità tumorali con opzioni terapeutiche adiuvanti altrettanto efficaci. Il fatto che la combinazione di nivolumab e ipilumab abbia raggiunto una sopravvivenza libera da recidiva (RFS) del 70% a 24 mesi nei pazienti con melanoma NED in stadio IV (“nessuna evidenza di malattia”; nessun residuo dopo la resezione), rispetto al 42% con la monoterapia con nivolumab e al 14% con il placebo, sottolinea l’efficacia dell’inibizione del checkpoint nel contesto adiuvante. [1,8]. Tuttavia, anche il trattamento adiuvante con inibizione di BRAF/MEK ha fornito prove convincenti di efficacia. Dabrafenib più trametinib ha ridotto il rischio di recidiva del tumore o di morte (RFS) del 53% rispetto al placebo dopo un follow-up mediano di 2,8 anni (HR 0,47; 95% CI; 0,39-0,58; p<0,001) [1,9,13].
Congresso: EADO Annual Meeting
Letteratura:
- «Recommendations from the updated European Interdisciplinary Melanoma Guideline 2022 (EADO/EORTC)», Prof. Dr. med. Claus Garbe, Symposium 4, EADO Annual Meeting, 20.04.2023.
- Garbe C, et al.; EDF, EADO, and EORTC. European consensus-based interdisciplinary guideline for melanoma. Part 2: Treatment – Update 2022. Eur J Cancer 2022; 170: 256–284.
- Innovationsreport 2021, www.tk.de/resource, (letzter Abruf 22.05.2023)
- Läuchli S: Chirurgische Techniken: Dermatochirurgische Möglichkeiten für die Behandlung von Hauttumoren in der Praxis. Dermatologie Praxis 2023; 2: 12–15.
- Korn EL, et al.: Meta-analysis of phase II cooperative group trials in metastatic stage IV melanoma to determine progression-free and overall survival benchmarks for future phase II trials. J Clin Oncol 2008; 26(4): 527–534.
- Larkin J, et al.: Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 2019; 381(16): 1535–1546.
- Robert C, et al.: Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med 2019; 381(7): 626–663.
- Schadendorf D, et al.: ESMO 2019 Oral BA67.
- Hauschild A: Abstract LBA6_PR, ESMO 2017.
- Larkin J, et al.: Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 2019; 381(16): 1535–1546.
- Robert C, et al.: Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med 2019; 381(7): 626–636
- Diaz-Ramón JL, et al.: Cancers 2023; 15: 2174. www.mdpi.com/2072-6694/15/7/2174#, (letzter Abruf 23.05.2023)
- ESMO 2017: Adjuvant Dabrafenib Plus Trametinib Significantly Lowers Risk of Death in Stage III BRAF V600–Mutated Melanoma, www.esmo.org/oncology-news/archive; (letzter Abruf 23.05.2023)
DERMATOLOGIE PRAXIS 2023; 33(3): 26–27