L’ictus è una delle principali cause di disabilità. Il deterioramento cognitivo che si verifica dopo l’ictus è stato piuttosto trascurato per molti anni. La revisione si concentra sull’incidenza e la prevalenza del declino cognitivo dopo l’ictus, sui principali fattori predisponenti, sui fattori di imaging e sui potenziali biomarcatori candidati.
L’ictus è una delle principali cause di disabilità [1]. Mentre la maggior parte della ricerca e degli interventi si è concentrata sulle disabilità fisiche [2], i disturbi cognitivi che si verificano dopo l’ictus sono stati piuttosto trascurati per molti anni [3,4]. Attualmente è noto che anche gli ictus minori possono influire sul funzionamento quotidiano e sulla cognizione, influenzando di conseguenza la qualità della vita [5]. L’ictus ischemico può facilitare l’insorgenza della demenza vascolare e aggravare il declino cognitivo preesistente. L’insorgenza del declino cognitivo può manifestarsi immediatamente dopo l’insorgenza dell’ictus ischemico, ma spesso c’è un ritardo nello sviluppo del declino cognitivo dopo un ictus [6]. Vengono attivati sia i meccanismi neurodegenerativi che quelli vascolari e probabilmente si verificano processi sovrapposti all’interno dell’unità neurovascolare [7]. Nella presente rassegna, ci concentreremo sull’incidenza e la prevalenza del declino cognitivo dopo l’ictus, sui principali fattori predisponenti, sui fattori di imaging e sui potenziali biomarcatori candidati.
Epidemiologia
I sopravvissuti all’ictus hanno un rischio maggiore di sviluppare un deterioramento cognitivo. Le stime riportate sulla prevalenza della demenza sono coerenti tra i vari studi: Il 10% dei pazienti presenta demenza prima del primo ictus, il 10% sviluppa una nuova demenza dopo il primo ictus e più di un terzo presenta demenza dopo un ictus ricorrente [8,9].
La forte associazione tra demenza post-ictus e ictus multipli evidenzia il ruolo causale centrale dell’ictus e, quindi, il probabile effetto di una cura ottimale dell’ictus acuto e della prevenzione secondaria nel ridurre il peso della demenza [8]. La prevalenza del deterioramento cognitivo nei sopravvissuti all’ictus varia a seconda del contesto, della popolazione, dei criteri di esclusione (demenza pre-ictus, ictus ricorrente, afasia), dei criteri utilizzati per la diagnosi di deterioramento cognitivo e dell’intervallo di tempo trascorso dall’ictus [10]. La prevalenza della demenza post-ictus nel primo anno dopo l’ictus varia dal 7% negli studi basati sulla popolazione dell’ictus di primo impatto, escludendo la demenza pre-ictus, al 41% negli studi basati sugli ospedali che includono l’ictus ricorrente e la demenza pre-ictus [8]. Il rischio di demenza post-ictus è stato riscontrato come più alto nei primi mesi dopo l’ictus, il che potrebbe essere parzialmente dovuto al deterioramento cognitivo non riconosciuto prima dell’ictus [10]. Dopo l’iniziale incidenza di demenza post-ictus, l’incidenza cumulativa aumenta linearmente a un tasso del 3% e dell’1,7% all’anno negli studi basati sugli ospedali e sulla popolazione, rispettivamente [11]. Pochi studi hanno utilizzato esiti a lungo termine: il periodo di osservazione più lungo è stato di 25 anni in uno studio basato sulla popolazione che ha riscontrato un’incidenza cumulativa di demenza post-ictus del 48% all’anno 25 [12].
Il deterioramento cognitivo può verificarsi anche dopo un TIA. In una recente revisione sistematica che includeva 1167 pazienti, la prevalenza del deterioramento cognitivo lieve post-TIA variava dal 29 al 68%. Il deterioramento cognitivo grave è stato riscontrato nell’8-22% dei pazienti. Gli studi che utilizzano uno strumento di screening cognitivo e quelli eseguiti poco dopo il TIA o diversi anni dopo, hanno riportato le frequenze più alte di compromissione [13].
Definizioni
La demenza vascolare è la seconda causa più comune di declino cognitivo dopo la malattia di Alzheimer e comprende la demenza post-ictus. Pertanto, i termini PSD e demenza vascolare non sono sinonimi. La demenza vascolare rappresenta un concetto che include non solo gli infarti multipli corticali e/o sottocorticali, ma anche singoli infarti strategici, lesioni della materia bianca non infartuate, emorragie e ipo perfusione come possibili cause di demenza. Inoltre, bisogna sottolineare che non tutti i casi di demenza post-ictus sono di origine vascolare. Di conseguenza, il termine di demenza post-ictus (PSD) viene utilizzato per qualsiasi demenza che si sviluppa in seguito a un evento clinico cerebrovascolare. In questo modo, il termine PSD non suggerisce un particolare processo neuropatologico. Inoltre, il riconoscimento dello stato cognitivo precedente all’ictus è essenziale per consentire una classificazione adeguata. Un paziente con un deterioramento cognitivo preesistente che presenta un ictus minore non dovrebbe essere etichettato come PSD. Inoltre, la valutazione temporale del deterioramento cognitivo è un altro fattore diagnostico rilevante. Dopo un ictus si osservano spesso carenze acute nei punteggi dei test cognitivi e un nuovo test dopo alcune settimane rivela spesso miglioramenti [10]. Pertanto, si raccomanda di ritardare la diagnosi finale di PSD ad almeno sei mesi dall’evento.
Occorre inoltre notare che il termine “post-ictus” non comprende solo gli ictus e gli ictus minori, ma anche gli attacchi ischemici transitori (TIA), poiché le prove emergenti suggeriscono che i TIA possono anche essere associati a prognosi cognitive avverse [13].
Test di screening
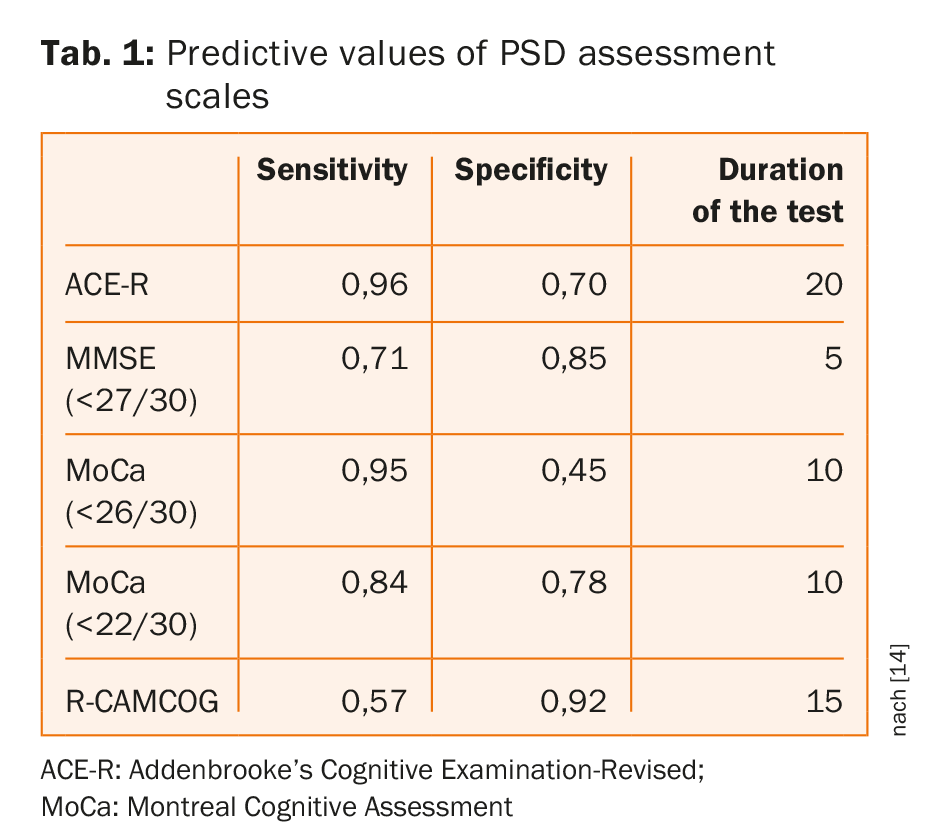
Gli strumenti di screening cognitivo comunemente utilizzati hanno un’accuratezza simile per l’individuazione della demenza/del deterioramento multidimensionale, con nessun test chiaramente superiore e nessuna prova che gli strumenti di screening con tempi di somministrazione più lunghi abbiano prestazioni migliori [14]. Come mostrato nella tabella 1, il MoCA alla soglia abituale offre un tempo di valutazione breve con un’elevata sensibilità, ma a costo della specificità; i cutoff adattati hanno migliorato la specificità senza sacrificare la sensibilità [14].
Fattori di rischio per la demenza post ictus
I principali fattori di rischio per la demenza post ictus sono elencati nella tabella 2. In realtà, questi parametri agiscono su livelli distinti, alcuni piuttosto sulla condizione pre-ictus, mentre altri sulla condizione post-ictus. In una revisione sistematica e meta-analisi che ha incluso 7511 pazienti, Pendlebury e colleghi hanno dimostrato che l’atrofia del lobo temporale mediale, il sesso femminile e una storia familiare di demenza erano fortemente associati alla demenza pre-ictus, mentre le caratteristiche e le complicazioni dell’ictus e la presenza di lesioni multiple nel tempo e nel luogo erano più fortemente associate alla demenza post-ictus [8].
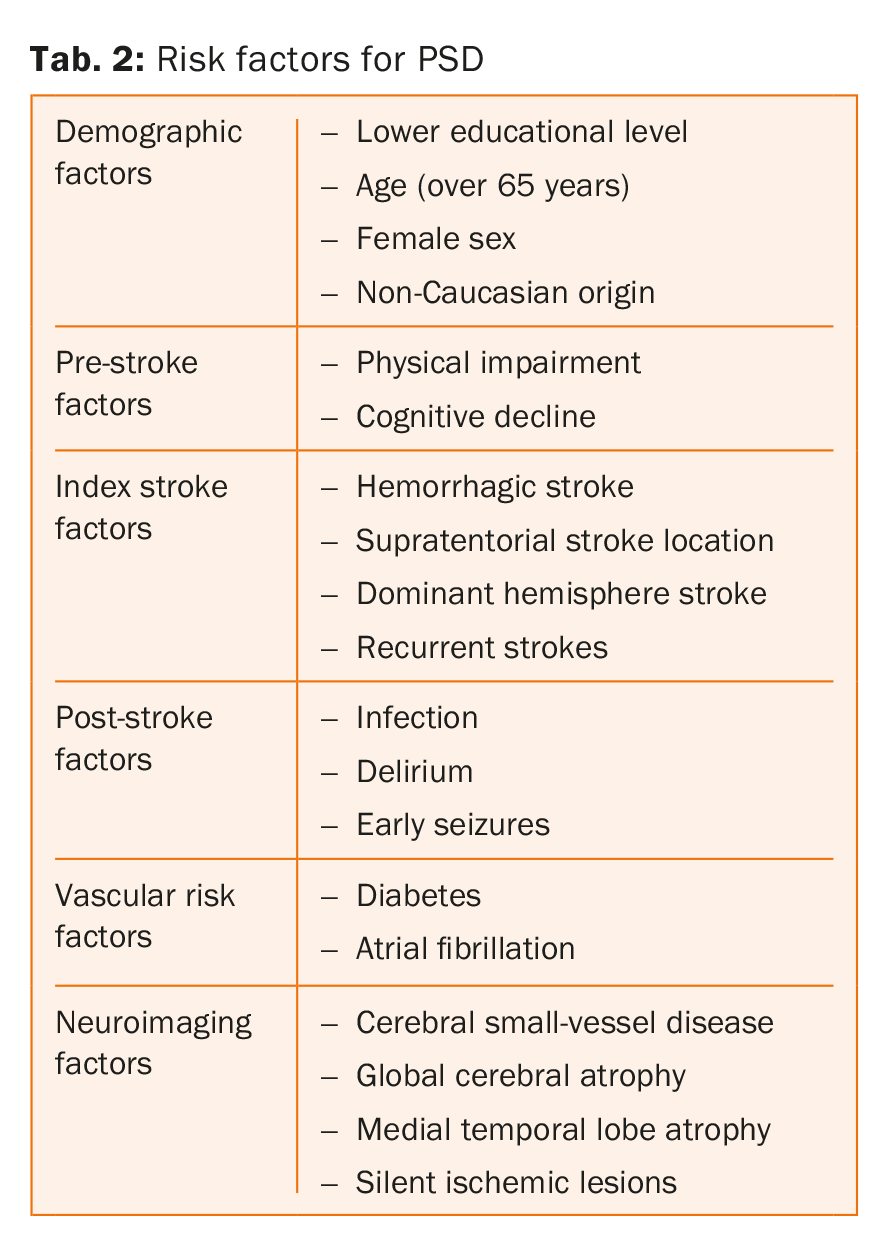
Degno di nota è anche il fatto che i fattori di rischio vascolare, come il diabete e la fibrillazione atriale, sono associati a un aumento del rischio di demenza post-ictus indipendentemente dal deterioramento cognitivo pre-ictus, mentre questo non è stato riscontrato per altri due fattori di rischio ben consolidati, l’ipertensione e il fumo [8,15-18]. Questa scoperta, tuttavia, è in contraddizione con i risultati di altri studi che dimostrano che l’ipertensione arteriosa è un importante fattore determinante del deterioramento cognitivo [19,20]. Infine, mancano prove per stabilire se i fattori di rischio vascolare legati allo stile di vita, come l’inattività fisica e la dieta malsana, siano anche fattori di rischio indipendenti per la PSD [21].
Sottotipi di ictus
In genere si pensa che gli ictus lacunari abbiano meno probabilità di influire sulla cognizione rispetto agli ictus corticali più gravi e più grandi, tuttavia gli ictus lacunari sono di solito associati alla malattia dei piccoli vasi cerebrali, una causa comune di deterioramento cognitivo e di demenza, soprattutto negli anziani [22]. In una recente meta-analisi, Makin e colleghi hanno confrontato l’incidenza del deterioramento cognitivo in base ai diversi sottotipi di ictus [23]. Gli autori hanno dimostrato che tra 7575 pazienti, di cui 2860 con ictus lacunare, il 24% aveva un lieve deterioramento cognitivo (MCI) o PSD. La prevalenza della demenza dopo l’ictus lacunare (sei studi, n=1421) era del 20% (95% CI 9 – 33) e l’incidenza di MCI o demenza (quattro studi, n=275) era del 37% (95% CI 23 – 53). Gli autori hanno concluso che il deterioramento cognitivo sembra essere comune dopo gli ictus lacunari, nonostante le loro piccole dimensioni, suggerendo che la SVD associata può aumentare il loro impatto. Non è stata osservata alcuna differenza significativa per quanto riguarda la prevalenza di PSD tra ictus lacunari e non lacunari.
Neuroimaging
La neuroimmagine è uno strumento diagnostico importante nella PSD. La risonanza magnetica (RM) è la modalità di neuroimmagine chiave che offre un’elevata sensibilità e specificità per rilevare le alterazioni patologiche, compresa la malattia dei piccoli vasi. Per la diagnosi della malattia dei piccoli vasi e del declino cognitivo post-ictus, la risonanza magnetica deve essere utilizzata con diverse sequenze. Gli standard per la neuroimmagine sono raccomandati con una terminologia ampiamente accettata che consente il confronto dei risultati [26].
La tomografia a emissione di positroni (PET) consente di imitare i disturbi metabolici localizzati e/o diffusi responsabili del deterioramento cognitivo e della demenza, ed è efficace nel differenziare la demenza vascolare da quella degenerativa, come la malattia di Alzheimer (metabolismo ridotto nella corteccia temporo-mesiale, temporo-parietale e nel cingolo posteriore, metabolismo conservato nella corteccia frontale e visiva, nella regione centrale e nei gangli della base). Può anche rilevare i cambiamenti infiammatori e la loro interazione con i depositi amiloidi per lo sviluppo di demenze miste dopo l’ictus [27].
Predittori di imaging
Alcune caratteristiche della risonanza magnetica hanno un valore predittivo per quanto riguarda l’insorgenza della PSD. In uno studio recente, 294 pazienti con SVD sono stati valutati da tre a cinque anni dopo la presentazione iniziale di un ictus sottocorticale di tipo lacunare [28]. Al follow-up, il deterioramento cognitivo vascolare (VCI) di qualsiasi tipo è stato rilevato in 188 (63,9%) dei pazienti con SVD, con 65 (22,1%) che hanno soddisfatto i criteri per la demenza vascolare. L’analisi di regressione logistica multivariata aggiustata per età e sesso ha identificato la gravità complessiva delle iperintensità della materia bianca (tARWMC HR 1,42, 95% CI 1,01-2,00; p0,043) e il numero totale di infarti lacunari (HR 3,06, 95% CI 1,71-5,50, p < 0,001) come predittori indipendenti di declino cognitivo. Un altro studio ha confrontato il valore prognostico dell’atrofia del lobo temporale mediale e le caratteristiche della SVD in una coorte di 234 pazienti con ictus o TIA [29]. È stata esplorata la relazione tra le caratteristiche radiologiche che suggeriscono la malattia di Alzheimer e la SVD ed è stata studiata l’associazione di ciascuna di queste caratteristiche con lo stato cognitivo a un anno. Le caratteristiche SVD erano associate in modo indipendente all’MTA (p<0,001). Dopo l’aggiustamento per l’età, il sesso, la disabilità dopo l’ictus, l’ipertensione e il diabete mellito, l’atrofia temporale mediale è stata l’unica caratteristica radiologica associata in modo indipendente al deterioramento cognitivo, definito utilizzando soglie di mini stato mentale (MMSE) ≤26 (odds ratio 1,94; 95% CI1,28-2,94) e MMSE ≤23 (odds ratio 2,31; 95% CI1,48-3,62).
Biomarcatori
I biomarcatori per la PSD possono includere mediatori metabolici, genetici e infiammatori. L’allele e4 dell’apolipoproteina E (APOE4) è un noto fattore di rischio per la malattia di Alzheimer [30,31]. L’APOE4 è anche associato a malattie cardiovascolari e infarti cerebrali [31]. Esistono dati contrastanti sull’associazione del polimorfismo APOE4 con la demenza vascolare e la PSD [32–35]. È stato riferito che il sistema renina-angiotensina, attraverso effetti sia metabolici che vascolari, è coinvolto nella patogenesi della demenza [36,37]. L’enzima di conversione dell’angiotensina (ACE) è uno degli enzimi del sistema renina-angiotensina. I pazienti con genotipo ACE hanno livelli elevati di ACE nel plasma e sono a maggior rischio di comorbilità cardiovascolare [38–40]. Studi precedenti hanno mostrato un’associazione tra l’allele ACE e il declino cognitivo. Questo effetto potrebbe essere più forte in presenza di APOE4 [41,42]. Tuttavia, gli studi che hanno esaminato l’ACE come predittore del declino cognitivo post-ictus si sono conclusi con dati contrastanti [42,43]. Altri biomarcatori, come l’enzima secretasi B (BACE1) e i livelli del recettore per i prodotti finali della glicazione avanzata (sRAGE), sono stati suggeriti come correlati al deterioramento cognitivo subito dopo l’ictus (valutato due settimane dopo l’ictus) [39]. I livelli di omocisteina, vitamina B12 e acido folico sono stati collegati al declino cognitivo e all’ictus e potrebbero svolgere un ruolo nella PSD. Tuttavia, nello studio VITATOPS, l’integrazione con le vitamine B non ha avuto alcun effetto sull’incidenza del deterioramento cognitivo o del declino cognitivo [44]. Un ambiente infiammatorio eccessivo nel cervello potrebbe aggravare il danno post ischemico. Pertanto, i soggetti con un’elevata risposta infiammatoria all’insulto ischemico possono essere più vulnerabili a ulteriori danni tissutali e a sviluppare la PSD.
L’infiammazione sistemica e i marcatori infiammatori sono noti per essere associati al deterioramento cognitivo [45], in particolare alla demenza degenerativa come la malattia di Alzheimer [46–48]. Gli studi longitudinali hanno mostrato una correlazione tra una maggiore concentrazione basale di interleuchina 6 (IL-6) [48] e di proteina C-reattiva (CRP) [49] e il declino cognitivo. Tuttavia, l’associazione tra infiammazione e PSD non è ancora stata stabilita. Diversi studi recenti hanno indagato la relazione tra i marcatori infiammatori e la PSD. La velocità di eritrosedimentazione (VES) [50], la CRP e l’IL-6 [51] sono stati suggeriti come predittori di PSD.
Trattamento farmacologico e prevenzione
Esistono diversi interventi farmacologici per la prevenzione del declino cognitivo post-ictus. L’abbassamento della pressione sanguigna a lungo termine dopo l’ictus con il perindopril è stato associato a una riduzione del declino cognitivo e a una tendenza alla diminuzione della demenza nello studio PROGRESS [52].
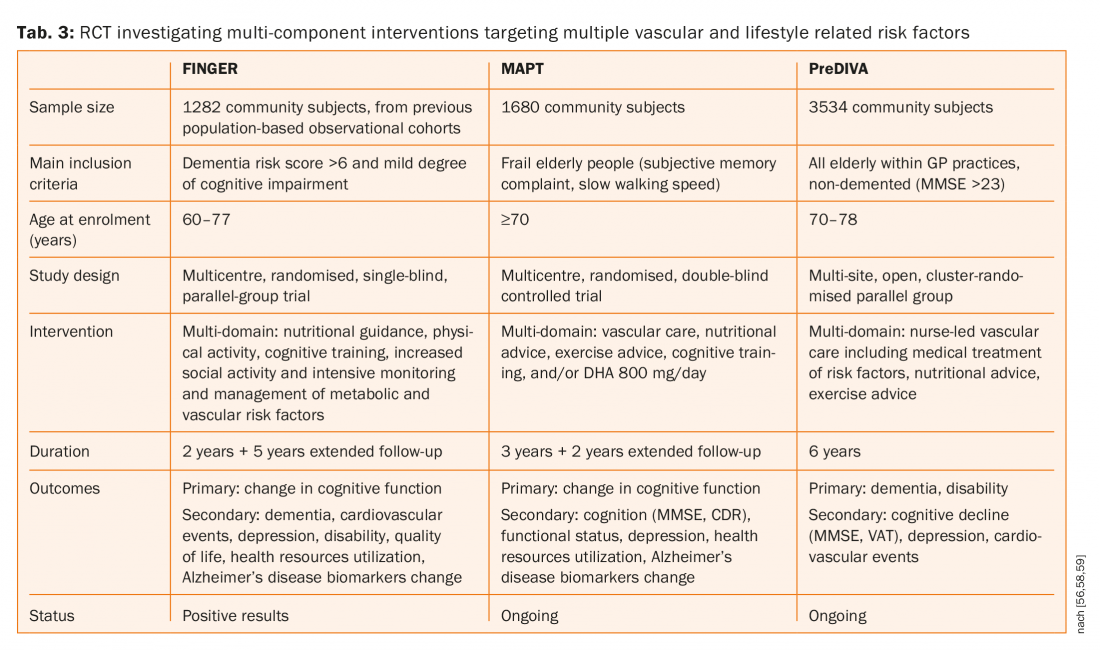
Inoltre, è stato dimostrato che le statine riducono sia il primo ictus che quello ricorrente, ma né la simvastatina né la pravastatina hanno avuto alcuna influenza sulla cognizione [53,54]. Tre grandi studi randomizzati e controllati (FINGER, MAPT e preDIVA, scheda. 3) che studia interventi multicomponenti rivolti a più fattori di rischio vascolari e legati allo stile di vita rispetto alla consulenza sanitaria generale (gruppo di controllo) per prevenire il declino cognitivo e la demenza [55–58]. Uno di questi tre studi (FINGER) ha pubblicato i risultati e ha suggerito che un intervento multidominio potrebbe migliorare o mantenere il funzionamento cognitivo negli anziani a rischio [55,56]. Ci sono stati 1260 pazienti assegnati in modo casuale al gruppo di intervento (n=631) o al gruppo di controllo (n=629). 591 (94%) partecipanti nel gruppo di intervento e 599 (95%) nel gruppo di controllo hanno avuto almeno una valutazione post-baseline e sono stati inclusi nell’analisi intention-to-treat modificata. La variazione media stimata nel punteggio della batteria di test neuropsicologici a due anni è stata di 0,20 nel gruppo di intervento e di 0-16 nel gruppo di controllo. La differenza tra i gruppi nella variazione del punteggio totale della batteria di test neuropsicologici per anno è stata di 0,022 (95% CI 0,002-0,042; p=0,030).
Conclusione
Una percentuale importante di pazienti soffrirà di demenza o di forme più lievi di deterioramento cognitivo dopo un ictus o anche un TIA. Un certo numero di parametri clinici e radiologici possono predire il verificarsi della PSD. Sebbene il rischio sia più alto nel periodo immediatamente successivo all’ictus, rimarrà comunque elevato anche dopo diversi anni. La presenza di questo ritardo tra il momento dell’ictus e l’insorgenza della demenza consente di utilizzare una finestra temporale terapeutica per l’intervento. Gli studi farmacologici hanno dimostrato che l’abbassamento della pressione sanguigna a lungo termine dopo l’ictus è associato a una riduzione del declino cognitivo. Recentemente, un ampio studio randomizzato e controllato ha dimostrato che un intervento multidominio può migliorare o mantenere il funzionamento cognitivo nelle persone anziane a rischio. Questi risultati suggeriscono ulteriormente l’influenza positiva degli interventi multicomponente che mirano a molteplici fattori di rischio vascolari e legati allo stile di vita sull’insorgenza della demenza post-ictus.
Messaggi da portare a casa
- I sopravvissuti all’ictus hanno un rischio maggiore di sviluppare un deterioramento cognitivo.
- La demenza post-ictus (PSD) è associata a diversi fattori che indicano da un lato una ridotta riserva cognitiva, tra cui il declino cognitivo pre-ictus, la disabilità premorbosa, la malattia della materia bianca e l’atrofia cerebrale e dall’altro aspetti specifici dell’ictus.
- La risonanza magnetica (RM) è la modalità di neuroimaging chiave.
- Sebbene sia stato proposto un gran numero di biomarcatori per la PSD, non è stato ancora dimostrato che un parametro specifico sia in grado di predire in modo robusto la PSD.
- Gli studi farmacologici hanno dimostrato che l’abbassamento della pressione sanguigna a lungo termine dopo l’ictus è associato a una riduzione del declino cognitivo.
- Un ampio studio randomizzato e controllato ha recentemente suggerito che un intervento multidominio potrebbe migliorare o mantenere il funzionamento cognitivo nelle persone anziane a rischio.
Riferimenti:
- Strong K, Mathers C, et al…: Prevenire l’ictus: salvare vite in tutto il mondo. Lancet Neurol. 2007; 6: 182-187.
- Lees R, Fearon P, Harrison JK, et al: Valutazione cognitiva e dell’umore nella ricerca sull’ictus: revisione mirata degli studi contemporanei. Ictus. 2012; 43: 1678-1680.
- McKevitt C, Fudge N, et al: Bisogni a lungo termine auto-riferiti dopo l’ictus. Ictus. 2011; 42: 1398-1393.
- Pollock A, St. George B, et al: Le dieci principali priorità di ricerca relative alla vita dopo l’ictus. Lancet Neurol. 2012; 11: 209.
- Fride Y, Adamit T, et al…: Quali sono le correlazioni della cognizione e della partecipazione al ritorno al lavoro dopo il primo ictus lieve? Top Stroke Rehabil. 2015;22(5): 317-325.
- Ballard C, Rowan E, et al…: Studio prospettico di follow-up tra 3 e 15 mesi dopo l’ictus: miglioramenti e declino della funzione cognitiva tra i sopravvissuti all’ictus senza demenza >75 anni di età. Stroke 2003; 34: 2440-2444.
- Kalaria RN: Malattia cerebrovascolare e meccanismi del deterioramento cognitivo: prove da studi clinicopatologici nell’uomo.Stroke 2012; 43: 2526-2534.
- Pendlebury ST, Rothwell PM: Prevalenza, incidenza e fattori associati alla demenza pre-ictus e post-ictus: una revisione sistematica e una meta-analisi. Lancet Neurol. 2009; 8: 1006-1018.
- Pendlebury ST, Chen PJ, et al: Studio vascolare di Oxford. Fattori metodologici nella determinazione del rischio di demenza dopo l’attacco ischemico transitorio e l’ictus: (I) impatto del bias di selezione al basale. Ictus. 2015; 46: 641-646.
- Henon H, Pasquier F, Leys D: Demenza post-ictus. Cerebrovasc Dis 2006; 22: 61-70.
- Mijajlović MD, Pavlović A, et al…: Demenza post-ictus – una revisione completa. BMC Med. 2017 Jan 18; 15(1):11.
- Kokmen E, Whisnant JP, et al…: Demenza dopo un ictus ischemico: uno studio basato sulla popolazione di Rochester, Minnesota (1960-1984). Neurologia 1996; 46: 154-159.
- Van Rooij FG, Kessels RP, et al: Deterioramento cognitivo nei pazienti con attacco ischemico transitorio: una revisione sistematica. Cerebrovasc Dis. 2016; 42(1-2): 1-9.
- Lees R, Selvarajah J et al.:Accuratezza dei test di screening cognitivo per la diagnosi di demenza e deterioramento cognitivo multidimensionale nell’ictus. Ictus. 2014 Oct; 45(10): 3008-3018.
- Gottesman RF, Hillis AE: Predittori e valutazione della disfunzione cognitiva derivante da ictus ischemico. Lancet Neurol 2010; 9: 895-905.
- Pasquier F, Hénon H, Leys D: Fattori di rischio e meccanismi della demenza post-ictus. Rev Neurol. 1999; 155(9): 749-753.
- Chaudhari TS, Verma R, et al…: Predittori clinico-radiologici del deterioramento cognitivo vascolare (VCI) nei pazienti con ictus: uno studio osservazionale prospettico. J Neurol Sci. 2014 May 15; 340(1-2): 150-158.
- Arba F, Quinn T, et al…: Collaborazione VISTA. Determinanti del deterioramento cognitivo post-ictus: analisi di VISTA. Acta Neurol Scand. 2017 Jun; 135(6): 603-607.
- Iulita MF, Girouard H: Trattare l’ipertensione per prevenire il declino cognitivo e la demenza: Riaprire il dibattito. Adv Exp Med Biol. 2017; 956: 447-473.
- Kalaria RN: Fattori di rischio e meccanismi neurodegenerativi nella demenza legata all’ictus. Panminerva Med. 2012 Sep; 54(3):139-148.
- Teuschl Y, Matz K, Brainin M: Prevenzione del declino cognitivo post-ictus: una revisione incentrata sugli interventi sullo stile di vita. Eur J Neurol. 2013 Jan; 20(1): 35-49.
- Wardlaw JM, Smith EE, et al: Standard di neuroimaging per la ricerca sulla malattia dei piccoli vasi e il suo contributo all’invecchiamento e alla neurodegenerazione. Lancet Neurol 2013; 12: 822-838.
- Makin SD, Turpin S, et al..: Deterioramento cognitivo dopo l’ictus lacunare: revisione sistematica e meta-analisi di incidenza, prevalenza e confronto con altri sottotipi di ictus. J Neurol Neurosurg Psychiatry. 2013 Aug; 84(8): 893-900.
- Schmidt R, Ropele S, et al: Imaging pesato in diffusione e cognizione nello studio sulla leucoariosi e la disabilità negli anziani. Stroke 2010; 41: e402-e408.
- Blair GW, Hernandez MV, et al: Neuroimaging avanzato della malattia dei piccoli vasi cerebrali. Curr Treat Options Cardiovasc Med. 2017 Jul; 19(7): 56.
- Wardlaw JM, Smith EE, et al: Standard di neuroimaging per la ricerca sulla malattia dei piccoli vasi e il suo contributo all’invecchiamento e alla neurodegenerazione. Lancet Neurol. 2013; 12: 822-838.
- Heiss W-D, Zimmermann-Meinzingen S: L’imaging PET nella diagnosi differenziale della demenza vascolare. J Neurol Sci 2012; 322: 268-273.
- Pavlovic AM, Pekmezovic T, et al: Predittori basali del declino cognitivo nei pazienti con malattia cerebrale dei piccoli vasi. J Alzheimers Dis. 2014; 42 Suppl 3: 37-43.
- Arba F, Quinn T, et al…: VISTA. Collaborazione.Malattia cerebrale dei piccoli vasi, atrofia del lobo temporale mediale e stato cognitivo nei pazienti con ictus ischemico e attacco ischemico transitorio. Eur J Neurol. 2017 Feb; 24(2): 276-282.
- Bu G: L’apolipoproteina E e i suoi recettori nella malattia di Alzheimer: percorsi, patogenesi e terapia. Nat Rev Neurosci 2009; 10: 333-344.
- Davidson Y, Gibbons L et al…: Frequenza dell’allele dell’apolipoproteina E epsilon4 nella demenza vascolare. Dement Geriatr Cogn Disord 2006; 22: 15-19.
- Hsiung G-YR, Sadovnick AD, Feldman H: Il genotipo dell’apolipoproteina E epsilon4 come fattore di rischio per il declino cognitivo e la demenza: dati del Canadian Study of Health and Aging. CMAJ 2004; 171: 863-867.
- Mortimer JA, Snowdon DA, Markesbery WR: L’effetto dell’APOE-epsilon4 sulla demenza è mediato dalla neuropatologia dell’Alzheimer. Alzheimer Dis Assoc Disord 2009; 23: 152-157.
- Rippon GA, Tang MX, et al: Malattia di Alzheimer familiare nei latini: interazione tra APOE, ictus e sostituzione degli estrogeni. Neurology 2006; 66: 35-40.
- Jin YP, Østbye T, et al…: Effetto congiunto di ictus e APOE 4 sul rischio di demenza: il Canadian Study of Health and Aging. Neurologia 2008; 70: 9-16.
- Qian L, Ding L, et al…: Biomarcatori precoci per il deterioramento cognitivo post-ictus. J Neurol 2012; 259: 2111-2118.
- Kolsch H, Jessen F, et al…: Il polimorfismo ACE I/D è un fattore di rischio della malattia di Alzheimer, ma non della demenza vascolare. Neurosci Lett 2005; 377: 37-39.
- Hassan A, Lansbury A, et al…: Il genotipo di inserzione/delezione dell’enzima convertitore dell’angiotensina è associato alla leucoaraiosi nelle sindromi lacunari. J Neurol Neurosurg Psychiatry 2002; 72: 343-346.
- Szolnoki Z, Maasz A, et al: La coesistenza del polimorfismo A1166C del recettore dell’angiotensina II di tipo 1 e del polimorfismo D/D dell’enzima convertitore dell’angiotensina suggerisce una predisposizione all’ictus ischemico associato a piccoli vasi. Medicina Neuromolecolare 2006; 8: 353-360.
- Bartres-Faz D, Junque C, et al: Polimorfismo dell’enzima convertitore dell’angiotensina II negli esseri umani con disturbi della memoria associati all’età: relazione con le prestazioni cognitive. Neurosci Lett 2000; 290: 177-180.
- Richard F, Berr C, et al…: Effetto del polimorfismo dell’enzima di conversione dell’angiotensina I/D sul declino cognitivo. Il Gruppo di Studio EVA. Neurobiol Aging 2000; 21: 75-80.
- Bour AMJ, Rasquin SMC, et al…: L’effetto dell’allele APOE-epsilon4 e del polimorfismo ACE-I/D sulla cognizione durante un follow-up di due anni in pazienti colpiti da ictus di primo tipo. Dement Geriatr Cogn Disord 2010; 29: 534-542.
- Bour AMJJ, Rasquin SMC, et al…: L’effetto dell’allele APOE-epsilon4 e del polimorfismo ACE-I/D sulla cognizione durante un follow-up di due anni in pazienti colpiti da ictus di primo tipo. Dement Geriatr Cogn Disord 2010; 29: 534-542.
- Baum L, Chen X, et al…: Polimorfismi e deterioramento cognitivo vascolare dopo un ictus ischemico. J Geriatr Psychiatry Neurol 2007; 20: 93-99.
- Hankey GJ, Ford AH e altri: Effetto delle vitamine del gruppo B e della riduzione dell’omocisteina sul deterioramento cognitivo nei pazienti con precedente ictus o attacco ischemico transitorio: analisi secondaria prespecificata di uno studio randomizzato, controllato con placebo e meta-analisi. Stroke 2013; 44: 2232-2239.
- Karlsson H, Ahlborg B, et al…: Associazione tra la velocità di sedimentazione eritrocitaria e il QI nei maschi svedesi di età compresa tra i 18 e i 20 anni. Brain Behav Immun 2010; 24: 868-873.
- Craft S: Il ruolo dei disturbi metabolici nella malattia di Alzheimer e nella demenza vascolare: due strade convergenti. Arch Neurol 2009; 66: 300-305.
- Eikelenboom P, van Exel E, et al…: Neuroinfiammazione – un evento precoce nella storia e nella patogenesi della malattia di Alzheimer. Neurodegener Dis 2010; 7: 38-41.
- Schram MT, Euser SM e altri: Marcatori sistemici dell’infiammazione e declino cognitivo in età avanzata. J Am Geriatr Soc 2007; 55: 708-716.
- Hoth KF, Haley AP, et al…: La proteina C-reattiva elevata è correlata al declino cognitivo negli adulti anziani con malattie cardiovascolari. J Am Geriatr Soc 2008; 56: 1898-1903.
- Kliper E, Bashat DB et al…: Declino cognitivo dopo l’ictus: relazione con i biomarcatori infiammatori e il volume dell’ippocampo. Stroke 2013; 44: 1433-1435.
- Rothenburg LS, Herrmann N, et al…: La relazione tra i marcatori infiammatori e il deterioramento cognitivo post-ictus. J Geriatr Psychiatry Neurol 2010; 23: 199-205.
- Tzourio C, Anderson C, et al…: Effetti della riduzione della pressione arteriosa con la terapia a base di perindopril e indapamide sulla demenza e sul declino cognitivo nei pazienti con malattia cerebrovascolare. Arch Intern Med 2003; 163: 1069-1075.
- Collins R, Armitage J: Gruppo Collaborativo dello Studio di Protezione del Cuore. Effetti della riduzione del colesterolo con simvastatina sull’ictus e altri eventi vascolari maggiori in 20536 persone con malattia cerebrovascolare o altre condizioni ad alto rischio. Lancet 2004; 363: 757-767.
- Shepherd J, Blauw GJ, et al: Pravastatina in individui anziani a rischio di malattia vascolare (PROSPER): uno studio randomizzato controllato. Lancet 2002; 360: 1623-1630.
- Kivipelto M, Solomon A, et al: Il Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability (FINGER): disegno dello studio e progressi. Alzheimers Dement 2013; 9: 657-665.
- Ngandu T, Lehtisalo J, et al: Un intervento multidominio di 2 anni di dieta, esercizio fisico, formazione cognitiva e monitoraggio del rischio vascolare rispetto al controllo per prevenire il declino cognitivo negli anziani a rischio (FINGER): uno studio randomizzato controllato. Lancet. 2015 Jun 6; 385(9984): 2255-2263.
- Carrie I, van Kan GA, et al: Strategie di reclutamento per gli studi di prevenzione. Lo studio MAPT (MultiDomain Alzheimer Preventive Trial). J Nutr Health Aging 2012; 16: 355-359.
- Richard E, Van den Heuvel E, et al…: Prevenzione della demenza mediante cure vascolari intensive (PreDIVA): uno studio randomizzato a grappolo in corso. Alzheimer Dis Assoc Disord 2009; 23: 198-204.
InFo NEUROLOGIE & PSYCHIATRIE 2018; 16(1): 31-37