È stato stimato che circa 1,8 milioni di neuroni vengono persi al minuto nel corso di un danno ischemico causato da un ridotto apporto di sangue. Quindi, nel caso di un ictus acuto, le cose devono accadere rapidamente. La diagnostica per immagini di emergenza consente una diagnosi precoce e ha un’influenza decisiva sulla terapia.
Ogni 30 minuti, una persona in Svizzera viene colpita da un ictus. Circa il 25% delle persone colpite muore a causa delle conseguenze immediate, e circa un terzo rimane disabile in varia misura per tutta la vita [1]. Nell’87% dei casi, l’ictus è il risultato di una riduzione acuta dell’apporto di sangue nel contesto di un’occlusione tromboembolica o di una stenosi vascolare emodinamicamente rilevante, e nel 13% il risultato di un’emorragia intracranica o subaracnoidea [2]. È stato stimato che circa 1,8 milioni di neuroni vengono persi al minuto nel corso di un danno ischemico causato da un ridotto apporto di sangue [3]. Nel caso di un ictus acuto, le cose devono essere fatte rapidamente e sono necessari chiarimenti diagnostici e terapie immediate. La diagnostica per immagini di emergenza consente una diagnosi precoce e ha un’influenza decisiva sulla terapia.
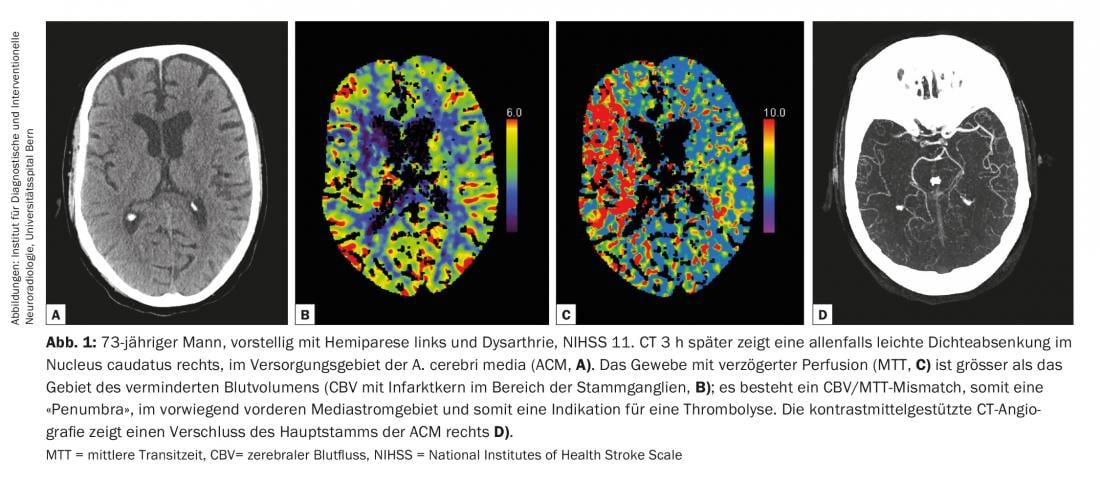
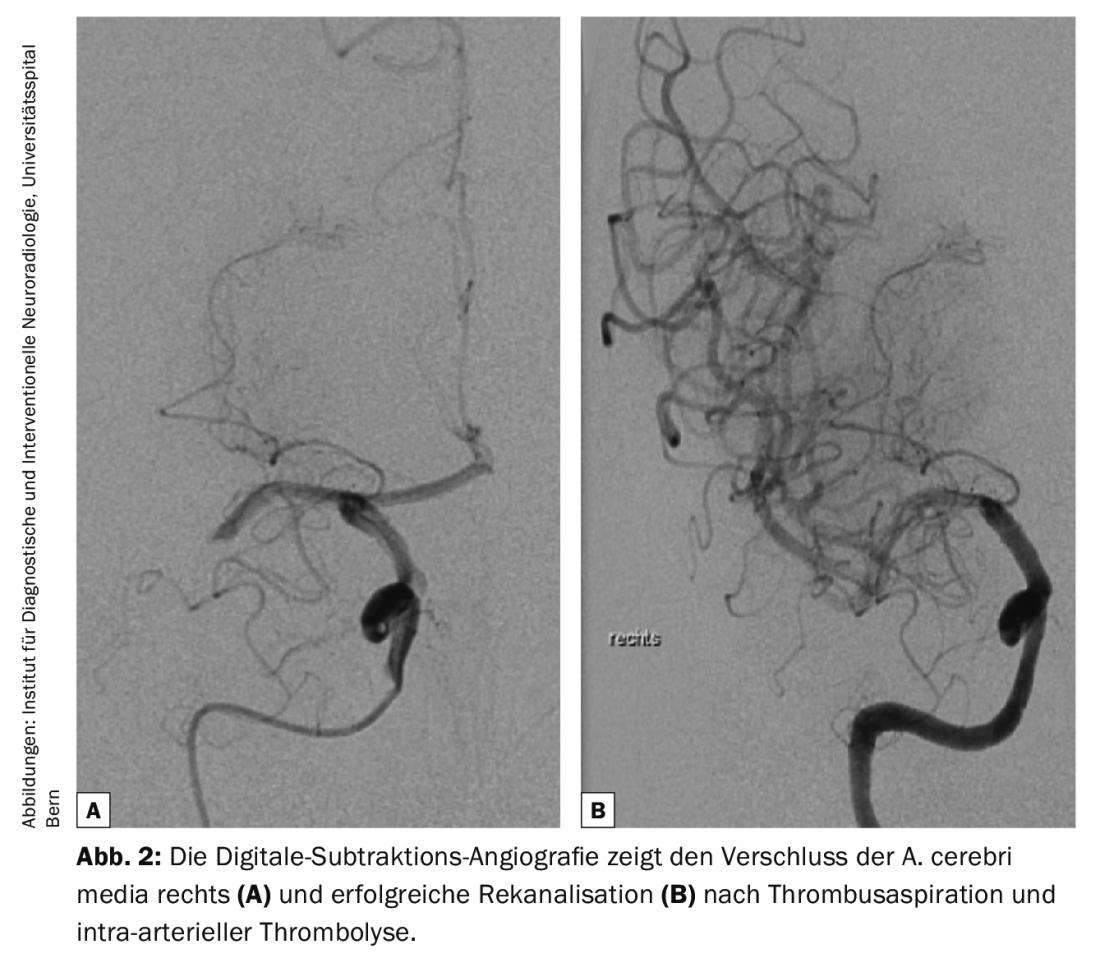
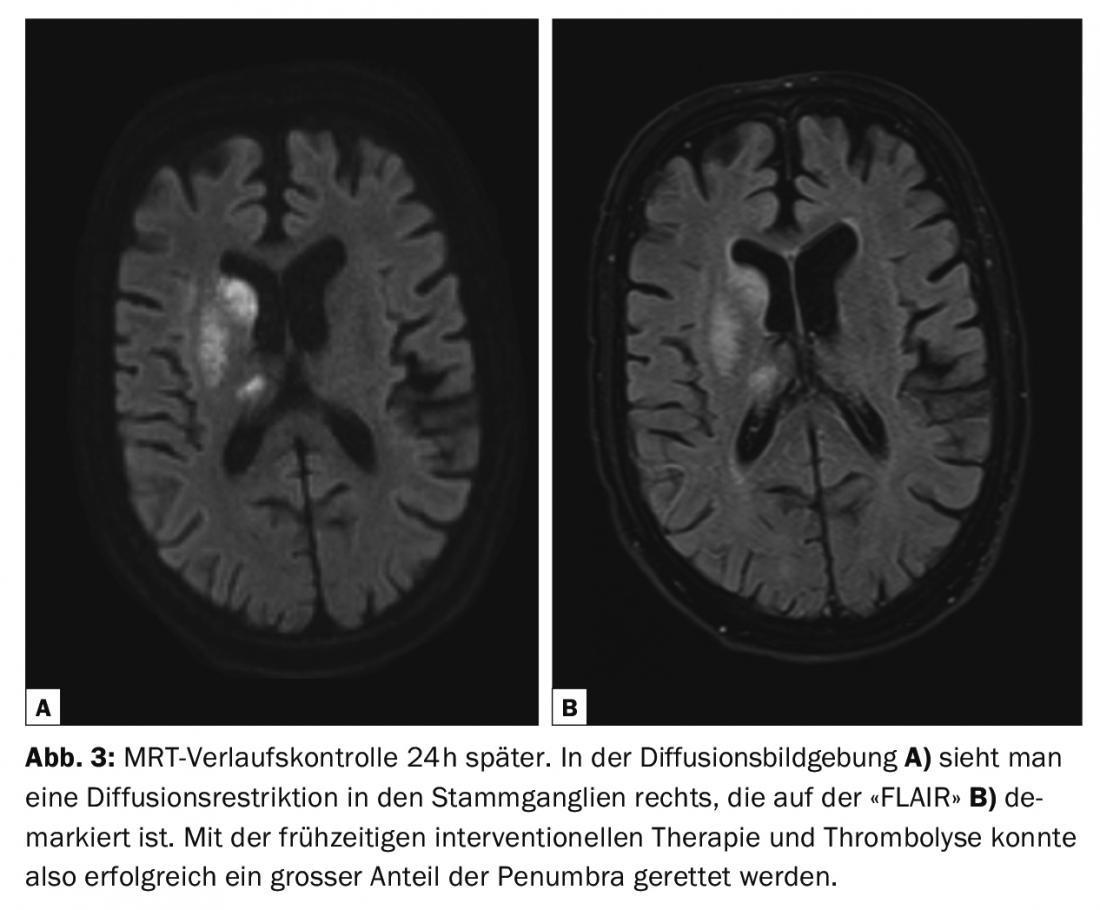
Le linee guida diagnostiche per le malattie cerebrovascolari sono continuamente aggiornate dall’American College of Radiology (ACR) e dall’American Heart Association/American Stroke Association (AHA/ASA) [2,4]. Tutte le modalità, dalla tomografia computerizzata (TC) e la risonanza magnetica (RM) agli ultrasuoni (US) e all’angiografia a sottrazione digitale (DSA), hanno il loro posto nella diagnosi delle malattie cerebrovascolari [2] (Fig. 1-3). La TAC e la risonanza magnetica sono utilizzate prevalentemente nella diagnosi dell’ictus acuto. Le seguenti domande devono avere una risposta affidabile e rapida:
- Emorragia intracranica?
- Chiusura dei vasi?
- Nucleo dell’infarto?
- Parenchima cerebrale potenzialmente salvabile (“penombra ischemica” o “tessuto a rischio”)?
- “Imitare l’ictus”?
L’indicazione per la trombolisi o la terapia interventistica viene formulata conoscendo la finestra temporale dall’insorgenza dei sintomi e i sintomi attuali, compresa la National Institutes of Health Stroke Scale (NIHSS), nonché le diagnosi secondarie rilevanti, come i fattori di rischio cardiovascolare.
Tomografia computerizzata (TC)
La TAC è disponibile 24 ore su 24 nella maggior parte degli ospedali e consente di escludere un’emorragia intracranica acuta in modo rapido e semplice. L’emorragia intracranica acuta è già iperdensa sull’imaging nativo (60-90 HU, quindi più luminosa o più densa del tessuto cerebrale sano) e rappresenta una controindicazione assoluta alla trombolisi endovenosa [4].
In caso di ischemia causata da un ridotto apporto di sangue (definito come flusso sanguigno cerebrale [CBF] <10 ml/100 g/min), il trasporto di ioni viene meno a causa della mancanza di energia, con conseguente afflusso di acqua nelle cellule (edema citotossico) [5]. L’aumento del contenuto di acqua nel tessuto ischemico porta a una riduzione della densità dell’area colpita e diventa visibile come differenziazione cranio-corticale abolita (soprattutto nella corteccia insulare come “segno del nastro insulare”) o come ipodensità nei gangli basali e nel campo midollare. Questa riduzione della densità deve essere interpretata come un nucleo infartuale nel senso di un danno parenchimale irreversibile. Tuttavia, il rilevamento di tali cambiamenti precoci e spesso sottili richiede molta esperienza e ha una sensibilità media del 66% (range, 20% – 87%) nelle prime tre ore dall’insorgenza dei sintomi [2].
Un trombo intravascolare, che viene visualizzato iperdenso, può anche essere visibile nell’imaging nativo. Questo cosiddetto “segno dell’arteria iperdensa” è altamente specifico ma non molto sensibile per un’occlusione vascolare e, come altre stenosi o occlusioni vascolari, può essere visualizzato in modo più dettagliato con l’aiuto dell’angiografia TC con contrasto. L’angiografia TC permette di valutare tutte le arterie afferenti al cervello dall’arco aortico al vertice e quindi permette anche di valutare la circolazione collaterale o le anomalie vascolari che possono complicare l’intervento endovascolare.
Il parenchima cerebrale potenzialmente salvabile, chiamato anche “penombra” o “tessuto a rischio”, è l’area di ipoperfusione critica (CBF 10-20 ml/100 g/min) [5]. I neuroni nella “penombra” sono disfunzionali, anche se la disfunzione è reversibile con una riperfusione tempestiva. Con l’occlusione persistente, si verifica una perdita graduale della “penombra”. L’imaging di perfusione è necessario per visualizzare il nucleo dell’infarto, la “penombra” (“tessuto a rischio”) e l’oligemia benigna adiacente (“tessuto non a rischio”, CBF >20 ml/100 g/min, norma 60-80 ml/100 g/min). La TC di perfusione è una tecnica di imaging dinamico con contrasto che fornisce informazioni su parametri temporali come il tempo di transito medio (MTT), il tempo al picco della curva intensità-tempo del segnale (TTP) e il tempo di massimo della cosiddetta funzione residua (Tmax), o su parametri semiquantitativi come il flusso sanguigno cerebrale (CBF) e il volume sanguigno cerebrale (CBV). La perfusione ritardata si manifesta con parametri di perfusione temporale prolungati. La riduzione della CBF nella “penombra” porta all’autoregolazione vasogenica dipendente dall’energia; MTT e TTP sono prolungati, la CBV è normale o addirittura leggermente aumentata. Questi meccanismi di compensazione non sono presenti nel nucleo dell’infarto, dove si verifica un calo della CBV [6]. Nella tomografia computerizzata, la penombra potenzialmente salvabile viene tradizionalmente stimata mediante il cosiddetto “mismatch CBV/MTT”.
Risonanza magnetica (MRI)
Nei centri per ictus, la risonanza magnetica è disponibile 24 ore su 24 e spesso è preferita alla TAC perché fornisce maggiori informazioni. Il protocollo di routine dell’esame RM comprende l’imaging di diffusione (DWI), la sequenza “FLAIR” o eco di spin pesata in T2, l'”angiografia RM a tempo di volo” (TOF-MRA) arteriosa, la sequenza pesata in suscettibilità (SWI) o la sequenza ad eco gradiente T2* (T2*GRE), la risonanza magnetica di perfusione, l’angiografia con contrasto dei vasi che alimentano il cervello e una sequenza pesata in T1 dopo la somministrazione del contrasto.
Le sequenze sensibili ai prodotti di degradazione del sangue (SWI o T2*GRE) consentono anche di visualizzare un possibile trombo intravascolare. La lunghezza del trombo, misurata con la risonanza magnetica o la TAC, ha una rilevanza prognostica, con una lunghezza superiore a 8 mm associata a una scarsa ricanalizzazione dopo la lisi i.v. [7].
Una maggiore quantità di deossiemoglobina porta a una depressione del segnale RM più evidente delle arterie corticali, leptomeningee (“segno dei vasi corticali”) e midollari profonde (“segno del pennello”) nella sequenza pesata in base alla suscettibilità e quindi permette di stimare l’area ipoperfusa [8].
Nell’ictus acuto e nell’ictus da risveglio (non si conosce l’ora di insorgenza dei sintomi), il confronto tra l’imaging pesato con la diffusione e quello FLAIR consente una classificazione temporale. L’edema citotossico, che corrisponde in gran parte al nucleo dell’infarto ma contiene anche alcune parti reversibili della “penombra”, può essere delineato già dopo pochi minuti sull’imaging di diffusione (sensibilità 88-100%, specificità 95-100%), ma solo dopo circa 6 ore post-ictus come aumento del segnale sulla “FLAIR”/T2 [2,9]. La sequenza pesata in T1 dopo la somministrazione del contrasto consente un’ulteriore classificazione temporale; l’iperemia meningea è prevista nel periodo compreso tra 24 ore e 3-4 giorni, l’interruzione della barriera del parenchima cerebrale infartuato nel periodo compreso tra 24 ore e diverse settimane o addirittura mesi [9].
Con l’angiografia TOF, la risonanza magnetica offre la possibilità di un imaging vascolare sensibile al flusso senza somministrazione di mezzi di contrasto e un’elevata risoluzione spaziale, oltre all’angiografia con mezzo di contrasto. La perfusione RM, come la perfusione TC, fornisce anche informazioni sui parametri temporali (MTT, TTP, Tmax) e semiquantitativi (CBV, CBF) dopo la somministrazione di un bolo di contrasto. Nella risonanza magnetica, la “penombra” ischemica è definita da una differenza tra il disturbo di perfusione nelle mappe MTT o TTP e il disturbo di diffusione, come un cosiddetto “mismatch di diffusione-perfusione” [2].
Quale imaging è appropriato?
Nelle attuali linee guida del 2018 [4], le Associazioni americane per il cuore e l’ictus (AHA/ASA) raccomandano che qualsiasi paziente con sospetto ictus acuto debba sottoporsi in primo luogo a una TAC del cranio nativo per escludere un’emorragia intracranica. L’imaging delle arterie carotidee e vertebrali extra e intracraniche è appropriato nei potenziali candidati alla trombectomia meccanica per pianificare la procedura, ma non deve ritardare la somministrazione di alteplase per via endovenosa, se indicato.

Inoltre, nei pazienti con occlusioni prossimali di grandi dimensioni nella circolazione anteriore e nella finestra temporale tra 6-24 ore dall’insorgenza dei sintomi, si raccomanda l’imaging di perfusione mediante TC o RM per l’indicazione di una possibile trombectomia meccanica. Oggi, l’imaging può essere effettuato ad alta velocità. Inoltre, i candidati alla trombectomia non possono essere identificati con sufficiente affidabilità clinica. Per questo motivo, nel paziente con ictus acuto utilizziamo un protocollo di risonanza magnetica con imaging di perfusione e di diffusione, oltre all’imaging dei vasi cerebrali. Per somministrare il bolo di lisi i.v., l’esame RM può essere interrotto brevemente dopo aver escluso l’emorragia. Nella pratica clinica quotidiana, la scelta dell’imaging dipende principalmente dall’infrastruttura disponibile e dall’esperienza del rispettivo centro.
Tuttavia, la valutazione iniziale con la risonanza magnetica offre alcuni vantaggi: Con la DWI, la risonanza magnetica offre una visualizzazione sensibile molto precoce del parenchima cerebrale ischemico ed è chiaramente superiore alla TAC in questo senso. La risonanza magnetica è chiaramente superiore alla TAC anche nel sospetto clinico di infarti infratentoriali nel tronco encefalico e nel cervelletto [10]. I pazienti con deficit neurologici difficili da classificare clinicamente possono quindi essere differenziati in modo affidabile in pazienti con ischemia acuta o con un “ictus mimico”, come l’emicrania emiplegica, la paralisi di Todd o la malattia dei nervi cranici [11]. Per il rilevamento di altre cause rare di ictus, come la dissezione vascolare, la displasia fibromuscolare o la trombosi venosa sinusale o cerebrale, è preferibile la risonanza magnetica. La classificazione temporale superiore dell’infarto nella risonanza magnetica consente una decisione più differenziata in merito alla terapia interventistica. Gli effetti potenzialmente dannosi delle radiazioni ionizzanti e degli agenti di contrasto TC contenenti iodio sono un altro fattore importante nella scelta appropriata dell’imaging. I principali svantaggi della risonanza magnetica sono il tempo di esame più lungo, di circa 15 minuti, rispetto alla TAC multimodale che dura circa 5 minuti, nonché la più difficile fattibilità con i pazienti che richiedono un monitoraggio e i pazienti irrequieti. Se l’idoneità alla risonanza magnetica del paziente è dubbia, in questa situazione acuta si dovrebbe eseguire una TAC.
Messaggi da portare a casa
- Le informazioni rilevanti per la terapia provenienti dalla diagnostica per immagini sono: Esclusione dell’emorragia, rilevamento dell’ischemia o del nucleo dell’infarto, “penombra” se necessario, occlusione del vaso e lunghezza del trombo. La TAC e la risonanza magnetica rispondono a queste domande e vengono utilizzate nella pratica clinica quotidiana, principalmente a seconda dell’infrastruttura esistente e dell’esperienza della rispettiva clinica.
- La risonanza magnetica è molto utile per valutare i pazienti con deficit neurologici difficili da classificare clinicamente e con sospetta ischemia del tronco encefalico.
- I pazienti con deficit neurologici in regressione devono anche ricevere un work-up completo dell’ictus e la diagnostica per immagini. L’esperienza dimostra che questi pazienti possono peggiorare rapidamente dal punto di vista clinico.
- Secondo le nuove linee guida AHA/ASA, un protocollo per l’ictus con TAC o risonanza magnetica dovrebbe includere serie native per escludere l’emorragia e/o rilevare l’ischemia, oltre all’imaging vascolare. Tuttavia, quest’ultima non dovrebbe ritardare la trombolisi endovenosa, se indicata.
Letteratura:
- Ufficio federale della sanità pubblica, Indicatori di qualità degli ospedali acuti svizzeri, Indicatori di qualità numero di casi: B1.1.M HD Ictus tutte le forme (età >19), 2015 (www.bag.admin.ch/bag/de/home/service/zahlen-fakten/zahlen-fakten-zu-spitaelern/qualitaetsindikatoren-der-schweizer-akutspitaeler/qualitaetsindikatoren-fallzahl.exturl.html/aHR0cDovL3d3dy5iYWctYW53LmFkbWluLmNoLzIwMTZfdGFnbG/FiLzIwMTZfc3BpdGFsc3RhdGlzdGlrL3BvcnRhbC5waHA_cD1x/aWZhbGx6Jmxhbmc9ZGUmYmFza2V0PSU3Q2IxLjElN0MwJnF5PT/IwMTY=.html)
- DeLaPaz RL, et al: Criteri di appropriatezza ACR sulla malattia cerebrovascolare. J Am Coll Radiol 2011; 8(8): 532-538.
- Saver JL: Il tempo è cervello – quantificato. Stroke 2006; 37: 263-266.
- Powers WJ, et al: Linee guida 2018 per la gestione precoce dei pazienti con ictus ischemico acuto: una linea guida per gli operatori sanitari dell’American heart Association / American Stroke Association. Stroke 2018; 49: e46-e110. doi: 10.1161/STR.0000000000000158.
- Astrup J, et al: Soglie nell’ischemia cerebrale – la penombra ischemica. Stroke 1981; 12(6): 723-725.
- Knash M, et al: Il basso volume ematico cerebrale è predittivo della restrizione della diffusione solo nell’ictus iperacuto. Stroke 2010; 41(12): 2795-2800.
- Riedel CH, et al.: L’importanza delle dimensioni: il successo della ricanalizzazione mediante trombolisi endovenosa nell’ictus anteriore acuto dipende dalla lunghezza del trombo. Stroke 2011; 42(6): 1775-1777.
- Morita N, et al: Risultati ischemici della risonanza magnetica T2* pesata a 3 tesla nei pazienti con ictus acuto. Cerebrovasc Dis 2008; 26(4): 367-375.
- Allen LM, et al: Risultati di risonanza magnetica specifici della sequenza che sono utili nella datazione dell’ictus ischemico. Radiographics 2012; 32(5): 1285-1297.
- Wintermark M, et al: Raccomandazioni di imaging per i pazienti con ictus acuto e attacco ischemico transitorio: una dichiarazione congiunta della Società Americana di Neuroradiologia, dell’American College of Radiology e della Società di Chirurgia NeuroInterventistica. J Am Coll Radiol 2013; 10(11): 828-832.
- Birenbaum D, Bancroft LW, Felsberg GJ: Imaging nell’ictus. West J Emerg Med 2011; 12(1): 67-76.
CARDIOVASC 2018; 17(2): 16-19