Le immunoterapie mirate possono essere utilizzate per l’artrite psoriasica (PsA), la psoriasi (PsO) e la dermatite atopica (AD).1-3 I dati attuali su queste opzioni di trattamento all’avanguardia sono stati presentati al Congresso annuale dell’Accademia Americana di Dermatologia (AAD) 2022 a Boston, Massachusetts, USA.
Le persone con malattie infiammatorie croniche della pelle spesso non soffrono solo dei sintomi fisici e delle comorbidità della loro malattia, ma anche dello stress psicologico associato. In generale, questo va di pari passo con una qualità di vita gravemente ridotta.4, 5 Le opzioni terapeutiche per le dermatosi infiammatorie, che mostrano una grande eterogeneità nel decorso e nella gravità, sono state a lungo limitate ai corticosteroidi topici (TCS) e all’immunosoppressione non specifica.1 Tuttavia, negli ultimi anni, i progressi nella comprensione della fisiopatologia hanno portato allo sviluppo di biologici e inibitori della Janus chinasi (JAKi), che consentono un’immunoterapia mirata.1-3
Risankizumab nella PsA: analisi degli studi di fase III KEEPsAKE
L’inibitore selettivo dell’IL-23 risankizumab (RZB; SKYRIZI®) è stato approvato in Svizzera dal marzo 2022 come monoterapia o in combinazione con farmaci antireumatici modificanti la malattia non biologici (csDMARDs) per i pazienti adulti con PsA che hanno avuto una risposta inadeguata o sono intolleranti a uno o più DMARDs.2 Gli studi cardine di fase III, randomizzati, in doppio cieco e controllati con placebo (PBO), KEEPsAKE-1 e KEEPsAKE-2, hanno analizzato l’efficacia e la tollerabilità del farmaco biologico in pazienti adulti affetti da PsA, che hanno ricevuto dosi sottocutanee di 150 mg di RZB alle settimane 0, 4 e 16. Mentre KEEPsAKE-1 includeva solo i pazienti che avevano risposto in modo inadeguato a ≥ 1 csDMARD, KEEPsAKE-2 includeva anche i pazienti con una risposta inadeguata a ≤ 2 DMARD biologici (bDMARD).
In KEEPsAKE-1, il 57,3% dei pazienti in terapia con RZB e il 33,5% dei pazienti in terapia con PBO (p<0,001) hanno raggiunto l’endpoint primario dello studio, ossia un miglioramento di almeno il 20% secondo i criteri dell’American College of Rheumatology (ACR 20) a 24 settimane. In KEEPsAKE-2, questo risultato è stato raggiunto dal 51,3% dei pazienti nel gruppo RZB e dal 26,5% dei pazienti nel braccio PBO (p<0,001). In entrambi gli studi, meno dell’1% dei pazienti in terapia con RZB ha sviluppato effetti collaterali che hanno portato all’interruzione del trattamento.6, 7
Al Congresso AAD di quest’anno, è stato esaminato in modo più approfondito l’effetto della terapia con RZB nella PsA sui risultati riferiti dai pazienti(PRO). Sono state presentate anche le indagini sulladifferenza minima clinicamente importante ( MCID) raggiunta con il trattamento.
- Miglioramento della qualità della vita, della fatica e della produttività lavorativa con RZB 8
Gli studi KEEPsAKE-1 e KEEPsAKE-2 hanno misurato i PRO relativi alla qualità di vita correlata alla salute (HRQoL), alla fatica e alla produttività sul lavoro. Secondo un’analisi in pool, sia l’HRQoL che la fatica sono migliorate significativamente con RZB rispetto al gruppo PBO nelle prime 24 settimane di trattamento. Ad esempio, la differenza tra i gruppi RZB e PBO in EQ-5D-5L* è stata di 5,8 ([95% CI: 3,6-8,0]) e nel punteggio FACIT-Fatigue* è stata di 2,5 ([95% KI:1.5-3.4]) (p<0,001 per tutti i punteggi). Con la RZB, i pazienti con WPAI-PsA* hanno mostrato anche una minore compromissione del lavoro, limitazioni dell’attività e presenzialismo rispetto alla PBO.8
- I risultati riferiti dai pazienti sono migliorati anche nei pazienti con un coinvolgimento cutaneo grave. 9
I pazienti di KEEPsAKE-1 e KEEPsAKE-2 che avevano un coinvolgimento cutaneo grave con ≥ 3% di superficie cutanea interessata o un Indice di Area e Severità della Psoriasi (PASI) > 10 hanno ottenuto un miglioramento significativo dell’attività della malattia percepita e del dolore con il trattamento con RZB rispetto a PBO, secondo un’analisi di sottogruppo integrata dei due studi. Il miglioramento della qualità della vita dopo 24 settimane rispetto al basale, misurato come SF-36 (PCS* 6,3 [95% KI:4.2-8.4] & MCS* 4,4 [95% CI: 2,3-6,6; p<0,001]), l’indice EQ-5D-5L (0,1 [95% CI: 0,1-0,2; p<0,001]) e il punteggio VAS* (8,2 [95% CI: 2,5-13,9; p<0,01]), era anche significativamente più alto con il trattamento RZB rispetto al PBO.9
- Alleviare il dolore e l’infiammazione con RZB 10, 11
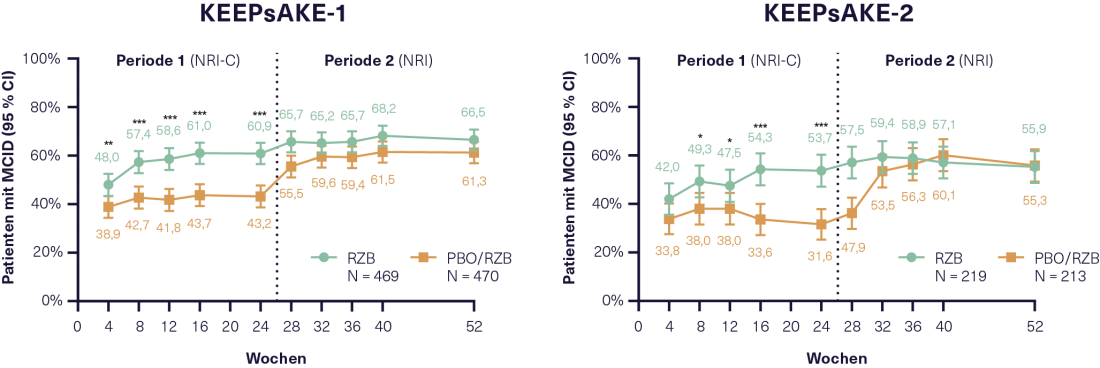
Anche l’efficacia della RZB sull’infiammazione e sul dolore nella PsA è stata al centro del Congresso AAD. In 1407 pazienti con PsA che hanno completato 24 settimane di trattamento in KEEPsAKE-1 e KEEPsAKE-2 e hanno partecipato al successivo studio di estensione in aperto, è stata misurata la diminuzione della proteina C-reattiva (CRP). Questo suggerisce un miglioramento dell’infiammazione con RZB, che si è verificato anche nei pazienti del gruppo PBO una volta passati al trattamento con RZB nello studio di estensione in aperto. Il dolore nelle ultime 24 ore è stato misurato su una scala VAS* orizzontale di 100 mm. In entrambi gli studi, il doppio dei pazienti ha ottenuto un sollievo dal dolore del 30% (‘significativo’), del 50% (‘marcato’) e del 70% rispetto al basale, sia con RZB che con PBO, a 24 settimane. Una riduzione del dolore ≥ 10 mm è stata classificata come MCID. Questo risultato è stato raggiunto nel KEEPsAKE-1 dal 60,9% e nel KEEPsAKE-2 dal 53,7% dei pazienti sottoposti a RZB rispetto al 43,2% e al 31,6% dei pazienti sottoposti a PBO, rispettivamente (p<0,001 in entrambi gli studi)(Figura 1).10 Inoltre, dopo 24 settimane, i pazienti in terapia con RZB avevano maggiori probabilità di raggiungere un MCID in termini di attività della malattia (PtGA*), fatica (FACIT-F*), funzionamento fisico (HAQ-DI*) e salute fisica e mentale (SF-36 PCS e MCS*) rispetto ai pazienti in terapia con PBO.
I dati presentati al Congresso AAD sottolineano l’efficacia clinica di RZB nei pazienti affetti da PsA e illustrano che gli endpoint raggiunti negli studi clinici cardine KEEPsAKE-1 e KEEPsAKE-2 si traducono direttamente in miglioramenti tangibili dell’esperienza riferita dai pazienti.11
Dati a lungo termine e real-world sul trattamento con risankizumab nella PsO
RZB è stato approvato in Svizzera dall’aprile 2019 per il trattamento della PsO a placche da moderata a grave in pazienti adulti che hanno avuto una risposta inadeguata ad altre terapie sistemiche o che hanno una controindicazione o intolleranza a tali terapie.2 Negli studi randomizzati, in doppio cieco, controllati con placebo di fase III UltIMMa-1 e UltIMMa-2, i pazienti che hanno ricevuto un’iniezione sottocutanea di 150 mg di RZB alle settimane 0, 4, 16, 28 e 40 hanno mostrato una risposta migliore rispetto ai pazienti dei gruppi PBO e ustekinumab. Pertanto, il 74,6% dei pazienti sottoposti a RZB ha ottenuto una risposta PASI 90. Con ustekinumab, il 47,5% e con PBO il 2% dei pazienti ha raggiunto questo obiettivo (p<0,0001). Il profilo di sicurezza di RZB era paragonabile ai profili di sicurezza di ustekinumab e PBO.12 Altri studi testa a testa hanno dimostrato l’efficacia superiore dell’RZB rispetto all’adalimumab (studio IMMvent), al secukinumab (studio IMMerge) e agli esteri di acido fumarico (NCT03255382) nei pazienti con PsO da moderata a grave.13-15 Al Congresso AAD sono stati presentati i dati attuali dell’estensione aperta di questi studi per oltre 4,5 anni fino ad oggi, oltre ai risultati del mondo reale.
- Studio di estensione LIMMitless
Lo studio di estensione LIMMitless, attualmente in corso, ha arruolato 897 dei 955 pazienti che avevano completato uno dei cinque studi di base sopra menzionati. Al momento dell’attuale analisi di 256 settimane, 707 pazienti stavano ancora continuando 12 settimane di trattamento con 150 mg di RZB. In questo modo si è ottenuta un’efficacia buona e sostenuta per tutto il periodo di osservazione. Così, dalla settimana 28 degli studi di riferimento alla settimana 256, l’83% dei pazienti in terapia con RZB ha mostrato una risposta PASI 90 costante e il 52% una risposta PASI 100 costante(Figura 2). L’elevata efficacia continua della RZB si riflette anche in un miglioramento sostenuto della HRQoL. Oltre il 66% dei pazienti in terapia con RZB ha raggiunto un Indice di Qualità di Vita Dermatologico (DLQI) 0/1 già 16 settimane dopo l’inizio degli studi di riferimento, il che significa che la riduzione della qualità di vita dovuta alla malattia è stata minima o nulla. Questa condizione è stata mantenuta dal 75% dei pazienti durante lo studio LIMMitless. Non si sono verificati nuovi segnali di sicurezza o casi di infezione da Candida, malattia infiammatoria intestinale o tubercolosi attiva con RZB per una durata di esposizione di 4453 anni-paziente in un periodo di osservazione fino a 304 settimane. Nel complesso, il trattamento si è rivelato ben tollerato.16
- Buona risposta all’RZB anche in condizioni reali. 17, 18
Che l’RZB sia anche associato a una buona risposta nella PsO in condizioni reali, è evidente dall’analisi presentata al Congresso AAD dei dati di 205 pazienti con PsO da moderata a grave del Registro della Psoriasi CorEvitas statunitense/canadese, che avevano ricevuto 150 mg di RZB per 12 mesi (+/-3 mesi). I pazienti soffrivano di PsO da una media di 16,7 anni, erano per lo più molto sovrappeso e nel 61,0% dei casi erano stati pretrattati con biologici e immunomodulatori. Dopo 12 mesi, il trattamento con RZB ha mostrato una buona efficacia rispetto agli obiettivi di trattamento orientati al paziente definiti dalla National Psoriasis Foundation (NPF)(Treat-to-Target Skin Clearance Goals). L’89,2% dei pazienti ha ottenuto una risposta NPF accettabile, definita come il 3% o meno di superficie corporea interessata (BSA ≤ 3%), o un miglioramento della BSA del 75% rispetto al basale. Il 70,4% dei pazienti in trattamento con RZB ha raggiunto la risposta target NPF di BSA ≤ 1%. Il raggiungimento degli obiettivi di trattamento definiti dal NPF è stato indipendente dal pretrattamento: il 94,8% e l’85,5% dei pazienti biologici-naïve e biologici-pretrattati, rispettivamente, hanno ottenuto una risposta NPF accettabile e l’81,8% e il 62,4%, rispettivamente, hanno ottenuto una risposta NPF target.17
La maggior parte dei pazienti ha anche ottenuto una pelle priva di sintomi o quasi con la terapia continua con RZB – i punteggi PASI, Investigator’s Global Assessment (IGA) e BSA sono migliorati rispettivamente dell’86,4%, 71,9% e 88,0% nell’arco di 12 mesi (p<0,001 tutti i valori). Il miglioramento delle lesioni cutanee è stato accompagnato da miglioramenti nella fatica, nel dolore, nel prurito, nella qualità della vita e nella limitazione del lavoro/attività. I punteggi VAS* per la fatica e il dolore si sono ridotti rispettivamente del 38,0% e del 75,1%. Il punteggio VAS per il prurito è diminuito del 69,9% (p<0,001 tutti i valori). I pazienti hanno riportato un numero significativamente inferiore di limitazioni sul lavoro secondo il questionario WPAI. Inoltre, più di due terzi dei pazienti (66,7%) hanno raggiunto un DLQI 0/1 dopo 12 mesi di terapia con RZB.18
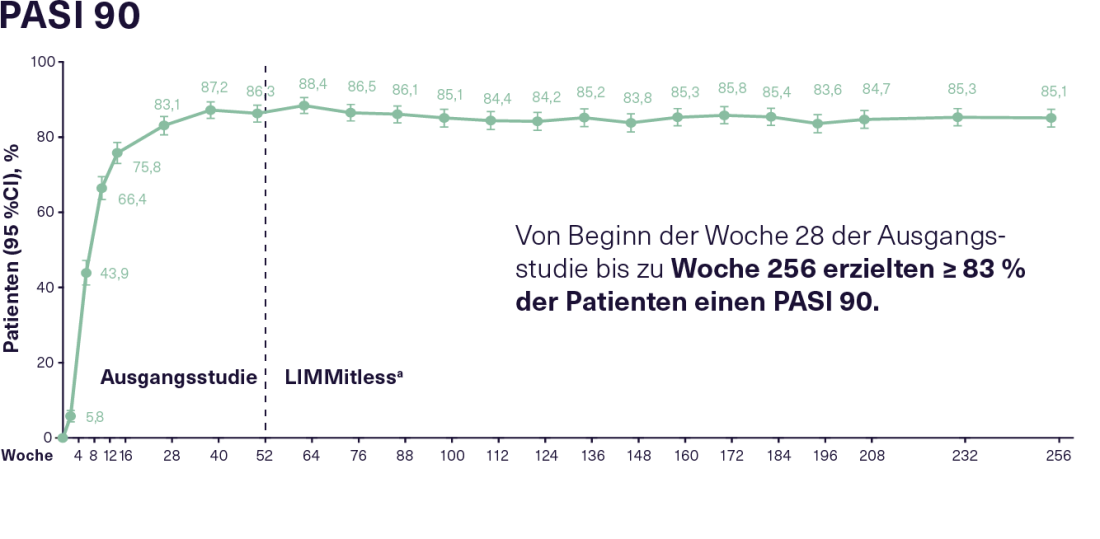
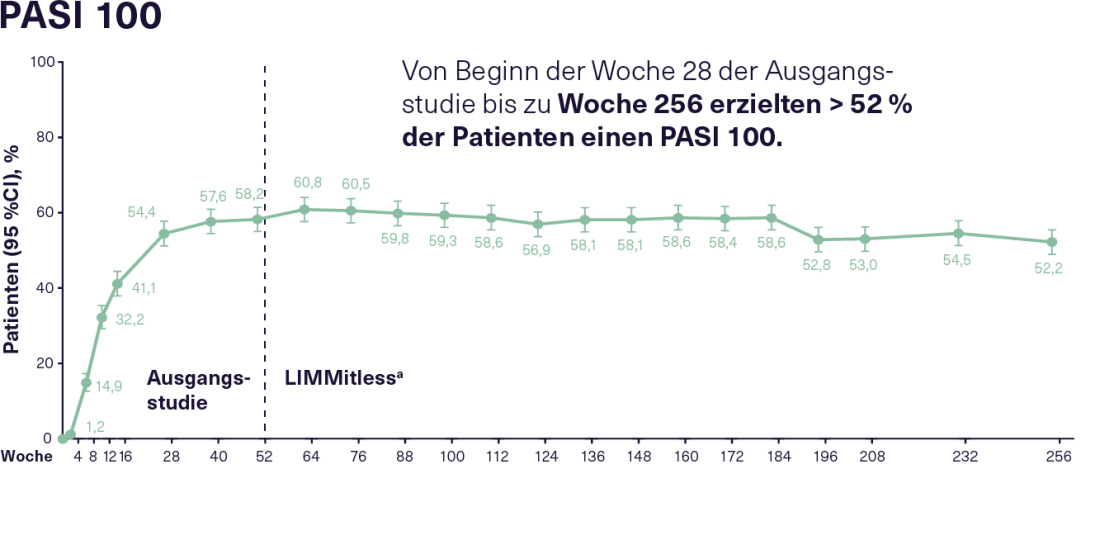 Figura 2: Risposta PASI 90 e PASI 100 nei pazienti con PsO da moderata a grave che hanno ricevuto un trattamento continuo con RZB per un totale di 256 settimane nello studio di estensione in aperto LIMMitless. N= 897 dalla settimana 0 alla settimana 256 (mNRI, imputazione modificata dei non rispondenti). RZB: 150 mg ogni 12 settimane; PASI 90/100: miglioramento del 90/100% dell’Indice di Area e Severità della Psoriasi; PsO: Psoriasi. a A causa delle differenze nella durata degli studi basali, alcuni pazienti sono passati allo studio LIMMitless prima di 52 settimane. Adattato dopo 16.
Figura 2: Risposta PASI 90 e PASI 100 nei pazienti con PsO da moderata a grave che hanno ricevuto un trattamento continuo con RZB per un totale di 256 settimane nello studio di estensione in aperto LIMMitless. N= 897 dalla settimana 0 alla settimana 256 (mNRI, imputazione modificata dei non rispondenti). RZB: 150 mg ogni 12 settimane; PASI 90/100: miglioramento del 90/100% dell’Indice di Area e Severità della Psoriasi; PsO: Psoriasi. a A causa delle differenze nella durata degli studi basali, alcuni pazienti sono passati allo studio LIMMitless prima di 52 settimane. Adattato dopo 16. |
Sicurezza a lungo termine di risankizumab nella PsO e nella PsA19 Il record più ampio e più lungo di sicurezza di RZB fino ad oggi comprende 3197 pazienti con PsO e 1542 pazienti con PsA, per un totale di 9982,6 e 1594,9 anni-paziente (PY), rispettivamente. I tassi di eventi avversi sono stati relativamente bassi in entrambi i gruppi di pazienti. La frequenza degli eventi avversi correlati al trattamento è stata di 158,3 e 160,8 casi per 100 PY nelle popolazioni PsO e PsA, rispettivamente. Gli eventi avversi gravi si sono verificati 7,6 e 8,4 volte in 100 PY, rispettivamente, e gli eventi avversi che hanno portato all’interruzione dello studio si sono verificati 1,9 e 2,3 volte in 100 PY, rispettivamente. I tassi di infezioni gravi, tumori maligni ed eventi cardiovascolari avversi gravi (MACE) nei pazienti PsO e PsA rientravano nei tassi di riferimento per le rispettive popolazioni. Gli eventi avversi più comuni in entrambi i gruppi sono stati le infezioni, in particolare la nasofaringite con 14,5 e 7,9 casi in 100 PY, rispettivamente, e le infezioni del tratto respiratorio superiore con 7,8 e 5,6 casi in 100 PY, rispettivamente.19 |
Aggiornamenti su upadacitinib nell’AD
L’inibitore orale di JAK upadacitinib (UPA; RINVOQ®) agisce in modo specifico su JAK1 e molto meno su JAK2, JAK3 o TYK2. Il principio attivo è indicato nel dosaggio orale di 15 mg una volta al giorno dal novembre 2021 per il trattamento di adulti con MA da moderato a grave, quando la terapia con farmaci topici convenzionali non fornisce un controllo adeguato della malattia o non può essere utilizzata.3 Gli studi di fase III MEASURE Up-1 e MEASURE Up-2, randomizzati, in doppio cieco e controllati con placebo, hanno analizzato l’efficacia e la tollerabilità di 15 mg di UPA una volta al giorno come monoterapia. Dopo 52 settimane, in un’analisi integrata dei due studi, l’80,6% dei pazienti in trattamento con 15 mg di UPA ha mostrato una risposta EASI* 75 e il 62,0% ha mostrato una risposta EASI 90.20 Inoltre, è stata osservata una risposta rapida all’UPA: dopo soli due giorni, un numero significativamente maggiore di pazienti ha riportato un sollievo significativo dal prurito con l’UPA rispetto al PBO.21 Al Congresso AAD, è stata presentata l’analisi dei dati MEASURE Up-1 e MEASURE Up-2, utilizzando il concetto di “treat-to-target”, basato sull’evidenza, sviluppato di recente.
- Il concetto di “Tratta al bersaglio 22
Utilizzando il concetto di “treat-to-target”, che integra i miglioramenti in vari parametri dell’AD relativi all’aspetto della pelle, al prurito e alla qualità della vita23 , sono stati analizzati un totale di 1299 pazienti adulti affetti da AD provenienti da MEASURE Up-1 e MEASURE Up-2, compreso un punteggio EASI di > 7, un DLQI > 5 e un prurito marcato (WP-NRS*). > 4) ha avuto sintomi gravi. La risposta iniziale accettabile (riduzione del PGIS-5* ≥ 1 rispetto al basale e una risposta EASI 50, una riduzione del 50% dello SCORAD* o riduzioni del punteggio WP-NRS, DLQI o POEM* di ≥3, ≥4 e ≥4 rispetto al basale) e sono state valutate le risposte ottimali a 6 mesi (valore assoluto PGIS-5 ≤ 2 e risposta EASI 75, riduzione del 75% del valore SCORAD o valori assoluti WP-NRS, DLQI o POEM di ≤4, ≤5 e ≤7, rispettivamente). Il 79,2% e il 72,4% dei pazienti in trattamento con 15 mg di UPA ha raggiunto la risposta target accettabile iniziale a 3 mesi, rispettivamente alla settimana 2 e alla settimana 16 di trattamento. La risposta ottimale più rigorosa a 6 mesi è stata raggiunta anche dalla netta maggioranza dei pazienti in terapia con UPA a 2 settimane e con percentuali simili a 16 settimane(Figura 4). La risposta rapida e sostenuta al trattamento con UPA è stata dimostrata in dettaglio dal fatto che il 95% dei pazienti aveva già raggiunto il criterio ≥ 1 per la risposta target accettabile a 3 mesi dopo 2 settimane e circa l’80% dei pazienti aveva raggiunto il criterio ≥ 1 per la risposta target ottimale a 6 mesi (p<0,0001 rispetto al PBO).22
Conclusione
I pazienti possono beneficiare della buona efficacia e della sicurezza delle immunoterapie mirate utilizzate nella PsA, PsO e AD.2, 3 Questo è evidente nei risultati degli studi oggettivi, ma anche nei risultati riferiti dai pazienti e nei dati dell’analisi del mondo reale.
*Abbreviazioni:
EQ-5D-5L = misura EuroQoL 5 dimensioni
FACIT-Fatigue = Valutazione funzionale della terapia delle malattie croniche-Fatigue
WPAI-PsA = Impairment della produttività e dell’attività lavorativa – questionario PsA
SF-36 = Indagine sulla salute a forma breve a 36 item
PCS/ MCS = Riepilogo componente fisica/ mentale
VAS = Scala analogica visiva
HAQ-DI = Questionario di valutazione della salute-Indice di disabilità
PtGA = Valutazione globale del paziente dell’attività della malattia
EASI = Indice di area e gravità dell’eczema
WP-NRS = Scala di valutazione numerica del prurito peggiore
PGIS-5 = Impressione globale di gravità del paziente
SCORAD = Punteggio della Dermatite Atopica
POEM = Misura dell’eczema orientata al paziente
Letteratura
Le referenze possono essere richieste dai professionisti all’indirizzo medinfo.ch@abbvie.com.
Testo: Dr. sc. nat. Katja Becker
Questo testo è stato realizzato con il sostegno finanziario di AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Contributo online dal 21.07.2022
CH-SKZD-220096_06/2022