Le tecniche chirurgiche utilizzate per trattare la malattia arteriosa periferica (PAVD) sono la tromboendarterectomia e l’innesto di bypass. Quale procedura si utilizza quando, come si svolge l’operazione e cosa bisogna tenere in considerazione?
La malattia arteriosa periferica (PAVD) è una malattia sistemica che porta al rimodellamento strutturale e funzionale dei vasi arteriosi [1]. Ciò comporta una riduzione del flusso sanguigno, che può essere asintomatica per lungo tempo o manifestarsi con sintomi come claudicazione intermittente, dolore ischemico a riposo o cancrena. La correlazione fisiopatologica della PAVD è l’aterosclerosi, un’infiammazione cronica della parete del vaso in cui si deposita una placca composta da lipidi, cellule muscolari lisce e macrofagi a livello subendoteliale. Nel prosieguo, questa placca può portare alla stenosi del lume vascolare o indurre la formazione di trombi locali attraverso la rottura [2].
Trattandosi di una malattia sistemica, la PAVD è spesso associata alla malattia coronarica (CAD) e alla malattia occlusiva cerebrovascolare (CVD). Un indice caviglia-bracciale (ABI) ridotto è associato a un aumento della mortalità cardiovascolare [3]. La prevalenza della PAVD è riferita al 7-15% [4,5]. L’abuso di nicotina, il diabete mellito, l’ipertensione arteriosa e l’ipercolesterolemia sono i fattori di rischio più rilevanti [6].
La classificazione secondo Fontaine si è dimostrata utile per la pratica clinica quotidiana. In base ai sintomi e alle misurazioni dell’ABI e dell’oscillografia, viene fatta una distinzione tra quattro fasi. Gli stadi I (asintomatico, stato dopo una rivascolarizzazione interventistica o chirurgica) e II (claudicazione intermittente) sono situazioni non critiche. Nello stadio III (dolore a riposo) e IV (cancrena), invece, c’è un disturbo critico della perfusione che può portare alla perdita dell’arto se non viene trattato.
Diagnostica
Nell’anamnesi, vengono chiesti la distanza di deambulazione senza dolore ed eventuali fattori di rischio e concomitanti. Inoltre, vengono chiesti il tipo, la localizzazione e l’ora del dolore (dolore notturno da riposo?). L’esame clinico comprende lo stato del polso ipsi e controlaterale, la funzione sensomotoria, il colore della pelle e le lesioni (acrali). L’ABI, la misurazione della pressione di occlusione e l’oscillografia possono essere utilizzate da un lato per confermare il sospetto diagnostico e dall’altro per classificare un disturbo della perfusione non critico e critico. Infine, la sonografia duplex consente di localizzare con precisione la stenosi e di valutarla in termini di estensione e grado. L’angiografia complementare viene utilizzata per confermare i risultati del duplex e per valutare i vasi di ingresso e di uscita in vista di una riparazione con catetere o chirurgica.
Riabilitazione endovascolare o chirurgica?
Nella fase non critica, la terapia consiste nel modificare il profilo di rischio (cessazione della nicotina, controllo del diabete), nella terapia farmacologica nel senso di “miglior trattamento medico” (inibizione dell’aggregazione piastrinica e stabilizzazione della placca) e nell’allenamento alla camminata sotto supervisione. La decisione di un trattamento chirurgico o endovascolare dipende dai sintomi, dalla posizione anatomica, dall’estensione della lesione e dalle condizioni generali del paziente. Nei pazienti asintomatici o con sintomi di claudicazione solo lievi, non si deve eseguire alcun intervento invasivo. L’intervento percutaneo o chirurgico è indicato per:
- Sintomi di claudicazione con riduzione significativa della qualità di vita,
- ischemia critica con imminente perdita dell’arto,
- Precedente rivascolarizzazione chirurgica e nuova stenosi e/o occlusione nell’area operata e nei vasi di afflusso e deflusso.
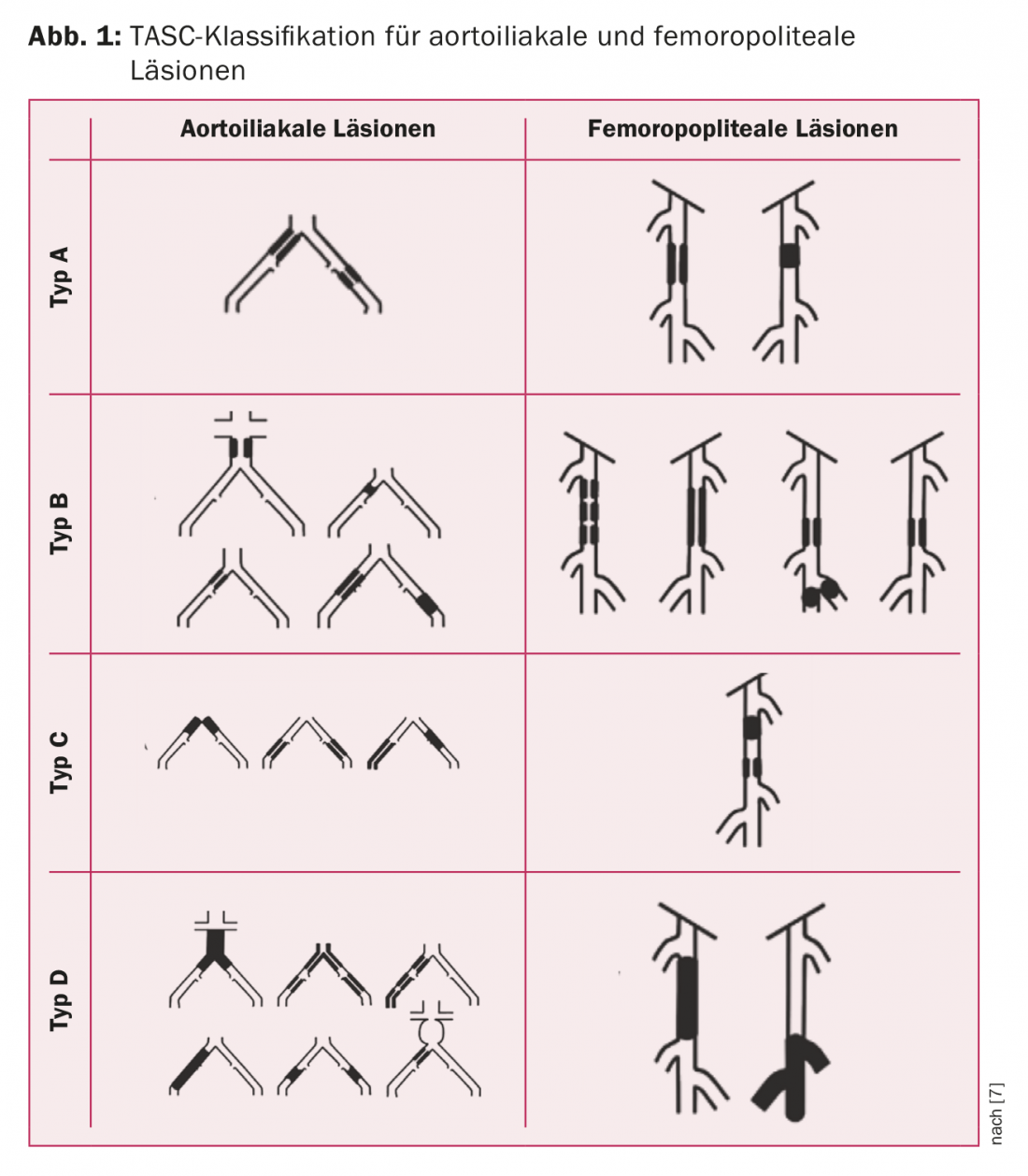
La decisione terapeutica deve essere presa in una discussione interdisciplinare tra le discipline curanti di angiologia, radiologia interventistica e chirurgia vascolare. La base del processo decisionale è la classificazione TASC [7]. Come “regola generale”, le lesioni di tipo A e B dovrebbero essere riparate principalmente per via endovascolare e le lesioni di tipo C e D principalmente per via chirurgica (Fig. 1) . Ulteriori criteri sono l’età e le comorbidità del paziente e la presenza di una vena di buona qualità per il bypass. La Tabella 1 riassume la procedura raccomandata dalle linee guida ESC.

Nelle stenosi sintomatiche isolate della biforcazione femorale, che spesso si presentano come sintomi di claudicazione, la terapia endovascolare è di scarso valore, poiché l’esito è significativamente migliore dopo la riparazione chirurgica. In presenza di un’ulteriore malattia occlusiva iliaca, viene eseguita una procedura ibrida per riparare apertamente la biforcazione femorale e la ricanalizzazione endovascolare retrograda dell’asse iliaco.
La tromboendarterectomia e l’innesto di bypass, o una combinazione di entrambi, sono le procedure chirurgiche utilizzate per trattare la PAVD.
Tromboendarterectomia (TEA)
La localizzazione tipica è la biforcazione femorale. Sia l’arteria femorale comune (AFC) che i rami della profunda femoris (APF) e dell’arteria femorale superficiale (AFS) sono frequentemente interessati. Dopo un approccio leggermente curvo e longitudinale, si prepara l’asse vascolare con la mobilizzazione del pacchetto linfonodale in direzione mediale. L’AFC viene aperto longitudinalmente e l’incisione viene fatta passare nell’AFP, se necessario. Nell’endarterectomia che segue, la placca aterosclerotica viene asportata in modo che rimanga solo l’avventizia come parete del vaso. Un gradino intimo-mediale che si sviluppa distalmente viene fissato con una sutura per evitare la dissezione dopo il rilascio del flusso sanguigno. La chiusura dell’arteriotomia longitudinale avviene con l’inserimento di un patch per evitare la stenosi mediante una sutura diretta. Se è necessaria una TEA di entrambi gli sbocchi APF e AFS, si può eseguire una trasposizione della forcella femorale se l’anatomia è favorevole. Nella stessa seduta, le stenosi emodinamicamente rilevanti dei vasi di entrata e di uscita vengono riparate per via retrograda (asse iliaco) o per via anterograda (asse femoropopliteo) attraverso l’approccio inguinale, utilizzando PTA o stent.
Funzionamento del bypass
L’intervento di bypass è, con poche eccezioni, riservato ai pazienti con PAVD di stadio III e IV ed è il trattamento di scelta per le occlusioni di lunga durata, femoropoplitee e infrageniche. I passaggi seguenti fanno parte dell’esecuzione di un’operazione di bypass:
Imaging preoperatorio: l’angiografia (convenzionale, TC o RM) deve essere disponibile per valutare i vasi di ingresso e di uscita e per pianificare l’anastomosi prossimale e distale. La posizione più comune dell’anastomosi prossimale del bypass femoropopliteo è l’AFC. Se l’anastomosi è distale al tronco tibiofibulare, si utilizza la migliore connessione ‘plantare’. Ciò significa utilizzare l’imaging preoperatorio per decidere quale arteria della gamba inferiore si estende al piede senza stenosi o occlusioni rilevanti. Di conseguenza, viene eseguito un approccio mediale o laterale alla parte inferiore della gamba.
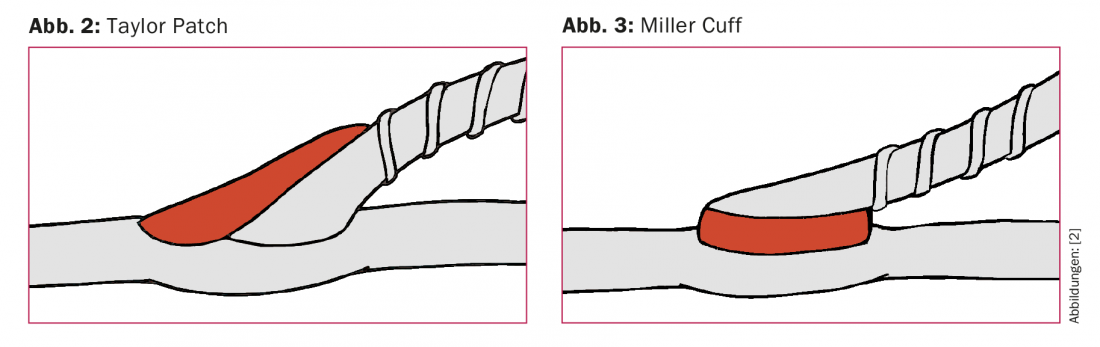
Pianificazione del materiale del bypass: il condotto di scelta è la vena grande safena autologa omolaterale (VSM). Se il calibro è troppo basso o è già stato utilizzato per un’altra procedura, si possono utilizzare in alternativa la VSM controlaterale, la vena safena (VSP) o le vene del braccio. Se necessario, diversi segmenti venosi possono essere combinati per formare un bypass composito. In caso di bypass femoropopliteo con connessione sovragenica al segmento P1, si raccomanda l’uso di una protesi in assenza di VSM [10]. Se la protesi è l’unico materiale di bypass possibile e la connessione è infragenica, un breve segmento di vena deve essere interposto come patch o cuffia nell’area dell’anastomosi distale per migliorare il tasso di apertura [11] (Fig. 2 e 3).
Prelievo della vena: prima dell’intervento, il decorso della vena viene marcato ecograficamente. Se la VSM è omolaterale, l’incisione per il prelievo venoso viene utilizzata anche per accedere al segmento popliteo sopra o infragenico per l’anastomosi.
“Invertito” vs. “Non invertito”: Se si decide di utilizzare la vena “invertita”, il segmento rimosso viene ruotato e l’apertura della valvola avviene ora nella direzione del flusso arterioso. Il vantaggio è che non è necessario resecare le valvole venose. Lo svantaggio, tuttavia, è che l’estremità della vena distale più stretta viene anastomizzata all’arteria di grosso calibro prossimale e viceversa.
Se si sceglie un bypass “non invertito”, le valvole vengono valvulotomizzate dopo il prelievo della vena. Questo può essere fatto angioscopicamente per valutare contemporaneamente la vena a livello endoluminale (accumulo di trombi, sclerosi della parete).
Esiste una situazione particolare con il bypass in situ. Qui la VSM viene lasciata nella sua duplicazione fasciale e i rami laterali marcati preoperatoriamente vengono legati attraverso piccole incisioni. Le estremità prossimali e distali della vena sono sufficientemente mobilizzate per il collegamento arterioso. Anche in questo caso, è necessaria una valvulotomia.
In letteratura non c’è una chiara preferenza per nessuna delle tecniche descritte. Nel nostro ospedale, il bypass viene solitamente eseguito con una tecnica “non invertita” dopo una precedente valvulotomia controllata angioscopicamente lungo l’asse del vaso.
Percorso di bypass: si distingue tra percorso di bypass anatomico (ortotopico) ed extra-anatomico. Il bypass femoropopliteo deve, se possibile, essere posizionato ortotopicamente nel percorso dell’asse del vaso nativo. È importante evitare di torcere o attorcigliare la vena diretta distalmente. I bypass extra-anatomici spesso corrono sottocutanei e lontani dall’asse del vaso vero e proprio. Ne sono un esempio il bypass axillofemorale o il bypass crossover per i processi di occlusione aortoiliaca. Di solito si tratta di pazienti con un rischio perioperatorio elevato, una situazione infettiva non sanata nel corso dell’asse vascolare o molteplici interventi precedenti.
Anastomosi: in genere, le anastomosi prossimali e distali vengono create in una configurazione end-to-side (E/S). Qui, l’estremità della vena viene cucita nell’arteria che è stata arteriotomizzata longitudinalmente. Il vantaggio è che la perfusione ante e retrograda dei collaterali prossimali e distali viene mantenuta.
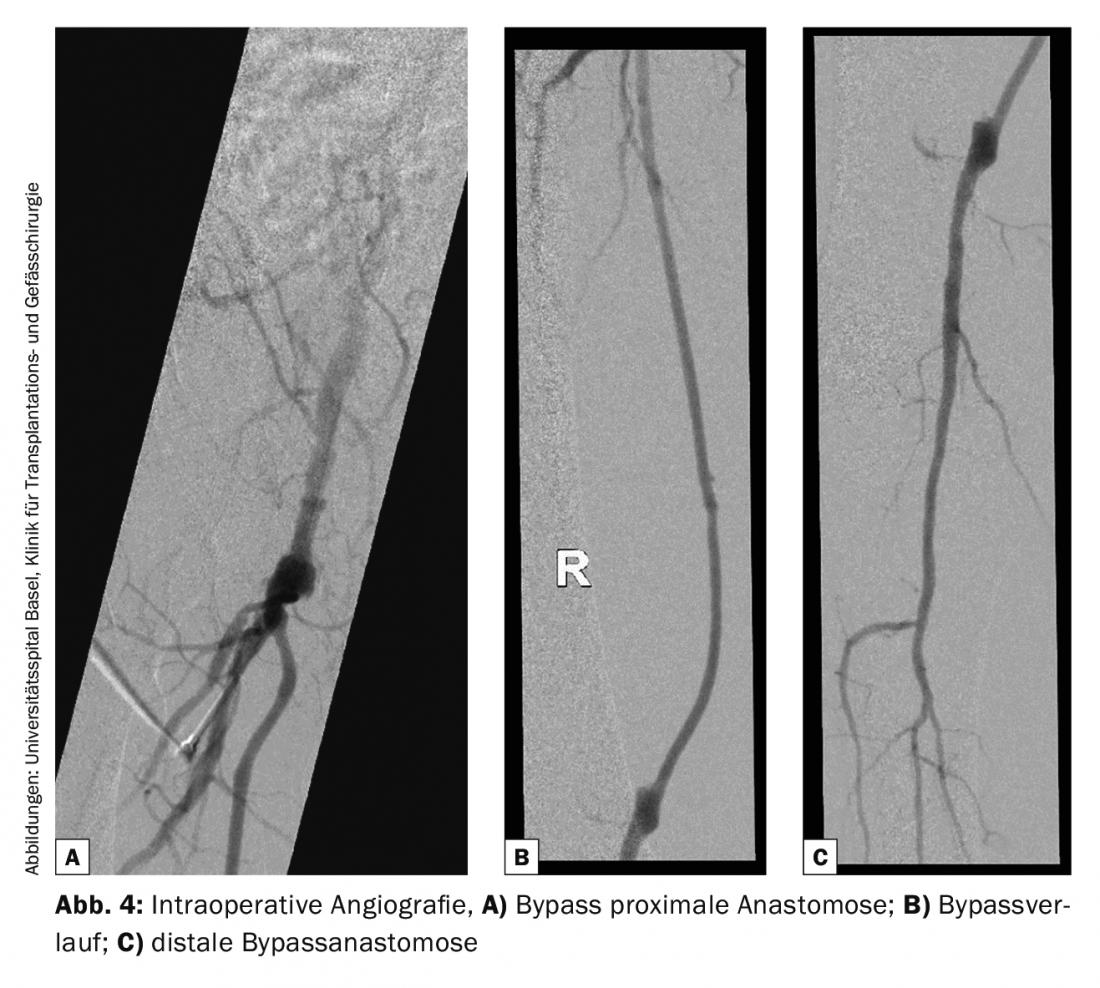
Controllo del bypass: il controllo intraoperatorio del bypass viene effettuato da un lato con il dispositivo Doppler e dall’altro angiograficamente per valutare le anastomosi, nonché il decorso del bypass e la situazione di deflusso nella parte inferiore della gamba. L’angiografia non è standard in tutte le cliniche (Fig. 4).
Gestione post-operatoria: il controllo post-operatorio del bypass viene eseguito con una sonografia duplex dopo tre, sei e dodici mesi, annualmente se la funzione del bypass è buona. Per quanto riguarda l’inibizione piastrinica e l’anticoagulazione orale dopo il bypass, esistono diversi approcci terapeutici. Lo studio olandese BOA ha dimostrato che non vi era alcuna differenza significativa tra Aspirina® e Marcoumar® nel tasso di bypass infrarenale. Tuttavia, in un’analisi di sottogruppo, i pazienti con un condotto venoso hanno mostrato un tasso di apertura migliore con l’anticoagulazione orale, mentre i pazienti con bypass protesici hanno avuto un esito migliore con la terapia antiaggregante [12].
Nella nostra clinica, i pazienti con un collegamento di bypass distale fino al tronco tibiofibulare incluso, di solito ricevono l’Aspirina®, a meno che non ci sia già un’anticoagulazione orale dovuta a un’altra indicazione. Quando viene creato un bypass venoso con una connessione crurale o pedale distale, i pazienti vengono anticoagulati per via orale. Tutti i pazienti con bypass protesici ricevono Aspirina® o Plavix®, se necessario, in aggiunta all’anticoagulazione preesistente.
Messaggi da portare a casa
- La PAVD è spesso associata a CHD e CVI. Una diminuzione dell’ABI è associata a un aumento della mortalità cardiovascolare.
- Mentre gli stadi I e II rappresentano una situazione di circolazione non critica, gli stadi III e IV possono portare alla perdita dell’arto se non trattati.
- L’esecuzione di una terapia endovascolare o chirurgica primaria dipende dalla posizione e dall’estensione della lesione, dalle condizioni generali, dal rischio perioperatorio, dall’aspettativa di vita del paziente e dalla presenza di una vena di buona qualità (dispositivo di bypass).
- Le tecniche chirurgiche per trattare la PAVD includono la tromboendarterectomia (TEA) e l’innesto di bypass nei casi di occlusione a lungo segmento e di perfusione critica. Se necessario, le due procedure vengono combinate. Se necessario, la rivascolarizzazione con catetere dei vasi di ingresso e di uscita viene eseguita nella stessa seduta.
- I pazienti con bypass venoso crurale o pedale devono ricevere un’anticoagulazione orale nel post-operatorio, mentre i pazienti con bypass protesici devono ricevere una terapia antiaggregante singola o doppia.
Letteratura:
- Donnelly R, Powell J: Epidemiologia e gestione dei fattori di rischio della malattia arteriosa periferica. In: Chirurgia vascolare ed endovascolare, 5a edizione. Edimburgo: Saunders Elsevier, 2014: 1-15.
- Owens C: Aterosclerosi. In: Chirurgia vascolare di Rutherford, Volume 1, 8a edizione. Philadelphia: Saunders Elsevier 2014: 66-77.
- McKenna M, Wolfson S, Kuller L: Il rapporto tra la pressione arteriosa alla caviglia e al braccio come predittore indipendente di mortalità. Aterosclerosi 1991; 87: 119-128.
- Fowkes F, et al: Edinburgh Artery Study: Prevalenza della malattia arteriosa periferica asintomatica e sintomatica nella popolazione generale. Int J Epidemiol 1991; 20: 384-392.
- Newman AB, et al: Indice caviglia-braccio come marcatore di aterosclerosi nel Cardiovascular Health Study. Gruppo di ricerca collaborativa Cardiovascular Heart Study (CHS). Circolazione 1993; 88: 837-845.
- Bhatt DL, et al: Prevalenza internazionale, riconoscimento e trattamento dei fattori di rischio cardiovascolare nei pazienti ambulatoriali con aterotrombosi. JAMA 2006; 295: 180-189.
- Norgren L, et al: Consenso intersocietario per la gestione della malattia arteriosa periferica (TASC II). J Vasc Surg 2007; 45: 5-67.
- Aboyans V, et al: Linee guida ECS 2017 sulla diagnosi e il trattamento delle malattie arteriose periferiche, in collaborazione con la Società europea di chirurgia vascolare (ESVS). European Heart Journal 2018; 39: 763-816.
- Adam AJ, et al: Bypass rispetto all’angioplastica nell’ischemia grave della gamba (BASIL): studio multicentrico, randomizzato e controllato. Lancet 2005; 366: 1925-1934.
- Klinkert P, et al: Vena safena contro PTFE per il bypass femoro-popliteo sopra il ginocchio. Una revisione della letteratura. Eur J Vasc Endovasc Surg 2004; 27: 357-362.
- Griffiths GD, et al: Studio clinico randomizzato della cuffia di interposizione venosa anastomotica distale nell’innesto di bypass infrainguinale in politetrafluoroetilene. Br J Surg 2004; 91: 560-562.
- Studio BOA olandese: Efficacia degli anticoagulanti orali rispetto all’aspirina dopo un intervento di bypass infrainguinale (The Dutch Bypass Oral Anticoagulants or Aspirin Study): uno studio randomizzato. Lancet 2000; 355: 346-351.
CARDIOVASC 2018; 17(5): 22-25